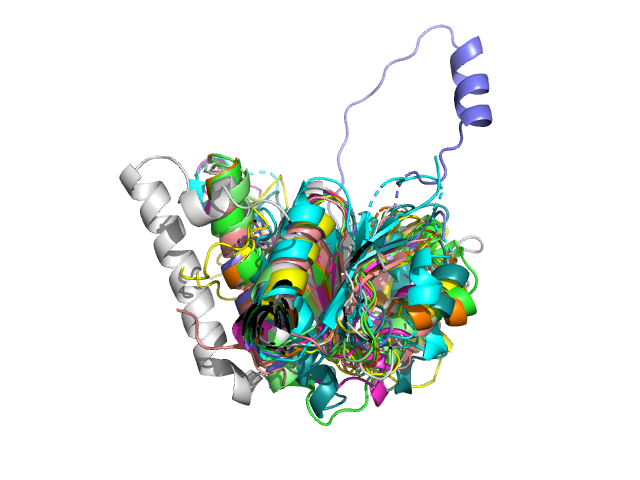

На рис.1 мы видим, что во всех случаях наблюдается чередование альфа-спиралей и бета-тяжей, однако сама последовательность и конкретное число элементов вторичной структуры различаются, в целом я считаю, что здесь имеет место общий фолд бета-альфа-бета.
Задание 2. Работа с разметкой вторичной структуры в ручном режиме
На рис.2 мы видим, что участок, выделенный желтым цветом, в двух структурах соответствует месту изгиба, опосредующего переход альфа-спирали в бета-лист. Для структуры 4kxwA03 dssp Pymol`а в этом месте выделил петлю, тогда как для второй - 3,10-спираль. Из общих соображений эта спираль соответствует наблюдаемым в других структурах в плане небольшой протяженности, локализации. Рассмотрим поближе связи, удерживающие эту структуру:
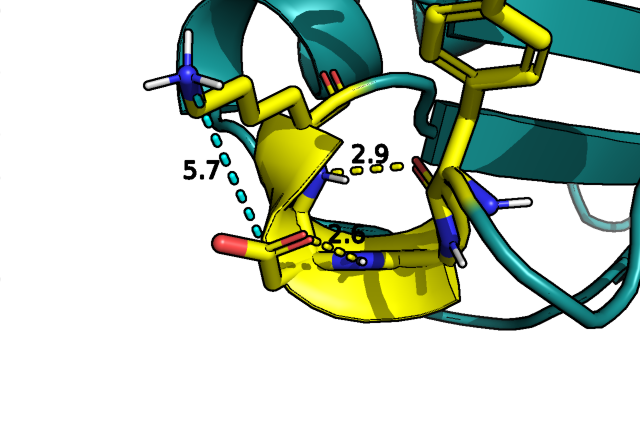
Как мы видим на рис.3 спираль удерживается характерной для нее водородной связью между остовами i-го остатка (здесь тирозина) и i + 1 (здесь лизина), большую роль также могут играть водородная связь между боковой группой и остовом аспартата и солевой мостик того же остатка с лизином, таким образом, боковая группа аспартата, предположительно, играет роль связующего звена между боковой группой лизина и остовом соседнего с ним аспартата, способствуя поддержанию структуры спирали.
Теперь посмотрим на соответствующий участок структуры 4kxwA03:
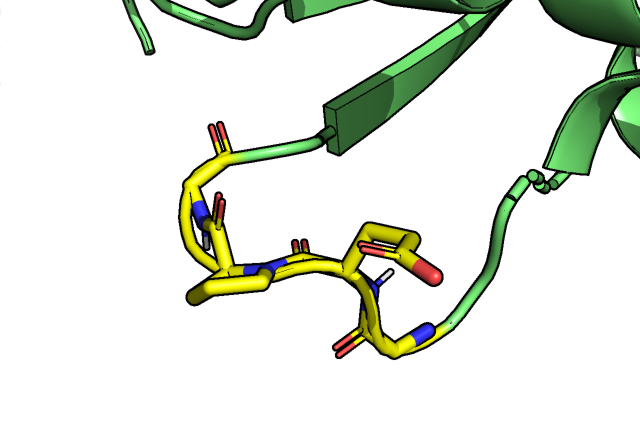
Как мы видим на рис.4, для структуры 4kxwA03 на этом участке присутствуют пролин, который сам по себе в силу отсутствия водорода при азоте остова не способствует формированию 3,10-спирали, и глицины, которые также не могут обеспечить возможную спираль дополнительными взаимодействиями на концах.
Как итог, по моему мнению, разметка 3,10-спирали на этом участке для структуры 5exeA02 и отсутствие ее в другом случае является оправданным.
Задание 3. Работа с разметкой вторичной структуры в автоматическом режимеВ этом задании надо было воспользоваться уже знакомой программой dssp и, используя возможности python, на основе датасета из 10 PDB посчитать склонность каждого типа аминокислотного остатка образовывать тот или иной тип вторичной структуры. Ссылка на скрипт: parse_dssp.ipynb. Таблица по всем типам аминокислот:propensity_table.txt.
По итогам работы были выделены остатки, которые показывали предпочтение в формировании той или иной вторичной структуры.
Во всех случаях в Таблице 1 брались аминокислоты, для которых склонность к формированию конкретной вторичной структуры была максимальной по другим остаткам и при этом являлась максимальной для данного типа аминокислотного остатка.
В случае петель глицин проявлял заметную склонность к этому типу по сравнению с остальными (для альфа-спиралей склонность: 0.2954, для бета-листов: 0.6499), что кажется логичным, так как в случае глицина нет дополнительной стабилизации структур за счет боковой группы, и этот остаток очень маленький, что способствует формированию подвижных структур. Здесь можно добавить, что среди остатков, максимальная склонность которых была к формированию петель, глицин не далеко ушел от того же пролина ( propensity: 1.5570), что также представляется разумным, так как, как уже упоминалось ранее, в силу отсутствия водорода на остовном азоте пролина, этот остаток не способствует формированию спиралей (непролиновых) и бета-листов, характеризующихся наличием структурированной сети водородных взаимодействий остова.
В случае альфа-спиралей метионин также несильно опережал другие аминокислотные остатки с максимумом для этой структуры, однако тут зависимость мне не совсем ясна, можно предположить, что этот остаток в данной выборке играл роль дополнительной стабилизации спиралей за счет гидрофобных взаимодействий, но вообще глобальные выводы, основываясь на нашей маленькой выборке, делать не корректно, то есть этот результат просто может быть продиктован особенностями данного датасета.
Для бета-листов фаворитом оказался валин, что также может трактоваться либо в рамках усиления взаимодействий в структуре, либо в рамках особенностей выборки.
©Makarikova Olga 2020