Исследование вторичной структуры белка LUXS_BASCU (PDB ID 1IE0).
Первый Семестр
1. Общее описание вторичной структуры LUXS_BACSU (PDB ID 1IE0).
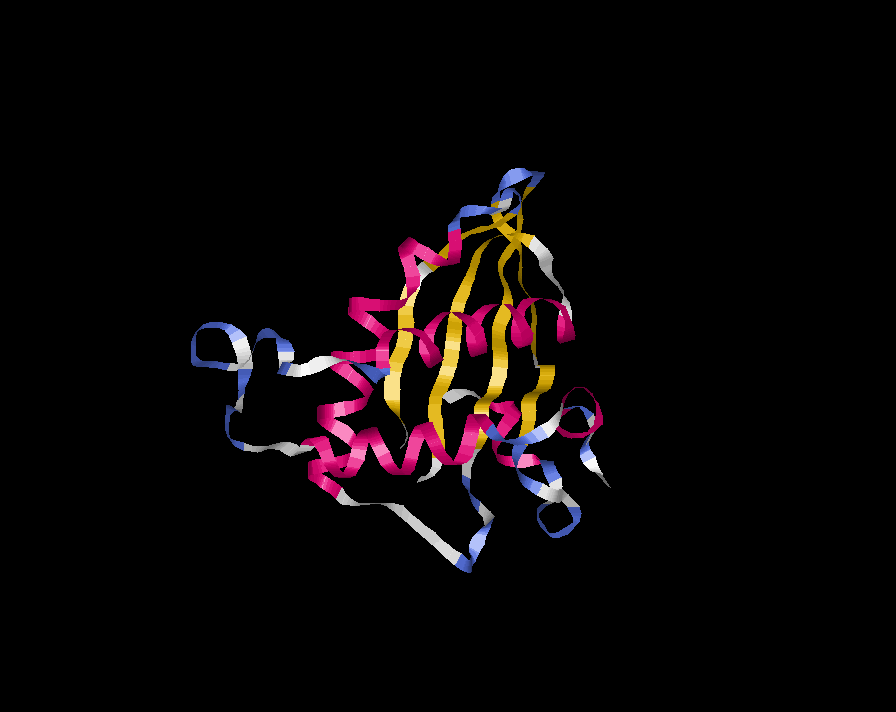
Белок относится к группе α+β-белков,т.к. регулярности в чередовании α-спиралей и β -слоев не наблюдается.
α-спиралей - 5(розовый)
β-тяжей - 6(желтый)
реверсионных поворотов - 17(синий)
Для исследования выбраны элементы вторичной структуры:
α-спираль: 98-112:A
антипараллельные β-тяжи: 34-39:A, 87-92:A, 78-82:A
параллельных β-тяжеи: ....
β-поворот: 122-126:А
2. Описание α-спирали 98-112:A.
Скрипт helix.spt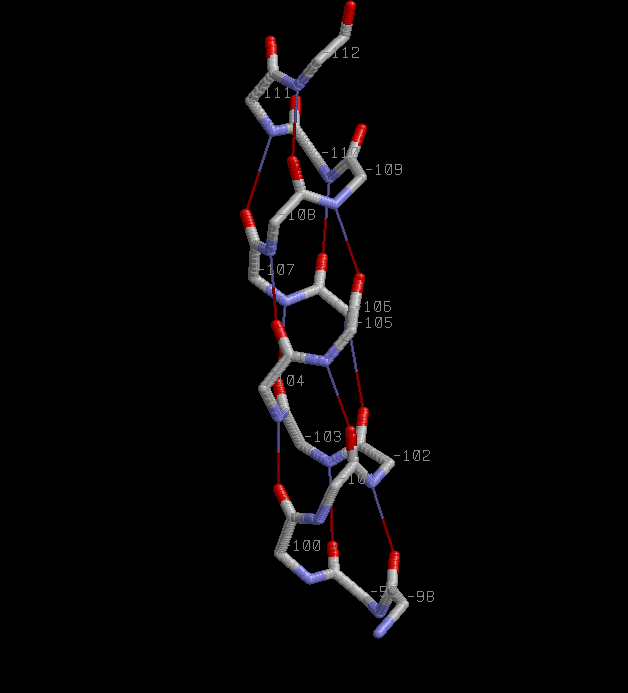 | 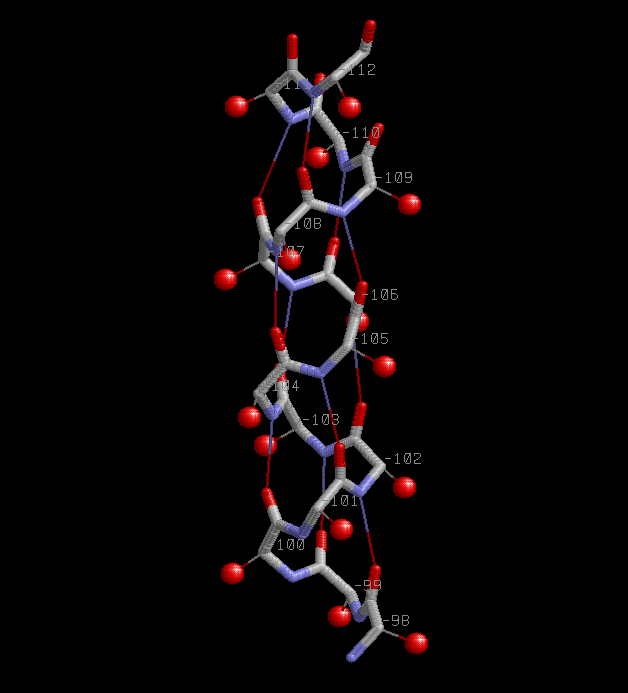 |
| Паттерн водородной связи H(i,i+4),где i=98,99,..,108 - номер а.о.,которому принадлежит атом кислорода. | Все Сβ атомы лежат снаружи спирали. |
3. Описание β-тяжей.
Параллельные β-тяжи 144-148:A,366-370:A,181-186:A.
b-sheet1.spt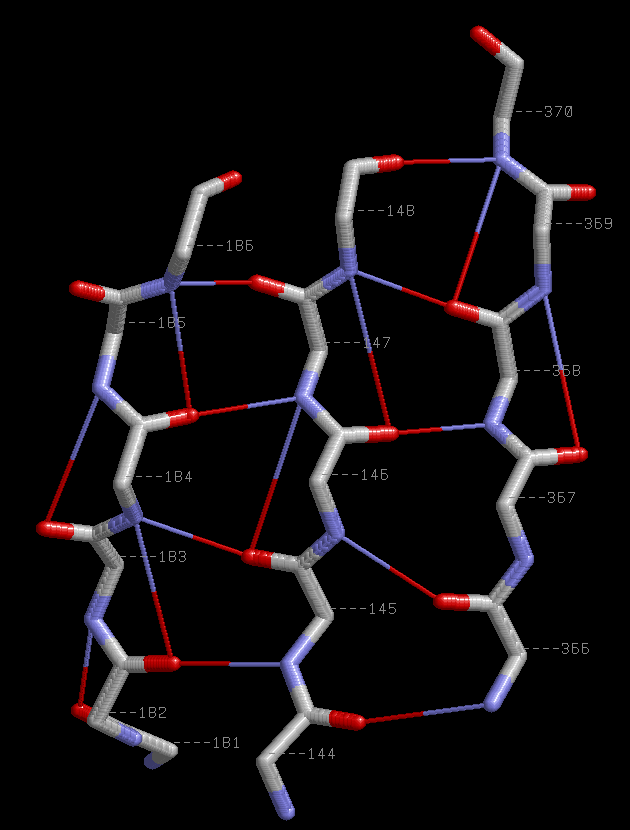 | 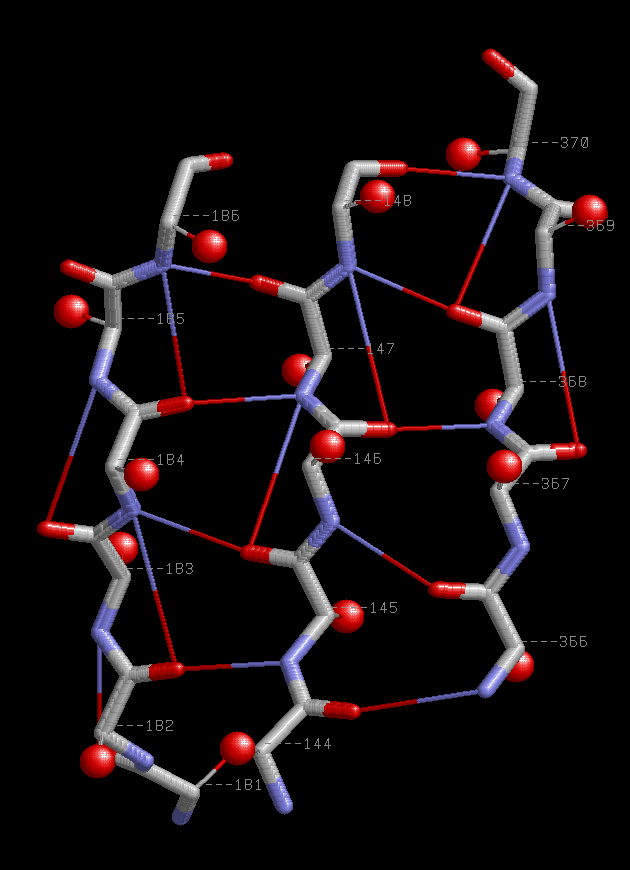 |
| Паттерн водородной связи между левым и центральным тяжами H(n+1+(-1)i;(n-39)+1+(-1)i+1),
а между центральным и правым Н((n-37-1)+1+(-1)i;(n-186)+1+(-1)i+1),где i=1,2,.. - номер связи,
а n - номера атома из правого тяжа,например 182.
Еще встречаются связи паттерна Н(n;n+2),где n - номер атома кислородда,а (n+2) - номер атома азота того же тяжа. Например 145.O - 147.N |
Сβ атом n-ого остатка лежит с одной стороны от плоскости β-слоя,а (n+1) - c другой.
Сβ атомы остатков,расположенных в разных цепях на одном уровне,распологаются практически на одной прямой. |
Антипараллельные β-тяжи 34-39:A, 87-92:A, 78-82:A.
b-sheet2.spt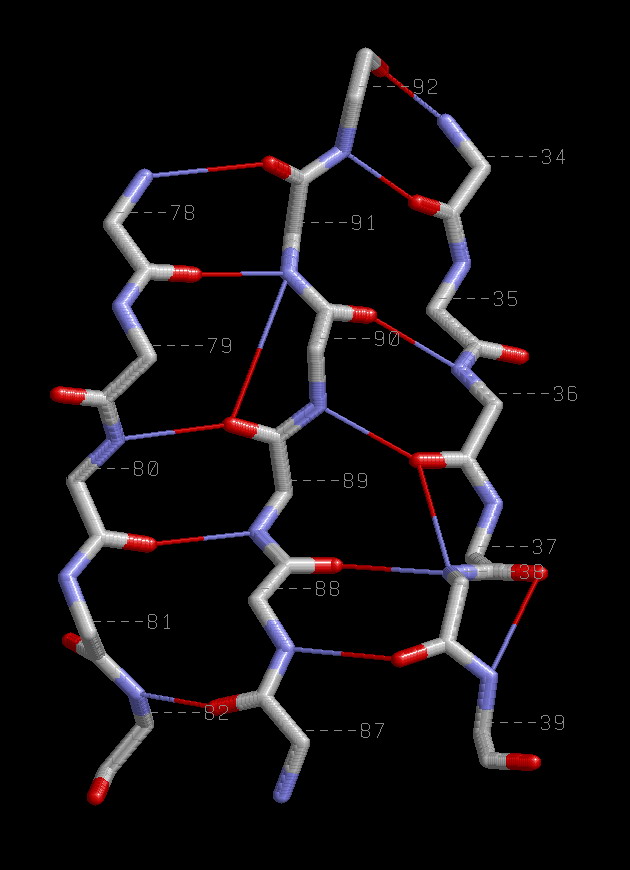 | 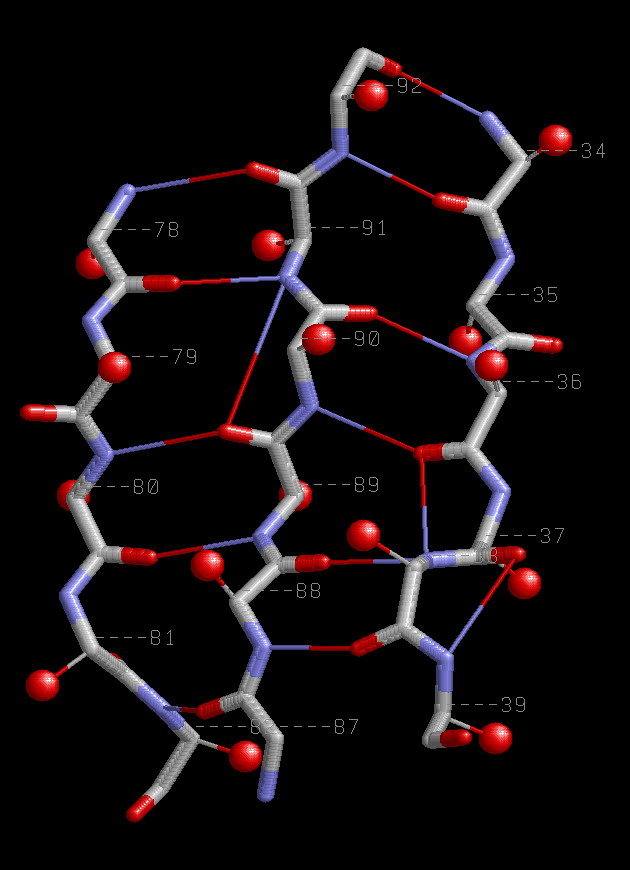 |
| Паттерн водородных связей между левым и центральным тяжами H(n+1+(-1)i;m-1-(-1)i),а между центральным и правым - Н((m+1)+1+(-1)i;k-1-(-1)i),где i=1,2,.. - номер связи,
а n,m,k номера атомов из левого,центрального и правого тяжей соответственно. Например 78,91,34. | Располодение Сβ атомов аналогично их расположению у параллельных β-тяжей. |
4. Описание реверсионного поворота(β-поворота).

выбранный Сβ-поворот - Asn122Glu123Lys124Gln125Cys126.
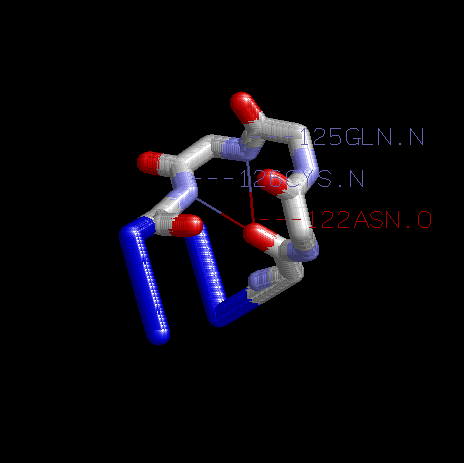
В данном повороте есть 2 Н-связи:между карбонильным кислородом 122 остатка аспарагина и амидным азотом 125 остатка глутамина(122ASN.O-125GLN.N)
и между тем же кислородом и амидным азотом 126 остатка цистеина(122ASN.O-126CYS.N).