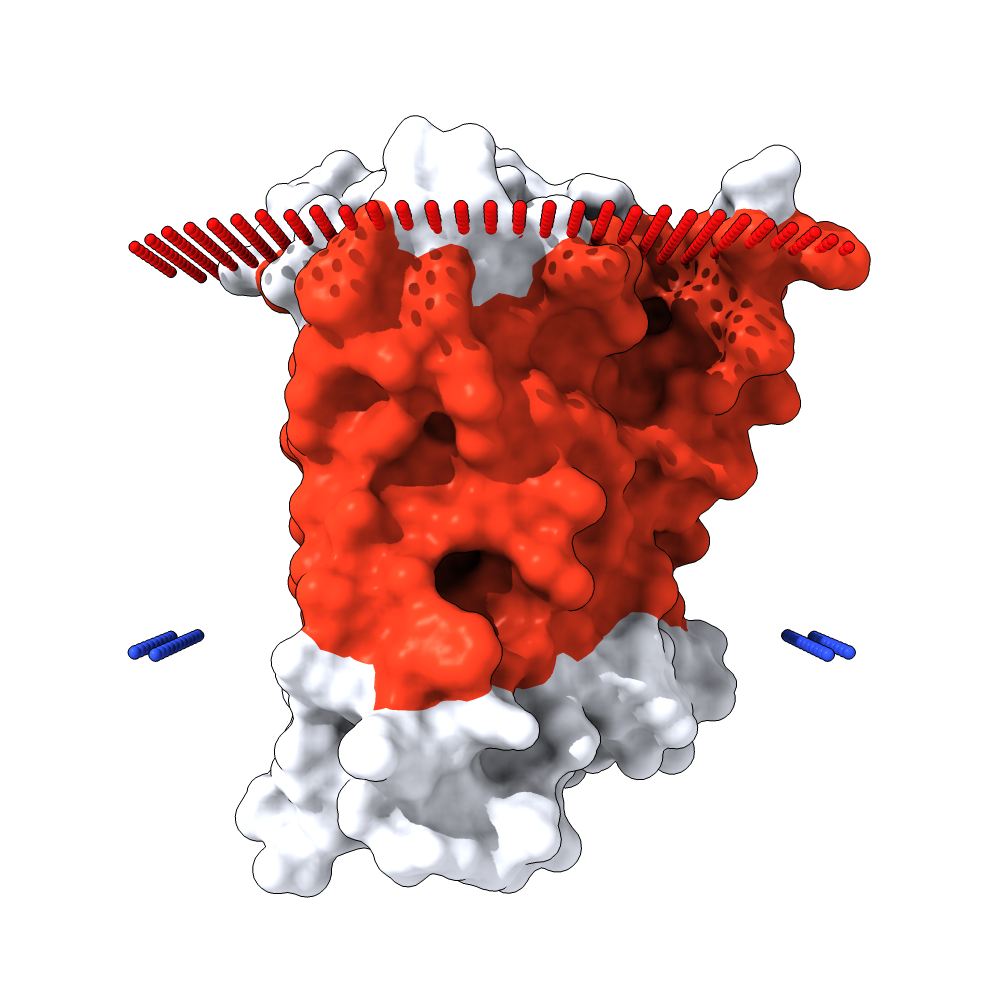
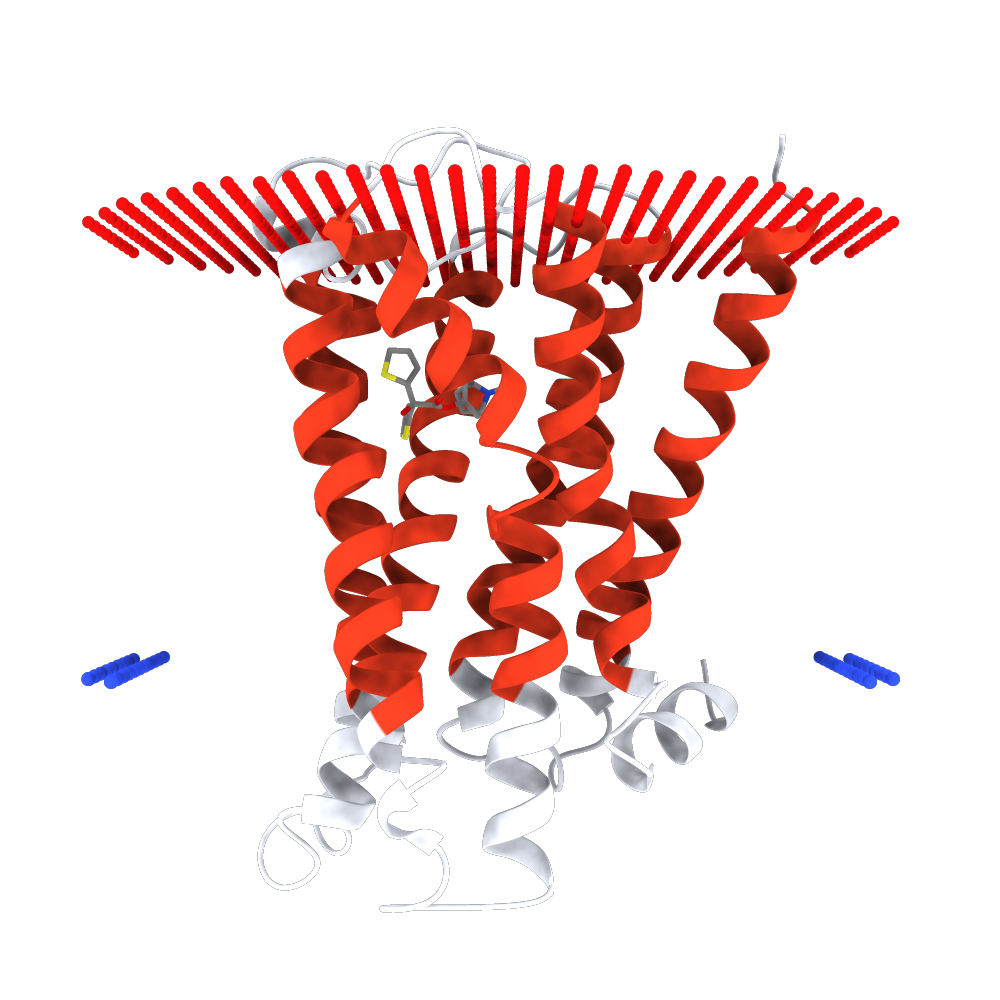
Для изучения структуры трансмембранных белков был использован белок - M3-mT4L рецептор(Muscarinic acetylcholine receptor M3). Этот рецептор служит посредником
для многих клеточных сигналов,
включая ингибирование аденилатциклаз, распад фосфоинозитидов и модуляцию калиевых каналов посредством G-белков.
На рисунках 1, 2 и 3
представлены его изображение, структура и расположение в мембране соответственно.
 |
 |
| Рис.1 Белок M3-mT4L receptor в мембране клетки. | Рис.2 Белок M3-mT4L receptor в мембране клетки. |
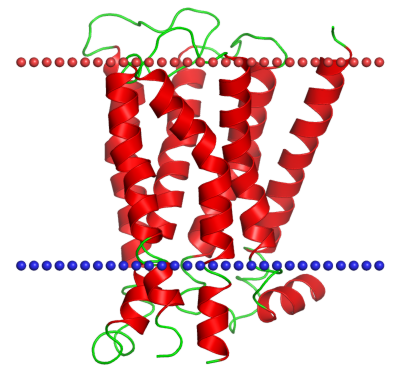
Рис.3 Белок M3-mT4L receptor в мембране клетки.
С помощью поиска по уровням классификации было необходимо найти любой белок, в трансмембранной части которого находятся ẞ-листы и описать оба белка
по заданным параметрам.
В качестве белка с ẞ-листами был выбран 1AF6 - мальтопорин из того же организма(Escherichia coli). В таблице ниже приведены описания белков, а также
изображения их расположения
по отношению к мембране. Красным цветом показана внешняя часть мембраны, а синим - внутренняя.
| Белок | 4U15 | 1AF6 |
|---|---|---|
| Название | Muscarinic acetylcholine receptor M3 (M3-mT4L рецептор) |
Maltoporin (Мальтопорин) |
| Классификация | Type: 1. Transmembrane Class: 1.1. Alpha-helical polytopic Superfamily: 1.1.001. Rhodopsin-like receptors and pumps Family: 1.1.01.02. G-protein coupled receptors, family A Species: Rattus norvegicus Localization: Eukaryotic plasma membrane |
Type: 1. Transmembrane Class: 1.3. Beta-barrel transmembrane Superfamily: 1.3.018. Sugar porins (n=18,S=22) Family: 1.3.18.01. Malptoporin-like proteins Species: Escherichia coli Localization: Bacterial Gram-negative outer membrane |
| Толщина гиброфобной части мембраны |
31.8 ± 1.5 A | 25.1 ± 0.7 A |
| Трансмембранные спирали/ẞ-тяжи (а.о.) |
1( 65- 90), 2( 105- 129), 3( 138- 163), 4( 185- 206), 5( 230 -251),6( 492- 515), 7( 522- 543) |
3 transmembrane subunits: 1. 1(2-13), 2(39-48), 3(58-68), 4(75-88), 5(98-103), 6(125-132), 7(138-146), 8(170-179), 9(185-194), 10(213-221), 11(227-235), 12(269-278), 13(284-293), 14(305-314), 15(320-329), 16(343-352), 17(361-370), 18(411-420) 2. 1(2-13), 2(39-48), 3(58-68), 4(75-88), 5(98-103), 6(125-132), 7(138-146), 8(170-179), 9(185-194), 10(213-221), 11(227-235), 12(269-278), 13(284-293), 14(305-314), 15(320-329), 16(343-352), 17(361-370), 18(411-420) 3. 1(2-13), 2(39-48), 3(58-68), 4(75-88), 5(98-103), 6(125-132), 7(138-146), 8(170-179), 9(185-194), 10(213-221), 11(227-235), 12(269-278), 13(284-293), 14(305-314), 15(320-329), 16(343-352), 17(361-370), 18(411-420) |
| Среднее количество остатков в одной спирали/тяже |
23 | 8 |
| Мембрана локализации |
Плазматическая мембрана эукариот | Внешняя мембрана Грам-отрицательной бактерии |
| Изображение |  |
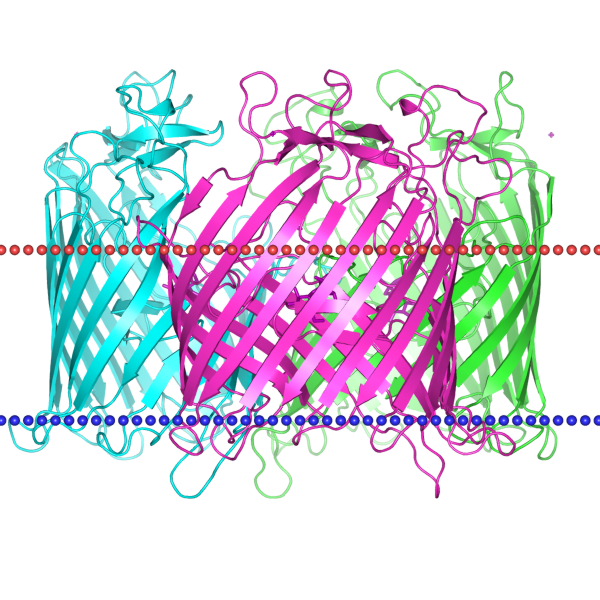 |
В данном задании было необходимо оценить корректность работы сервисов TMHMM и Phobius, предназанченнных для предсказания трансмембранных участков белков.
Для этого оба сервиса были запущены для
белка 4U15 (цепь A), и полученные результаты были сохранены в текстовом и графическом видах.
На рисунках ниже представлена
выдача программы TMHMM. Рассмотрим для начала текстовый формат. Первые несколько строк - статистика различных параметров для данного белка, таких как длина
последовательности,
число предсказанных трансмембранных участков, среднее количество аминокислот в одной цепи и т.д. Также установлена следующая система обозначений: TMhelix - трансмембранная
часть белка,
inside - часть белка, обращенная в цитоплазму, outside - часть белка, обращенная наружу, далее идет перечисление координат для соответствующих участков.
Графическое представление отражает
вероятности того, что та или иная часть белка находится в определенном взаимоотношении с мембраной. На оси Y отображены соответсвующие вероятности, а на
оси Х - аминокислотные остатки белка.
Красным цветом показаны предполагаемые трансмембранные части, розовым - части, обращеннные наружу, синим - части, обращенные внутрь.
Для нашего белка TMHMM предсказал 7 трансмембранных
частей, 4 наружних и 4 внутренних, что соответствует информации, содержащейся в базе данных OPMR. Координаты предсказанных трансмембранных
спиралей совпадают с настоящими достаточно хорошо
с погрешностью в среднем 2-3 а.о.
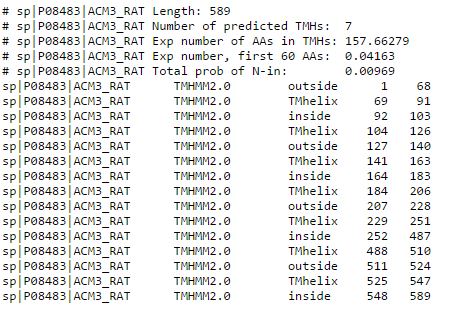
Рис.4 Выдача программы TMHMM для белка 4U15 в текстовом виде.
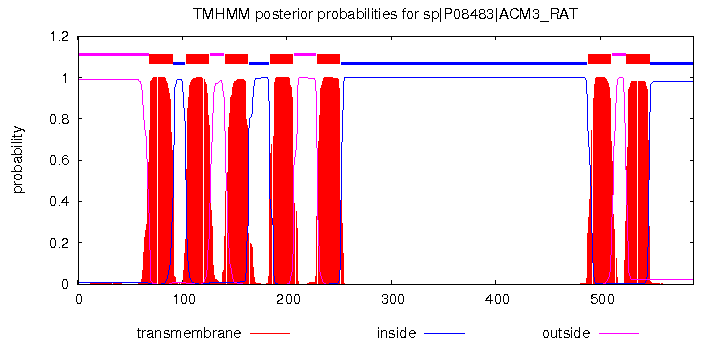
Рис.5 Выдача программы TMHMM для белка 4U15 в графическом виде.
Рассмотрим теперь выдачу Phobius. В тестовом формате заданы следующие обозначения: TRANSMEM - трансмембранная часть, CYTOPLASMIC - часть белка, обращенная в цитоплазму,
NON CYTOPLASMIC - часть
белка, обращенная наружу. В графическом формате все аналогично предыдущей программе с некоторым изменением цветовой схемы: серый - трансмембранная часть
белка, зеленый - цитоплазматическая,
синий - наружняя.
На этот раз программа предсказала всего 6 трансмембранных участков, 4 наружних и 3 внутренних. Точность предсказанных координат чуть меньше,
чем при работе сервиса TMHMM: погрешность составляет
в среднем 5-6 а.о.
Для данного белка обе программы сработали неплохо, однако точность работы сервиса TMHMM в данном случае выше.
Он правильно предсказал все 7 участков с небольшой погрешностью в координатах.
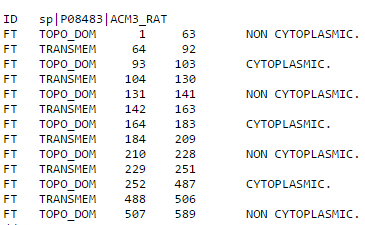
Рис.6 Выдача программы Phobius для белка 4U15 в текстовом виде.
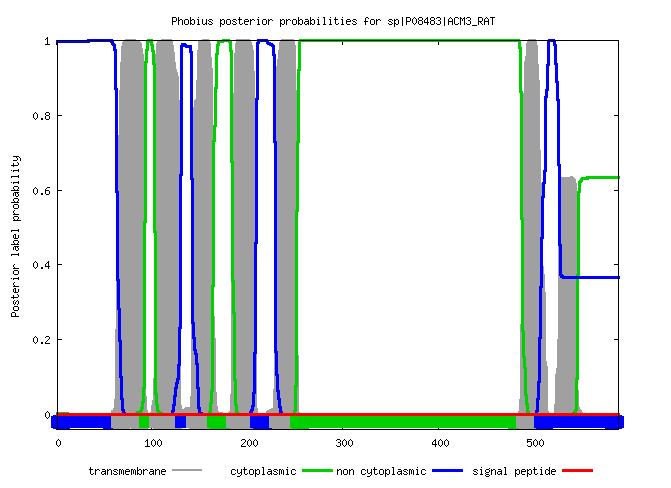
Рис.7 Выдача программы Phobius для белка 4U15 в графическом виде.
В следующем задании было необходимо найти описания исследуемых белков в базе данных TCBD (Transporter Classification Database). Эта база предоставляет детальную классификацию мембранных
транспортных белков,
объединяя как функциональные, так и филогенетические данные. В ней представлена информация для более чем 600 семейств транспортных белков. Транспортные системы
классифицируются на основе 5 критериев, каждому
из которых соответсвует один из 5 символов TC-кода.
В норме TC-код состоит из 5 компонентов: V.W.X.Y.Z. V (число) указывает на класс транспортера (например канал, первичный активный транспортер и т. п.), W (буква)
указывает на подкласс,
X (число) - на семейство, Y (число) - на подсемейство, а Z соответсвует собственно транспортеру со специфическими субстратами.
Белок 4U15 в этой базе данных не представлен, но зато там есть
информация по второму белку, 1AF6. 1AF6 имеет следующий TC-код: 1.B.3.1.1.
Пояснения: 1: Класс каналы/поры (Channels/Pores); 1.B: Подкласс ẞ-бочонковые порины (ẞ-Barrel Porins); 1.B.3: Семейство порины сахаров(The Sugar
Porin (SP) Family). Информации по подсемействам
нет.
В базе данных приводится подробное описание всех крупных систематических групп до семейства включительно. Белок 1AF6 является мальтопорином
и принадлежит к семейству поринов для сахаров.
Порины — белки бактериальной наружной мембраны, которые обычно функционируют как каналы трансмембранной диффузии для сахаров, ионов и аминокислот. Количество и тип поринов может изменяться
с изменением условий окружающей среды, регулируя тем самым проницаемость наружной мембраны в ответ на внешний стимул. Порины имеют избирательную химическую селективность для одной молекулы
или группы молекул, что используется бактериями для выработки резистентности к антибиотикам. Для выполнения своей задачи некоторые классы антибиотиков проникают в цитоплазму бактерии через
порин, мутация в гене которого может нарушить транспорт молекулы и выработать резистентный к данному антибиотику штамм.
Источники:
© Avdiunina Polina, 2017