Электронная плотность
Общая информация о белке
Для работы была выбрана структура бактериальной фотолиазы, выделенной из Agrobacterium fabrum (PDB ID: 4U63, разрешение: 1.67Å), которая была выдана для работы в первом семестре. Это один из ферментов репарации ДНК, активация которого происходит под действием видимого света. ДНК-фотолиаза удаляет фотопродукты и пиримидин-пиримидиновые димеры, образующиеся в молекуле ДНК под действием коротковолнового УФ-излучения. Процесс, в котором участвует фермент, называется фотореактивацией. Такие фотореактивирующие ферменты имеются у бактерий и низших эукариотических организмов, но в клетках млекопитающих они не обнаружены: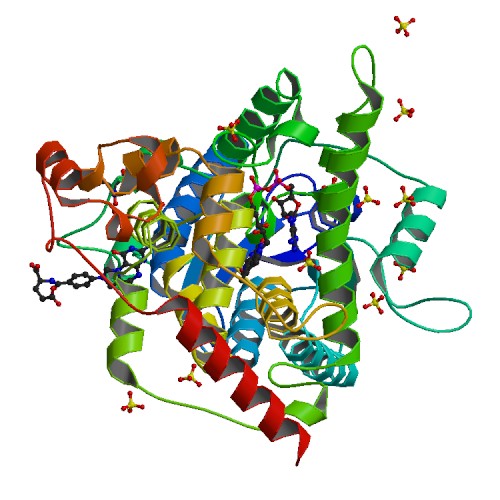
1) Со страницы структуры доступен для скачивания файл с электронной плотностью и файл с экспериментальными данными РСА; 2) При запуске PDBeFold> в таблице находок есть подходящие структуры белков, которые сходны с выбранным: в таблице с находками есть 5 или более разных белков с 0.8 Å ≤ RMSD ≤ 3.0 Å и 247 ≤ Nalgn ≤ 445 (от 50% до 90% числа аминокислот выбранного белка); 3) Доступен текст статьи, опубликованной по результатам расшифровки. Отчет о качестве структуры: скачать.
Электронная плотность вокруг остова
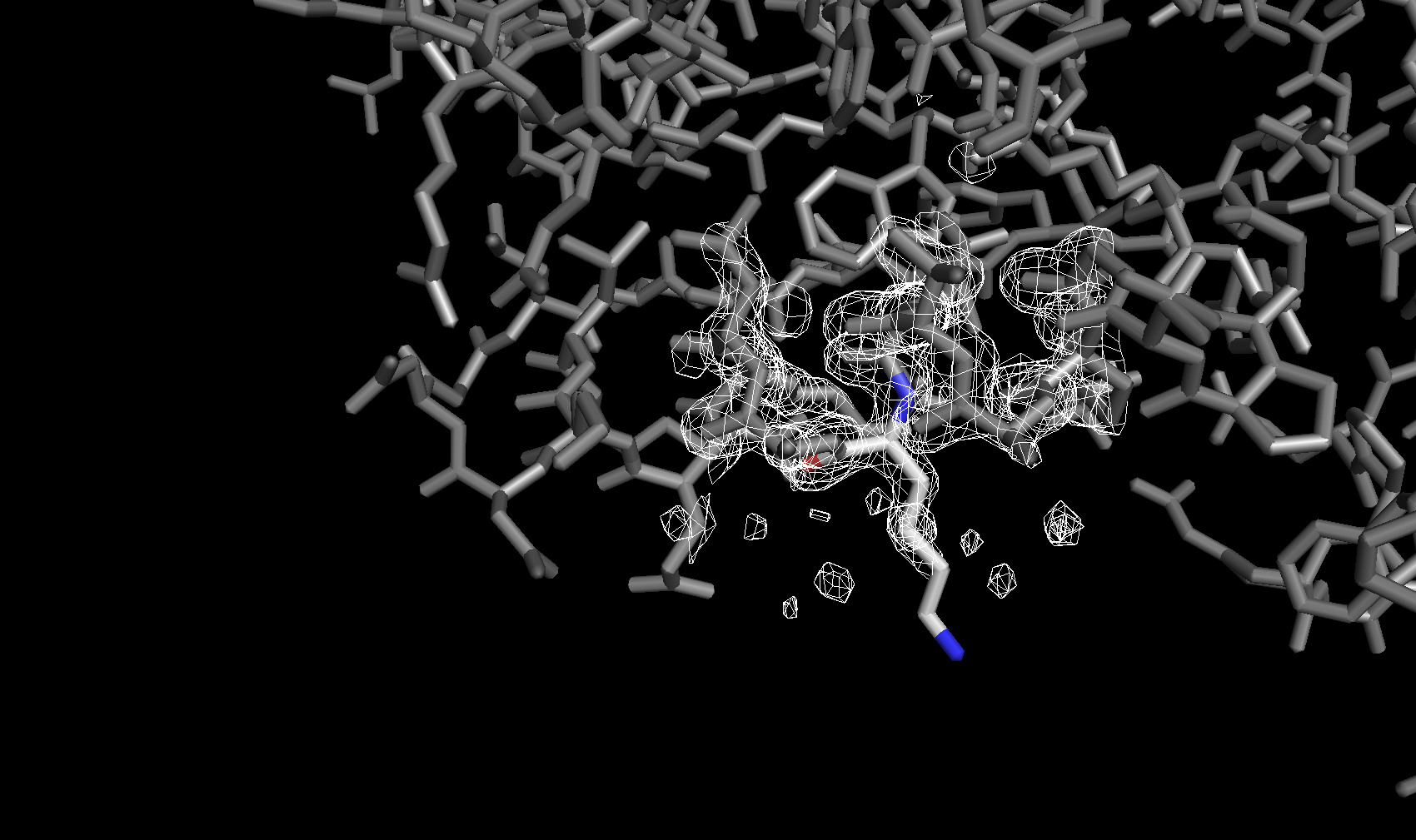
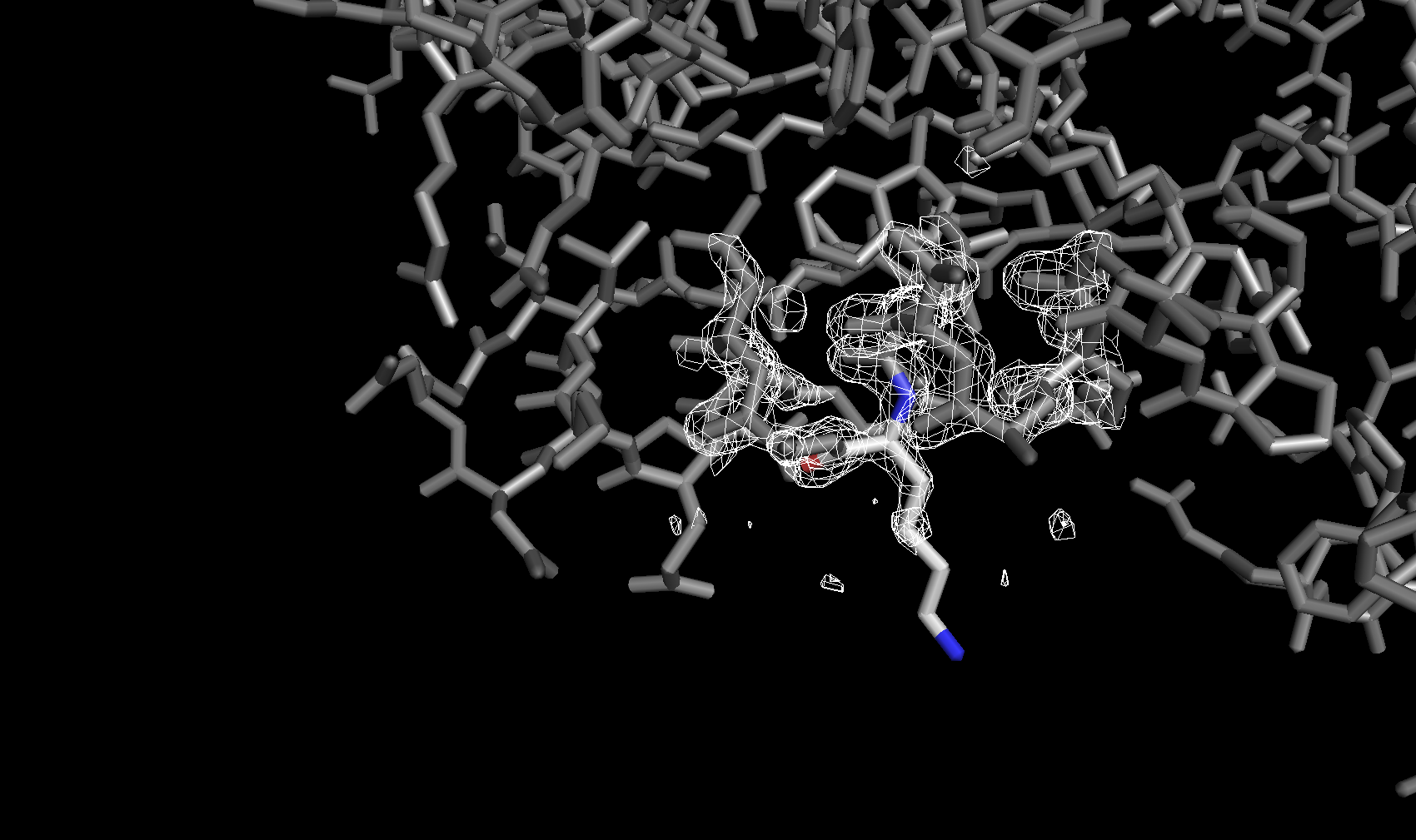
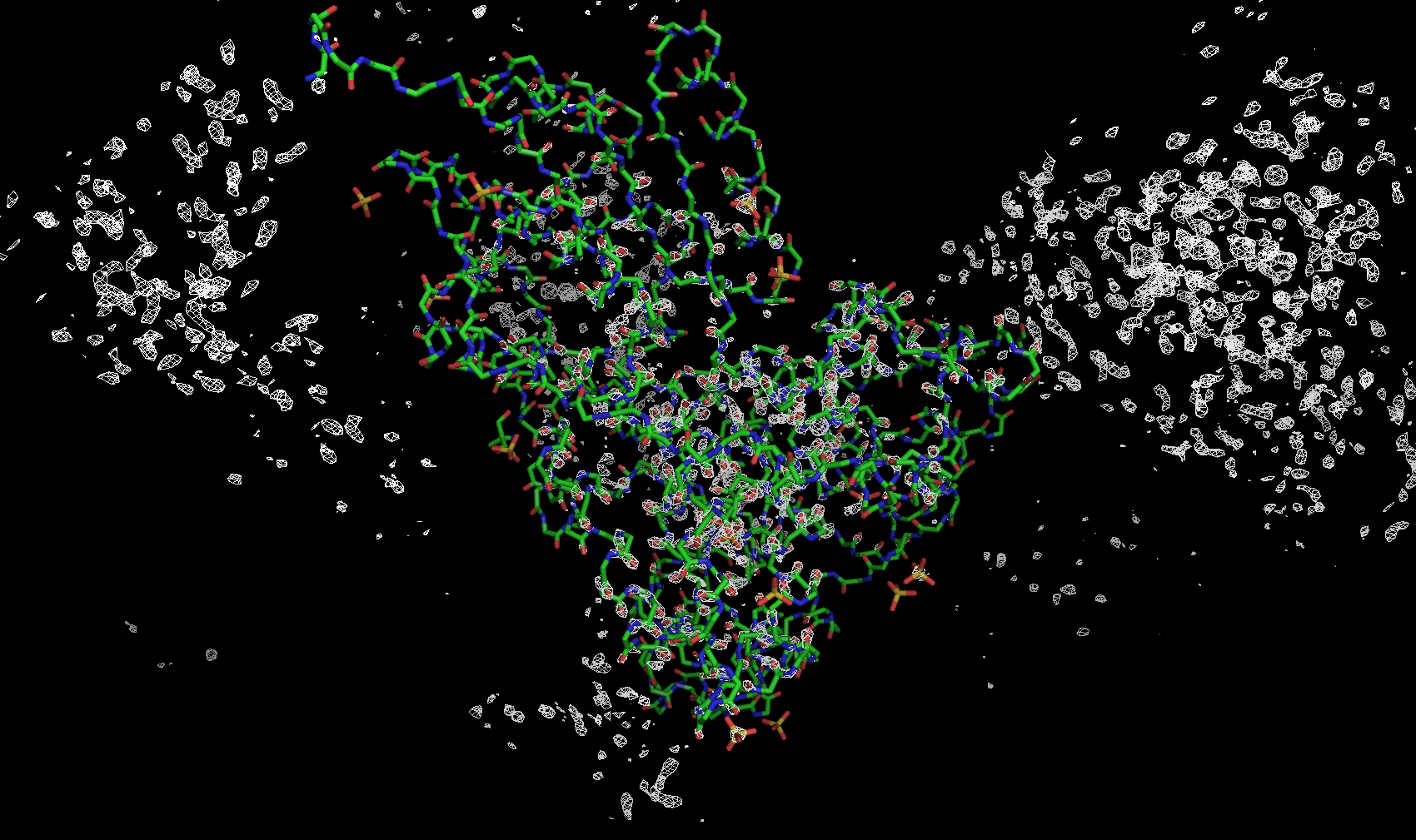
Для визуализации структуры и электронной плотности была использована программа для визуализации биомолекул PyMol. На рисунке ниже показана электронная плотность вокруг остова полипептидной цепи (боковые цепи спрятаны) с разными уровнями подрезки. Уровень подрезки Z = (R – M)/σ — отклонение электронной плотности в данной точке R от среднего значения электронной плотности по ячейке M, выраженное в стандартных отклонениях от среднего значения σ. Приведены изображения с уровнями подрезки 3σ, 4σ и 5σ соответственно.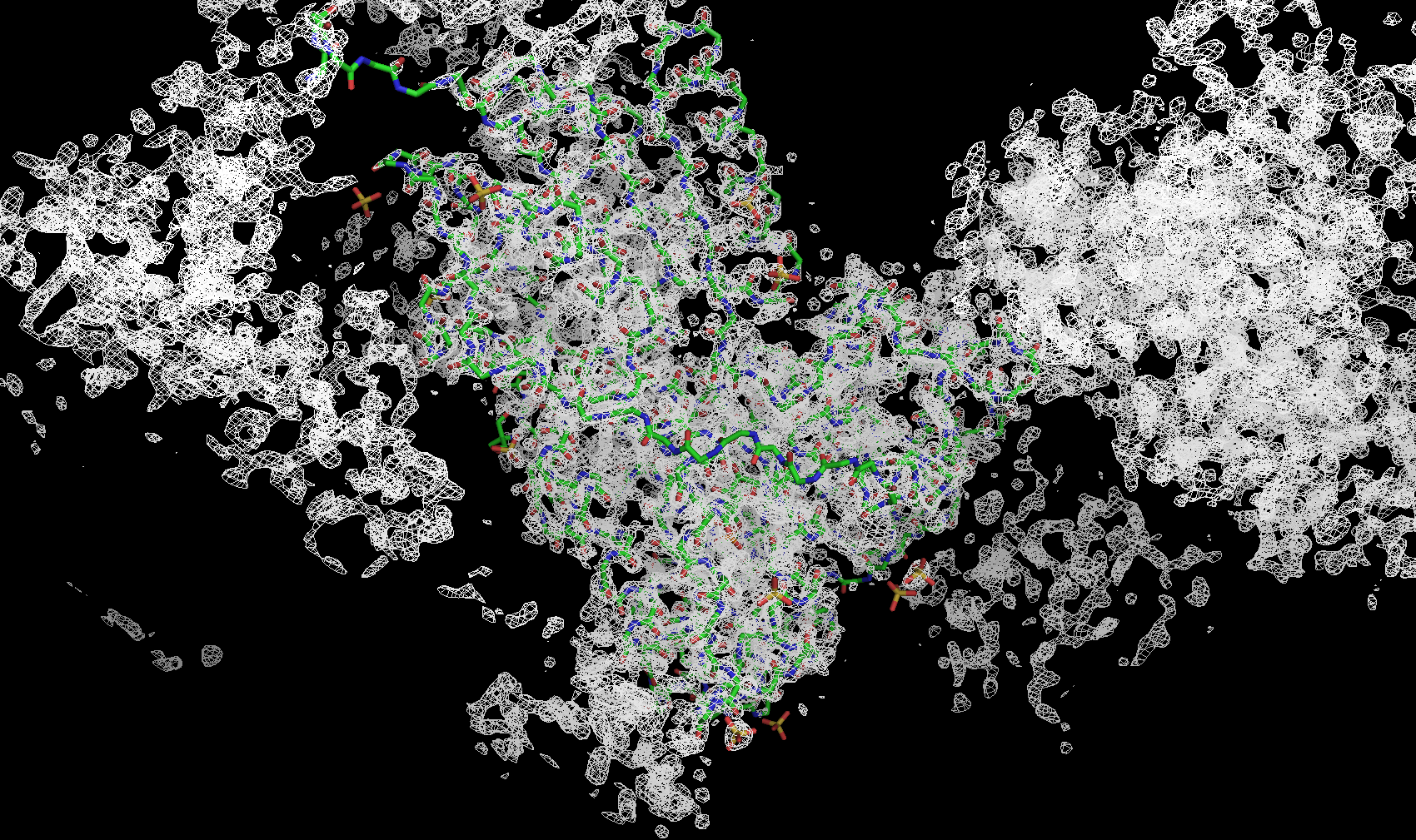

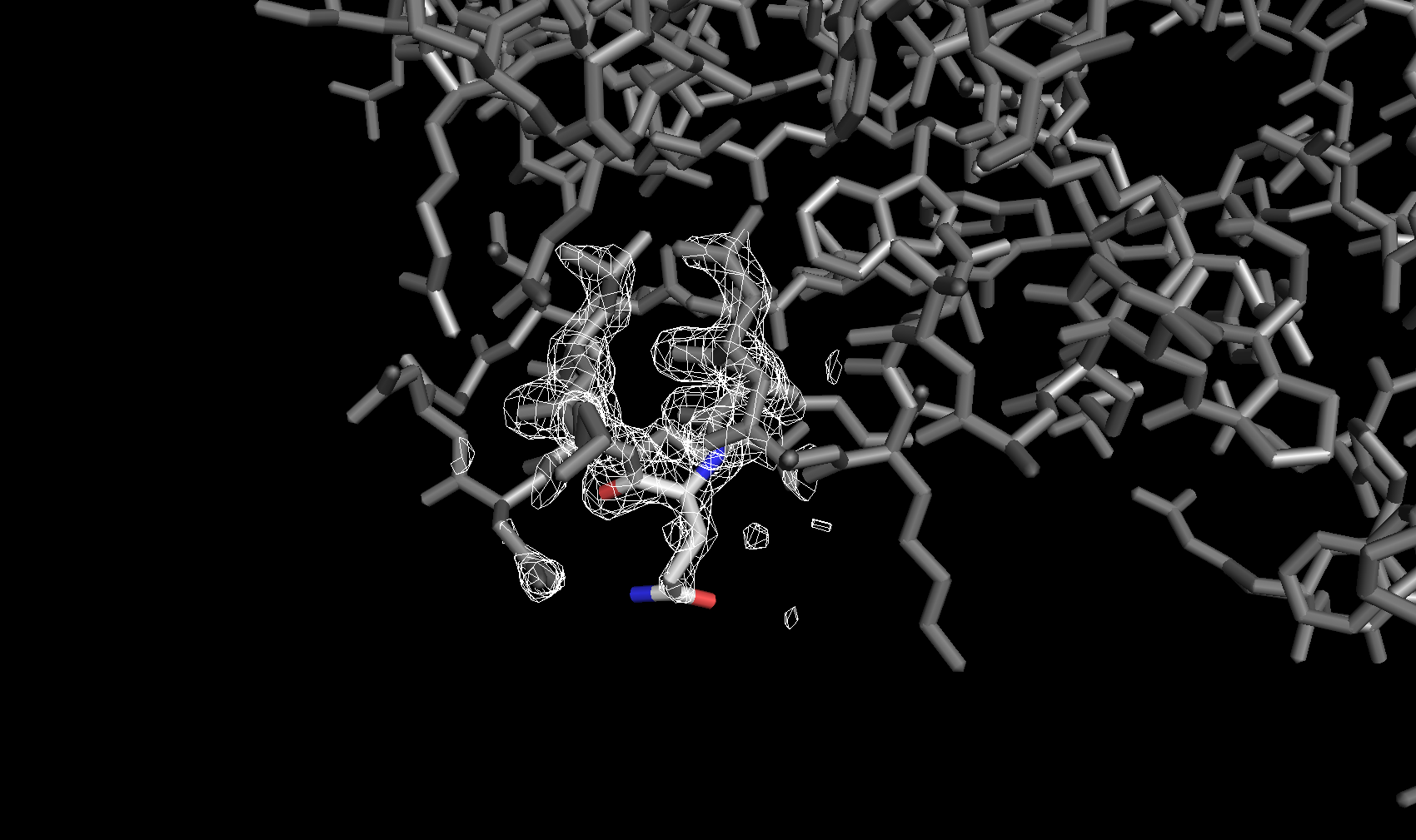
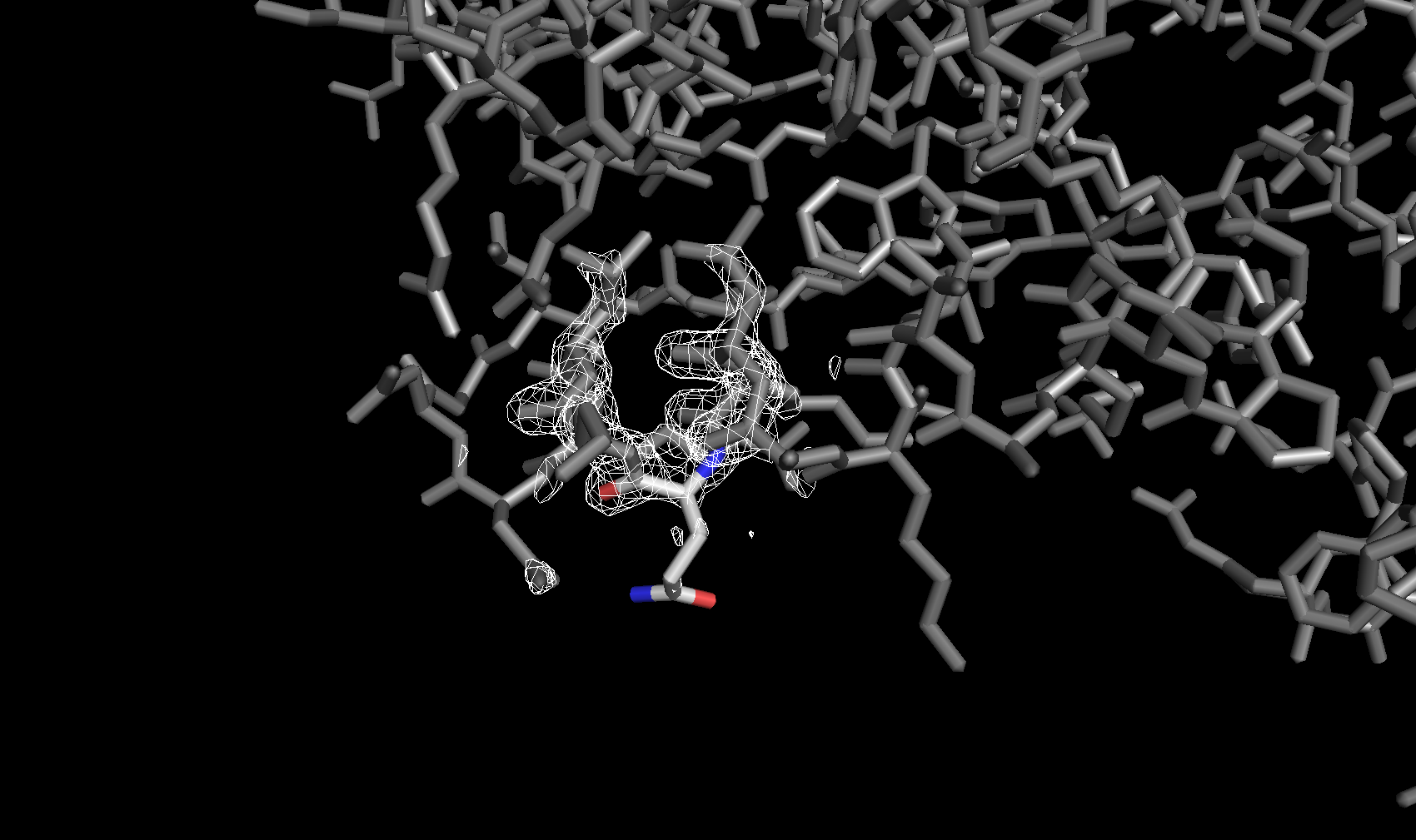
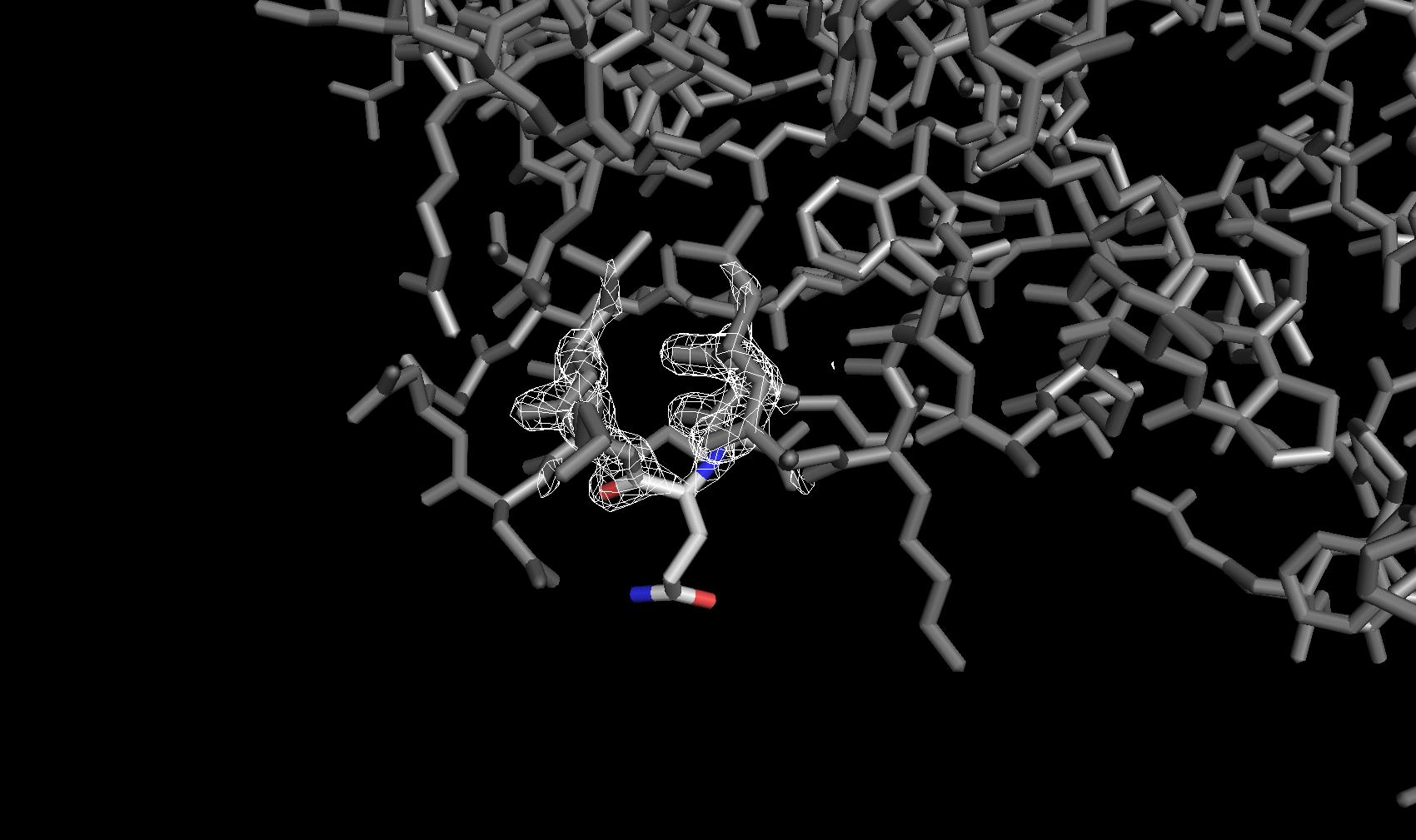
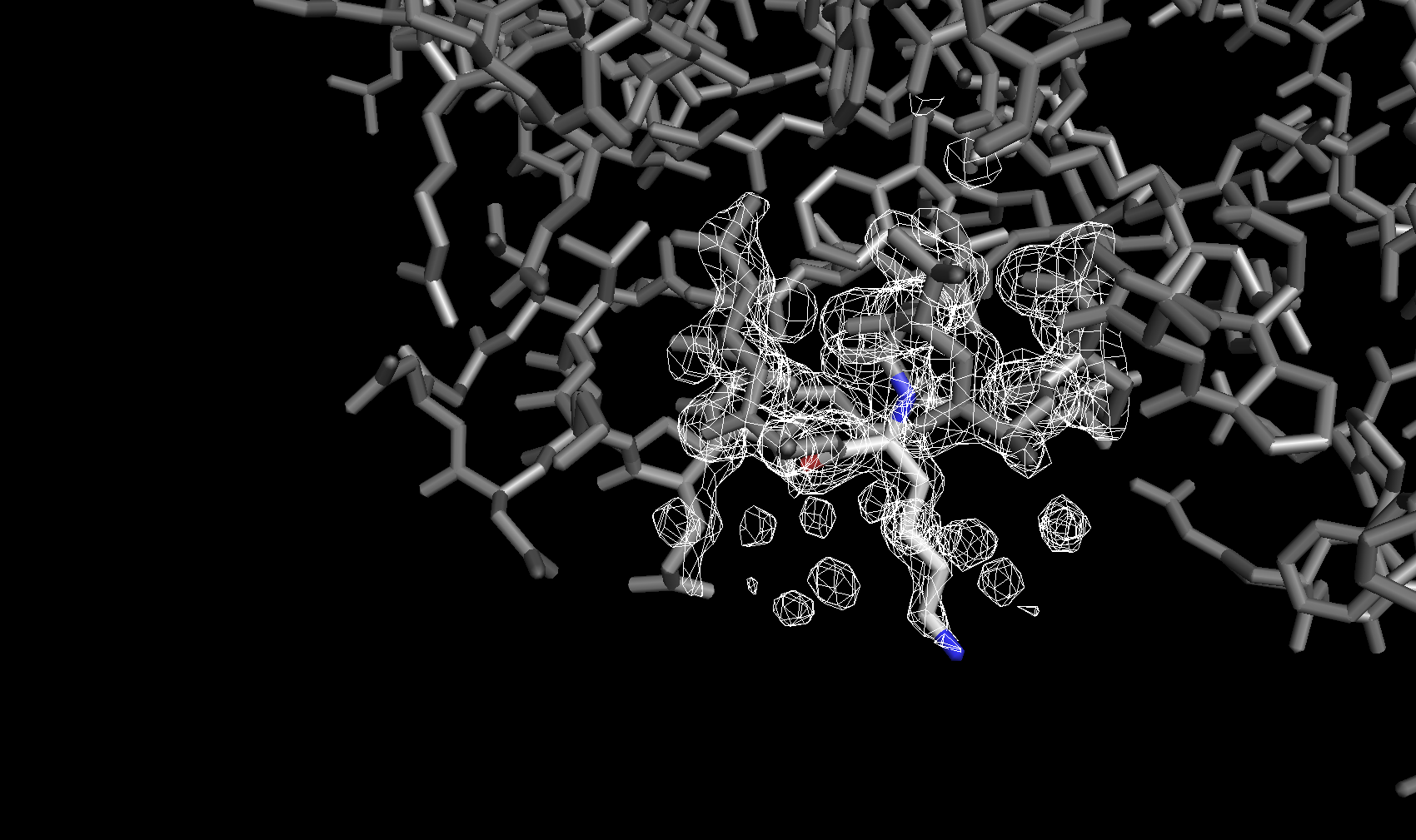
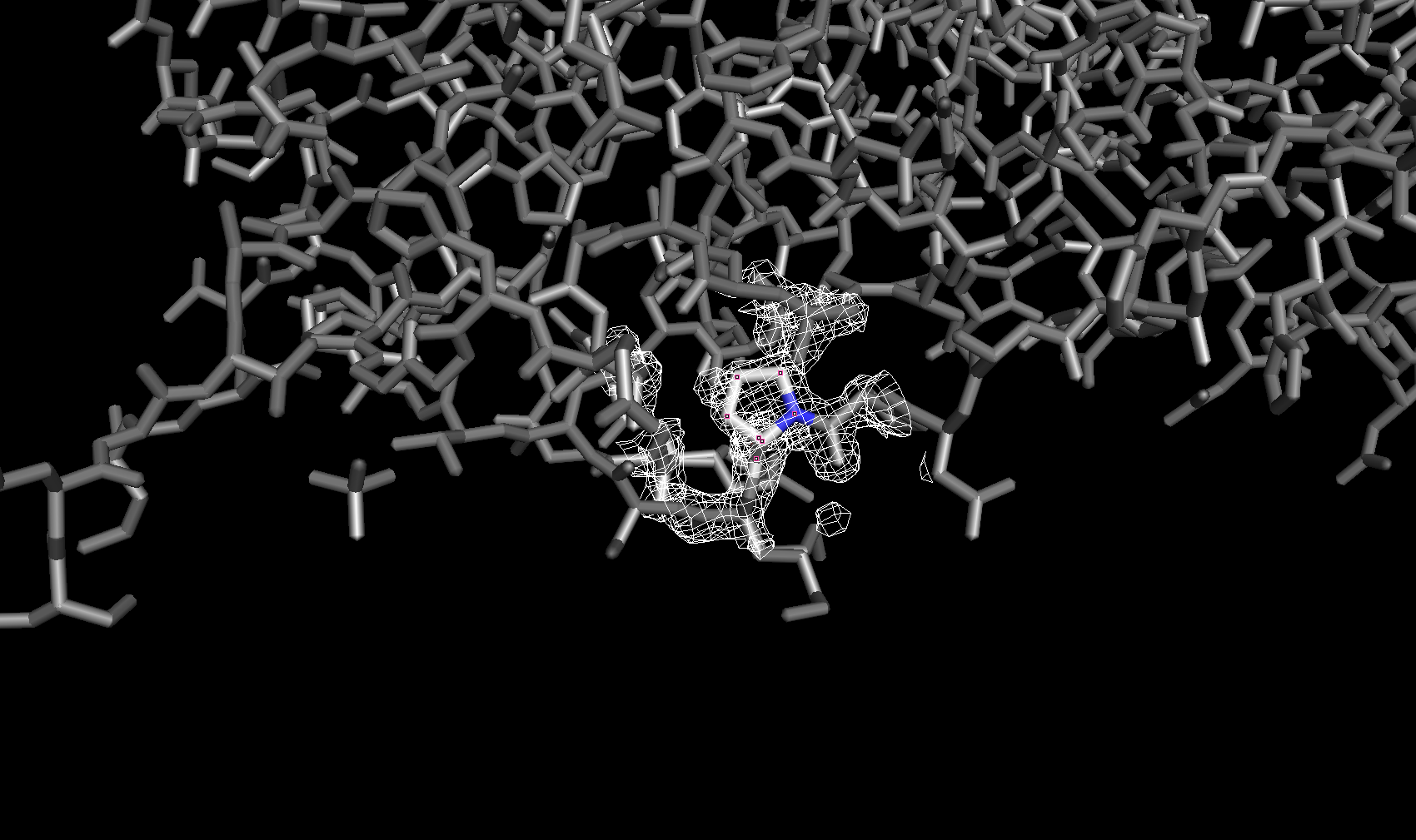
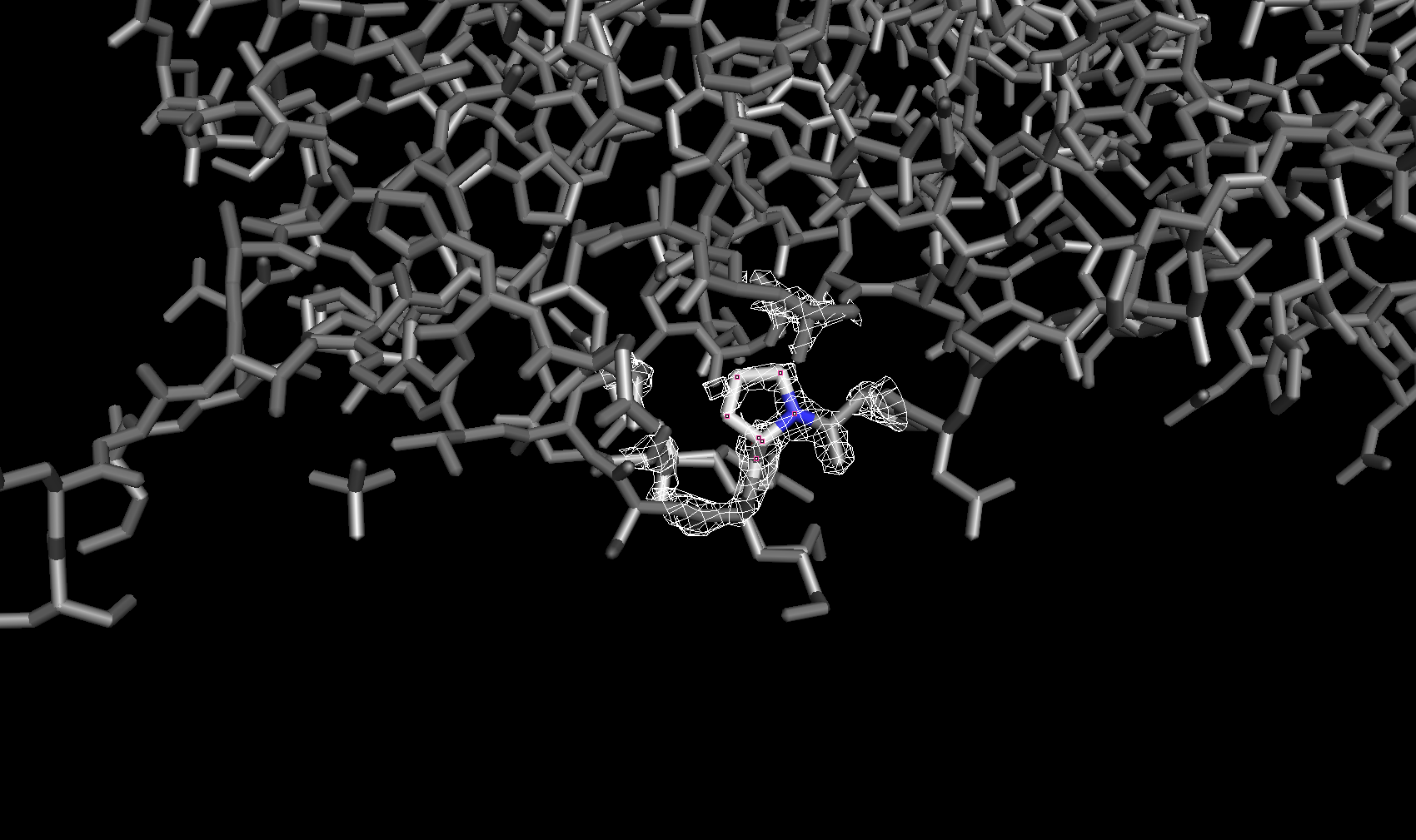
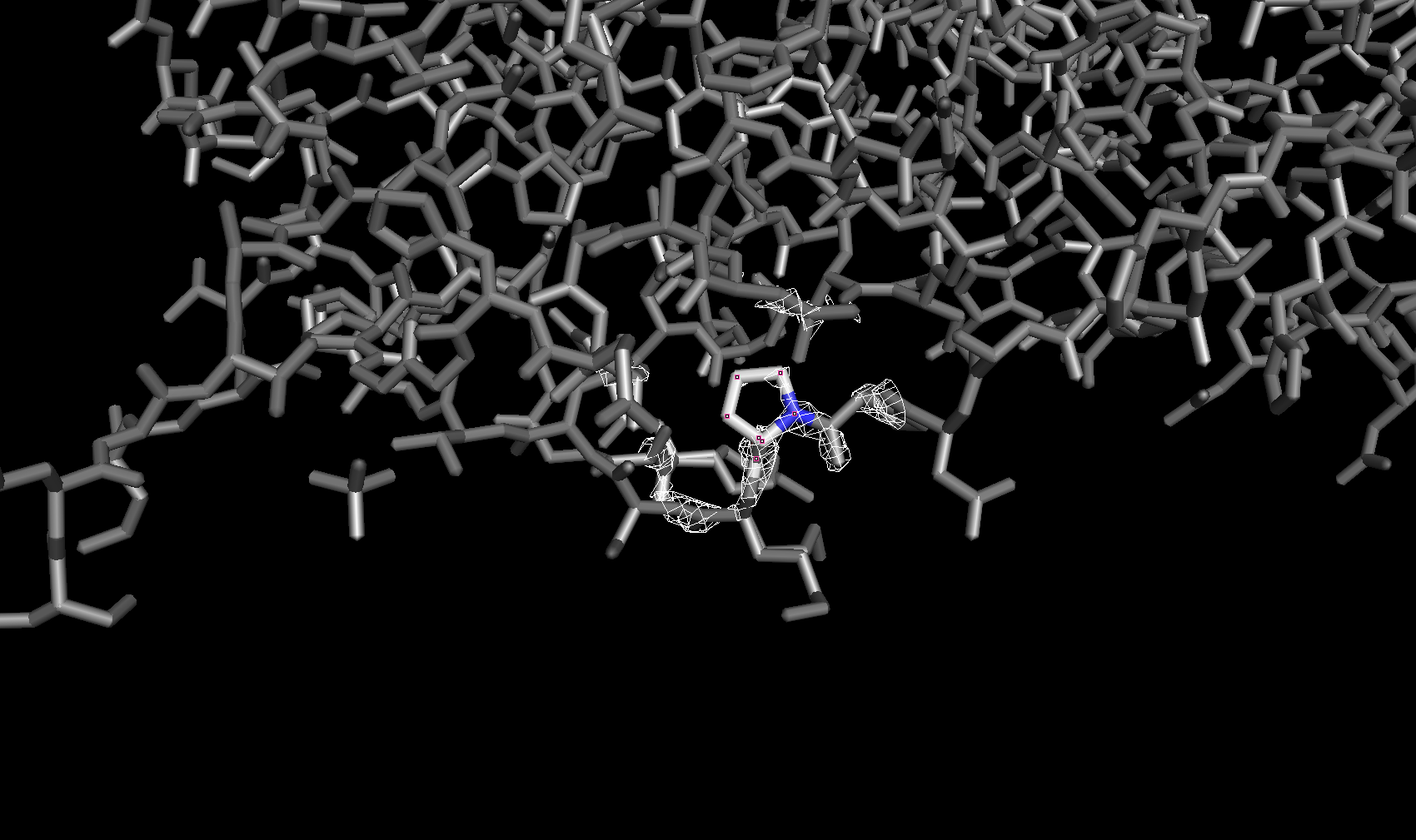
Электронная плотность вокруг аминокислотных остатков
Для сравнения далее была рассмотрена электронная плотность вокруг трех разных аминокислотных остатков с тремя уровнями подрезки у каждого. Глутамин с уровнями подрезки 2σ, 2.5σ и 3σ соответственно