Практикум 4
Резюме: В ходе работы над данным практикумом были освоены базовые навыки поиска взаимодействий между остатками в белке (pdb_id: 5N2T). Описание струткуры в целом представлено в практикуме 3.
Водородные связи
Как и в любом белке, в моей структуре широко представлены водородные связи. В том числе, они нужны для поддержания вторичной структуры (альфа-спиралей и бета-листов). Иллюстрация водородной связи между атомами остова белка представлена на рис. 1. Для поддержания третичной структуры белка тоже нужны водородные связи. Водородная связь, затрагивающая атомы боковых радикалов аминокислот, изображена на рис. 2.
Солевые мостики
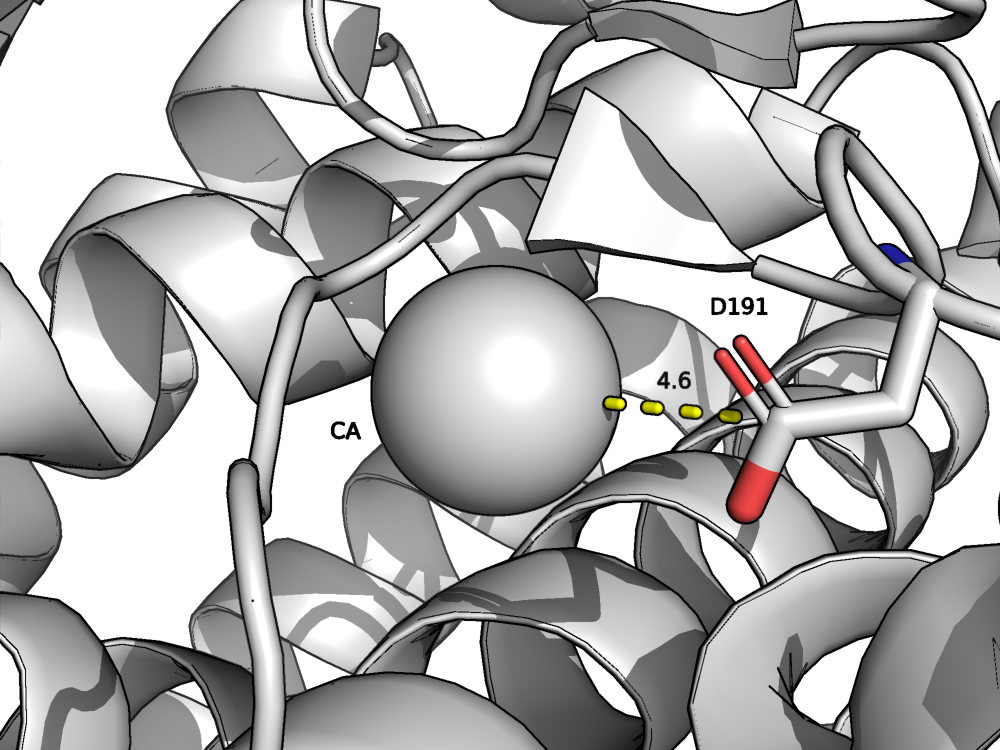
Солевые мостики - это электростатические взаимодействия между противоионами. Контакт аспартата и аргинина показан на рис. 3. Ионы кальция в структуре белка нужны для стабилизации (повышения термостабильности) термолизина. Контакт иона кальция и аспартата показан на рис. 4.
Стекинг
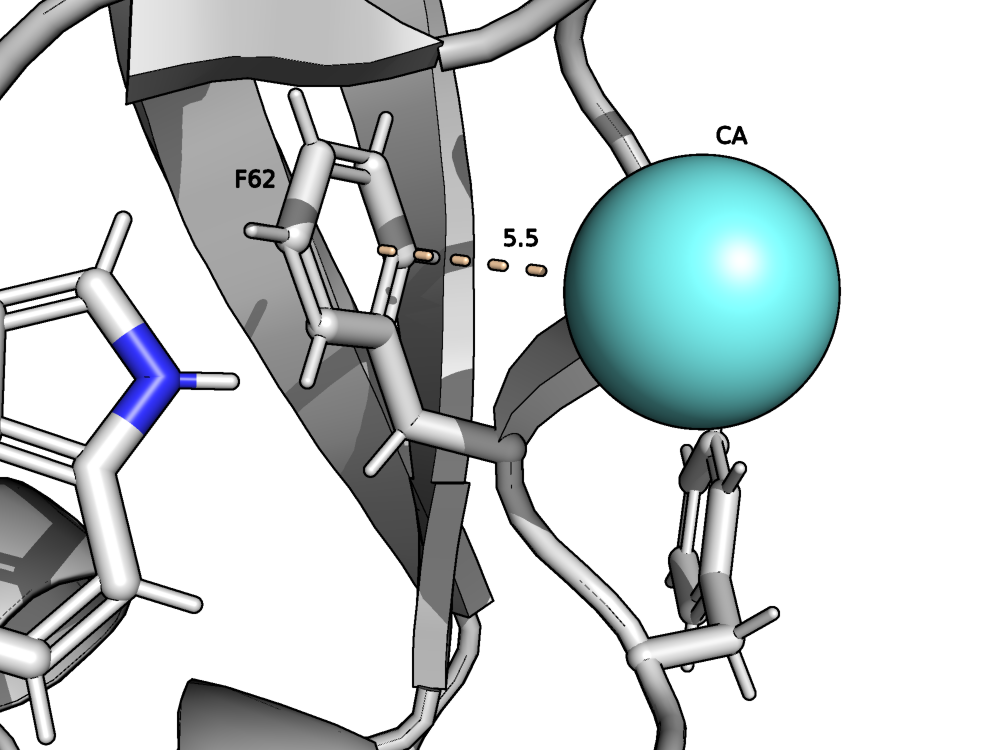
Стекинг-взаимдействия в моей струтуре представлены π-катионным стекингом (взаимодействием положительно заряженного иона и ароматической системы) - рис. 5 и 6.
Дисульфидные связи
В термолизине нет дисульфидных связей, так как в его последовательности нет цистеинов