Практикум 5
Резюме: В этом практикуме доставшаяся мне структура термолизина (pdb_id: 5N2T) была проанализирована с точки зрения осуществления ферментативной функции. Описание струткуры в целом представлено в практикуме 3.
Катализируемая реакция
Термолизин - это термостабильная цинк-содержащая металлопротеаза. Он осуществляет реакцию гидролиза пептидной связи перед лейцином (с большей эффективностью) или фенилаланином. Аминокислота перед разрезаемой связью неважна.
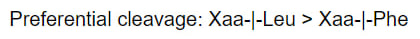
Каталитический центр
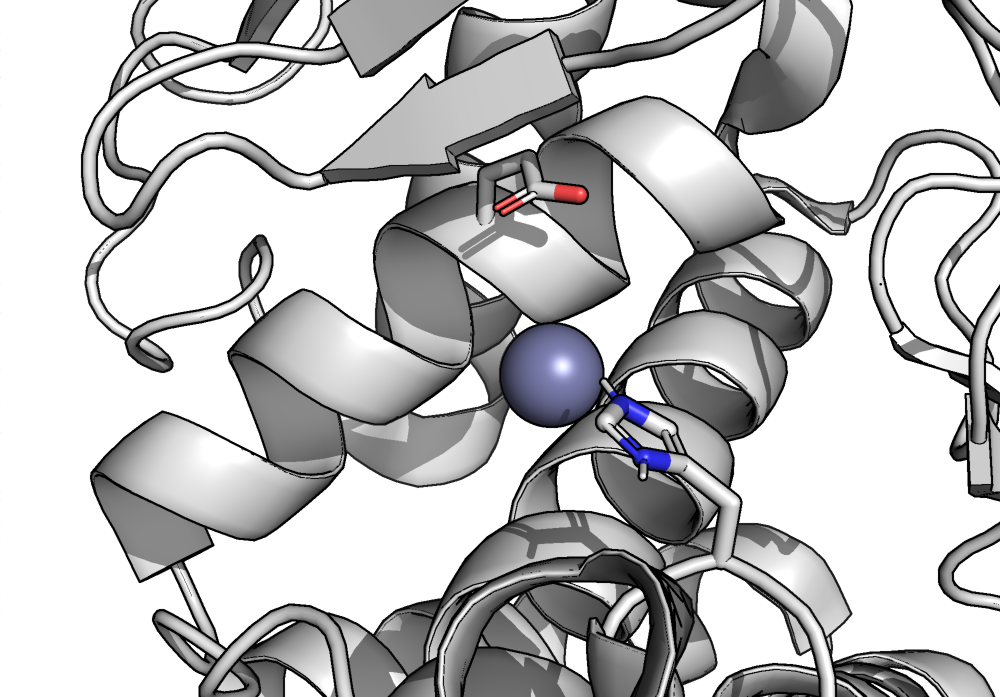
Каталитический центр термолизина состоит из двух аминокислот - GLU`143 и HIS`231 (рис. 1). Также в катализе участвует ион цинка. Насколько я понял, молекула воды из координационного окружения цинка осуществляет нуклеофильную атаку на атом углерода в составе карбонильной группы пептидной связи при участии глутамата и иона цинка (они как-то повышают ее нуклеофильные свойства и правильно ее позиционируют) [Brian W. Matthews, 1988].
Карман связывания
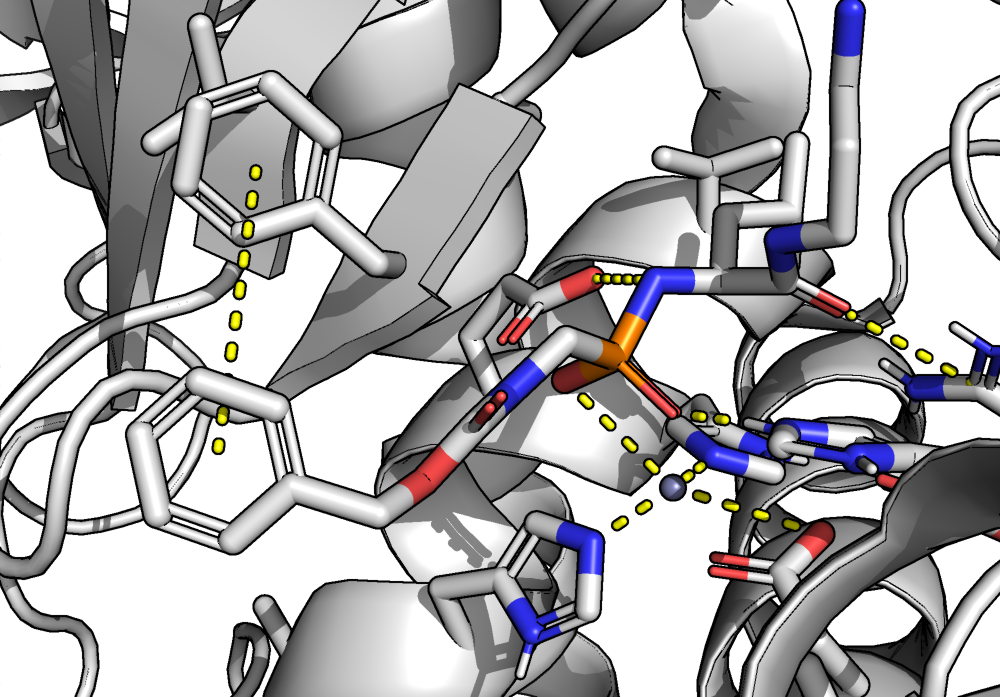
На рис. 2 (частично) показан карман связывания термолизина. Ион цинка координируется с помощью двух гистидинов (как никель в гис-таге) и аспартата. Четвертая координационная связь - с молекулой воды.
Ингибитор
Также со структурой моего белка связана молекула низкомолекулярного ингибитора, блокирующего его каталитическую активность. У меня это 8KK (phenylmethoxycarbonylaminomethylphosphonamidic acid). Ароматическое кольцо в составе 8KK распознается как фенилаланин. Также в структуре ингибитора есть две пептидные связи, по которым происходит распознавание его как субстрат. Скорее всего, ингибирование происходит, так как 8KK вытесняет из координационного окружения цинка молекулу воды, которая нужна для катализа.