Описание области контакта белка и лиганда EDO в структуре 2NV1
Лиганды в структуре 2NV1
В представленном белке встречаются можно встретить 3 различных лиганда: молекулы этандиола-1,2 или этиленгликоля (далее - EDO), ионы магния (Mg) и хлора (Cl).
Атомы металлов - Mg и Cl - вероятно, являются кофакторами белка и, скорее всего, обусловливают некоторые стадии реакции, катализируемой белком, участвуя в ней не напрямую, а косвенно, ориентируя молекулы участников и части самого белка. Атомы расположены равномерно по диаметру белка, они могут участвовать в формировании третичой структуры белка при образовании координационных связей с частями второй субъединицы белка (третичная структура рассмотрена в работе о внутремолекулярных взаимодействиях в структуре 2NV1).
Молекулы EDO являются лигандами белка только в полученной форме кристалла (в такой форме проводят ренгент-структурный анализ белка для получения данных о его пространнственном строении). из буфера, исползуемого для процесса кристаллизации белка.
Общую структуру белка и расположение лигандов можно увидеть на рисунке 1.
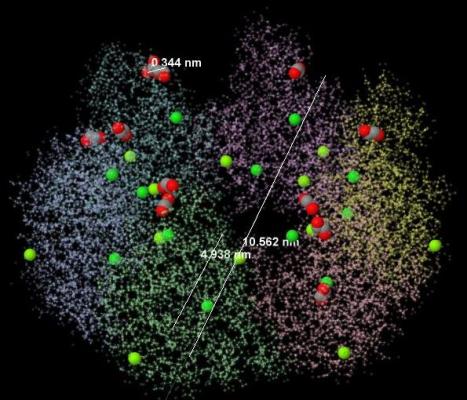
Рис. 1. Расположение лигандов в белке. Атомы EDO окрашены в стандартные цвета JMol (серый цвет обозначает углерод, красный цвет - кислород). Атомы магния - светло-зеленого цвета, атомы хлора - темно-зеленого цвета.
Скрипт (последовательность команд) для получения изображения 1 в программе JMol можно найти в приложенном файле.
Относительные размеры всех лигандов и самого белка представлены в таблице 1.
| Объект | Размер, А | Размер, нм | Размер, м |
| EDO (этандиол-1,2) (длина) | 3,41 | 0,341 | 0,341*10-9 |
| Mg (магний) (радиус атома) | 160*10-4 | 160*10-3 | 160*10-12 |
| Cl (хлор) (радиус атома) | 100*10-4 | 100*10-3 | 100*10-12 |
| Белок (2NV1) (D - диаметр, H - высота) |
D:1,0562 H:0,4938 |
D:10,562 H:4,938 |
D:10,562*10-9 H:4,938*10-9 |
Таблица 1. Относительные размеры белка и его лигандов.
Значения атомных радиусов магния и хлора взяты из Интернет-ресурса Википедия
[1]
Анализ области контакта белка из структуры PDB 2NV1 и лиганда EDO
В работе представлены некоторые данные о взаимодействии белка с лигандом EDO, расположение которого в трехмерном пространстве можно увидеть на рис.1.
Лиганд связывается с белком при помощи водородных связей и гидрофобных взаимодействий.
Водородные связи образуются между атомами кислорода молекулы EDO и атомами азота близлежащих аминокислот белка (в каждой цепи это две аминокислоты - аланин и тирозин). Также связи образуются между этандиолом и молекулами воды. Такие водородные связи показаны на рисунках 2-1 и 2-2 для молекулы EDO 3005 цепи А.
 - H-bonds-view.jpg)
Рис. 2-1. Водородные связи между атомами кислорода молекулы EDO (3005 в цепи А) и атомами аминокислот белка (Ala-191 и Tyr-193). Подписаны длины водородных связей. Изображение получено с помощью программы Ligand Explorer.
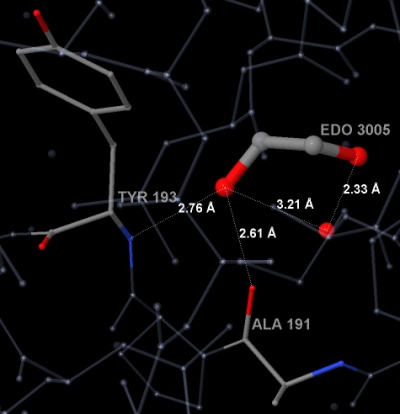
Рис. 2-2. Водородные связи между атомами кислорода молекулы EDO (3005 в цепи А) и атомами аминокислот белка (Ala-191 и Tyr-193).
Подписаны длины водородных связей.
Изображение получено с помощью программы JMol.
Скрипт в приложенном файле.
Гидрофобные взаимодействия - это сильное притяжение в воде между неполярными частицами. [2] Этиленгликоль - полярная молекула, ее полярность обеспечивают связи между кислородом и водородом. Но на основании обработанных в программе Ligand Explorer данных можно говорить, что атомы углерода и кислорода ориентированы в пространстве так, что возможно образование гидрофобных взаимодействий. А именно такие взаимодействия между углеродом этиленгликоля и аминокислотными остатками лизина и аланина рассмотрены для молекулы EDO 3005 в цепи А и показаны на рисунках 3-1 и 3-2. Подобные взаимодействия будут наблюдаться и для других молекул EDO в данном белке.
 - Hydrophobic-bonds.JPG)
Рис. 3-1. Гидрофобные связи углерода EDO (3005 в цепи А) и С-альфа атомоми аминокислотных остатков Lys-187 и Ala-186 и атомом углерода карбонильной группы Ala-186. Подписаны расстояния между этими атомами. Изображение получено с помощью программы Ligand Explorer.
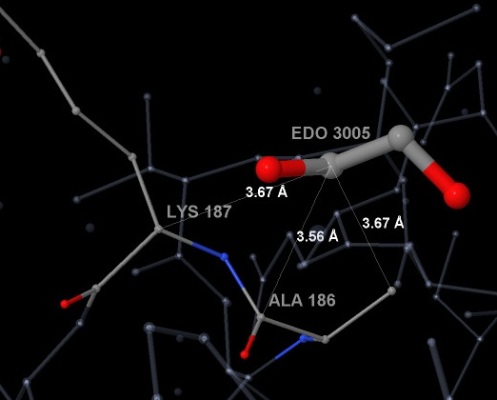
Рис. 3-2. Гидрофобные связи углерода EDO (3005 в цепи А) и С-альфа атомоми аминокислотных остатков Lys-187 и Ala-186
и атомом углерода карбонильной группы Ala-186. Подписаны расстояния между этими атомами.
Изображение получено с помощью программы JMol.
Скрипт в приложенном файле.
Схематическое изображение контактов лиганда с его окружением показаны на рис. 4. Представлены химические формулы и взаимодействия, которые складываются между лигандом и белком.
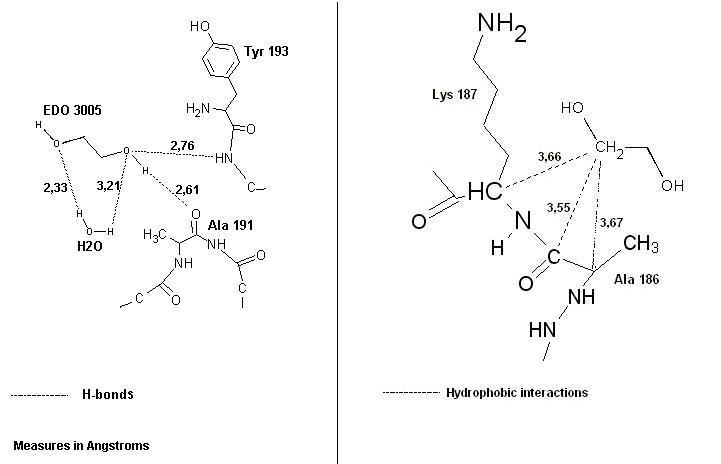
Рис. 4. Схема контактов лиганда с белком. Слева - водородные связи, справа - гидрофобные взаимодействия (все типы контактов показаны пунктирными линиями с подписанными расстояниями). Изображение получено с помощью программы ChemSketch.
В разделе представлено 3 изображения, полученных в программе JMol. Их можно получить, используя один скрипт (последовательность команд) в программе JMol.
Проект генно-инженерного эксперимента с белком из структуры 2NV1
Извините, данный раздел находится в стадии разработки. Полная информация появится вскоре.
Источники информации:
1. Ресурс Википедия (Атомный радиус);