Caspase 8
Данная страница посвящена апоптотической функции каспазы 8 (caspase 8) и процессу каспаза-8-зависимого апоптоза.
Для поиска статей, посвященных белку каспазе 8, в данной работе использовался ресурс NCBI – PubMed.
Для удобства автором была создана коллеция публикаций на заданную тему. Коллекцию можно увидеть перейдя по ссылке.
История необходимых для поиска запросов PubMed представлена в таблице 1.
| Запрос | Запрос PubMed из Search details | Всего находок | Всего в открытом доступе | Всего обзоров |
|---|---|---|---|---|
| (caspase 8[Title]) AND (apoptosis[Title]) | (caspase 8[Title]) AND (apoptosis[Title]) | 445 | 221 | 4 |
| (caspase 8[Title]) AND "Cancer research"[Journal] | (caspase 8[Title]) AND "Cancer research"[Journal] | 29 | 29 | 1 |
| (caspase 8[Tl]) AND "Cancer research"[Journal] and "function"[All fields] | (caspase 8[Title]) AND "Cancer research"[Journal] and "function"[All fields] | 12 | 12 | 1 |
| casp8 knockdown | ("caspase 8"[MeSH Terms] OR "caspase 8"[All Fields] OR "casp8"[All Fields]) AND knock-down[All Fields] | 331 | 187 | 0 |
| Статьи на близку тему (по мнению PubMed) для статьи из графы 2 | Related citation для статьи "Regulation of apoptosis and caspase-8 expression in neuroblastoma cells by isoforms of the IG20 gene", Li LC, Sheng JR, Mulherkar N, Prabhakar BS, Meriggioli MN | 106 |
Таблица 1.История запросов PubMed.
Каспаза 8 – регуляторный белок, цитозольная протеаза, основная и наиболее изученная функция которого – участие в апоптозе. Также каспаза 8 играет роль в иммунном ответе, о чем свидетельствуют многие исследования, но данная страница посвящена апоптотической функции белка.
Апоптоз – программируемая гибель клетки. Существуют различные причины апоптоза, а также различные пути его выполнения. Так фундаментальным считается каспаза-8-зависимый (caspase-8-dependant) апоптоз, его мы и будем рассматривать. Также есть доказательства существования каспаза-8-независимого (caspase-8-independant) апоптоза [2], но его суть не затрагивается в данной работе.
Основные события каспаза-8-зависимого апоптоза.
Рассмотрим общий случай участия каспазы 8 в апоптозе и последовательность реакций в сигнальном каскаде. Схема приведена на рисунке 1. Рецепторы мембраны клетки получают сигналы извне (Fas от Fas-лиганда и TNF-R1 от факторов некроза опухолей TNF – tumor necrosis factor – группа внутриклеточных сигнальных веществ) и становятся активными, обеспечивая взаимодействие между «доменами смерти» (“death domains”) в цитозольных белках FADD (Fas-associated death domain) и TRADD (TNF receptor-assosiated death domain). TRADD активирует различные протезы. FADD активирует каспазу 8, чьей мишенью могут являться митохондрии. Так высвобождаются белки, содержащиеся между наружной и внутренней митохондриальными мембранами – цитохром с, а также эффекторные каспазы (как правило, каспаза 3, и некоторые другие в зависимости от каскада; во втором разделе работы будет приведен пример каскада каспаза 8/каспаза 3).
Итоговые протеолиз (деградация белков, катализируемая протеолитическими ферментами; в данном случае распадаются жизненно важные белки, в результате чего происходит апоптоз) является основным фактором апоптоза. Так каспаза 8 играет ключевую роль в гибели клеток (в случае каспаза-8-зависимого апоптоза).
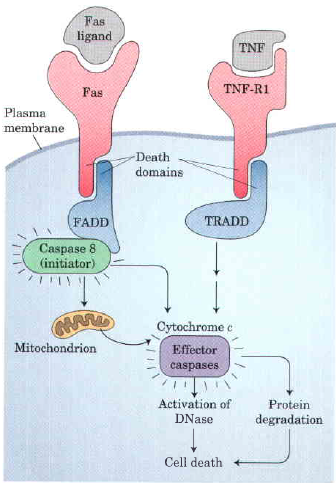
Рис. 1. Основые события каспаза-8-зависимого апоптоза. Описание в тексте. (Lehninger – Principles of Biochemistry. Fifth Edition, 2008).
Итак, мы рассмотрели эффекторную часть сигнального пути и последовательность реакций в сигнальном каскаде, в котором участвует описываемый белок. Целесообразно отметить факторы, в ответ на которые может активироваться такой процесс.
- «Запуск» каскада с каспазой-8 связан с взаимодействием рецептора Fas с Fas-лигандом – трансмембранным белком, который относится к факторам некроза опухоли (TNF). Это Причины наличия Fas-лиганда очень разнообразны. Экспрессия кодирующих его генов может быть вызвана в различных условиях, различны и способы сигнализации и транскрипционных механизмов, контролирующих этот процесс. В данной работе это не будет рассмотрена. Отметим только, что описанное взаимодействием является фундаментальным и единственным на данный момент изученным фактором активации интересующего каскада.
- Каспаза-8-зависимомый апоптоз может быть вызван с помощью нокаута определенных генов. Например, при нокауте гена, кодирующего MADD (Map kinase Activating Death Domain containing protein), высоким содержанием которого характеризуются клетки раковых опухолей (рак молочной железы), происходит увеличение активации каспазы-8, соответственно, и каскада реакций с ее участием. Это вызывает апоптоз опухолевых клеток. [3]
Патологии, вызванные нарушением каспаза-8-зависимого апоптоза.
Еще раз отметим, что описанный каскад является одним из важнейших путей апоптоза клетки. Поэтому его нарушения на различных стадиях вызывают различные патологии организмов (человека, животных, растений). Так неисправности в этом каскаде могут приводить к онкогенезу, лекарственной устойчивости уже существующих опухолей.
Рассмотренный путь апоптоза зависит от Fas-Fas-лиганд взаимодействия, которое ведет к запуску каспазного каспада и апоптоза. Мутации генов, кодирующих Fas могут вызвать такое заболевание как аутоимунное лимфопролиферативное заболевание (autoimmune lymphoproliferative syndrome). При этом имеют место, как правило, доброкачественные и «относительно доброкачественные» пролиферации (лимфаденопатия, гепатоспленомегали, гиперспленизм), связанные с нарушением апоптоза. [4]
Список литературы:
1) Lehninger – Principles of Biochemistry. Fifth Edition, 2008
2) «Evidence for a Novel, Caspase-8-Independent, Fas Death Domain-Mediated Apoptotic Pathway», Feng H, Zeng Y, Graner MW, Whitesell L, Katsanis E. Ссылка на текст статьи.
3) «MADD Knock-Down Enhances Doxorubicin and TRAIL Induced Apoptosis in Breast Cancer Cells», Andrea Turner, Liang-Cheng Li, Tania Pilli, Lixia Qian, Elizabeth Louise Wiley, Suman Setty, Konstantin Christov, Lakshmy Ganesh, Ajay V. Maker, Peifeng Li, Prasad Kanteti, Tapas K. Das Gupta, and Bellur S. Prabhakar. Ссылка на текст статьи.
4) «Autoimmune Lymphoproliferative Syndrome», Jack JH Bleesing, MD, PhD, Judith Johnson, MS, CGC, and Kejian Zhang, MD, MBA. Ссылка на текст статьи.
Caspase 8 - описание экспериментальной статьи
В данном разделе представлено краткое описание статьи (теоретических моментов, экспериментальной методики, результатов), посвященной одному из вариантов пути апоптоза и каскаду реакций с участием каспазы 8.
Основной источник – статья «Protein Kinase RNA/FADD/Caspase-8 Pathway Mediates the Proapoptotic Activity of the RNA-binding Protein Human Antigen R (HuR)», полный текст которой можно найти пройдя по ссылке.
РНК-связывающий белок – человеческий антиген R (далее – HuR) – в некоторых случаях может участвовать в апоптозе. HuR – один из наиболее важных посттранскрипционных рягуляторов генной экспрессии. Определенные участки HuR обеспечивают связывание с АU-богатыми участками (участки с большим содержанием аденина и урацила) мРНК (микро-РНК), что вызывает нестабильность последних, соответственно, играют роль в регуляции их транскрипции. Согласно результатам не малочисленных исследований, HuR может играть как проапоптотическую, так и антиапоптотическую роль в клеточном цикле (а именно в ответ на различные типы стресса HuR вызывает экспрессию проапоптотических или антиапоптотических мРНК). Статья рассказывает об апоптотической функции HuR и пути клеточной смерти, в котором участвует каспаза 8.
В статье описывается эффекторная часть пути каспаза-8-зависимого апоптоза, которой посвящена первая часть представленной на этой странице работы. В данном случае активная форма каспазы 8 активирует помимо цитохрома с также каспазу 3. Активация различных белков ведет к образованию апоптосом и клеточной смерти. Авторы указывают на увеличение действия данного пути апоптоза продуктами расщепления HuR.
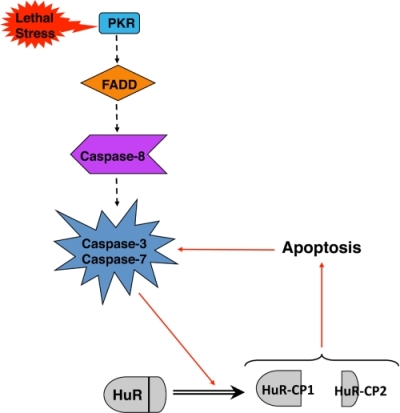
Расщепление HuR. Авторами описываемой статьи было показано, что в ответ на серьезный стресс HuR распадается с образованием двух продуктов – HuR-CP1 и HuR-CP2 (от англоязычного сокращения CP – cleavage product – продукт расщепления), которые вызвают апоптоз. Было выяснено, что такой распад может быть обусловлен действием протеинкиназы R (далее – PKR – protein kinase RNA). Интересно, что в ответ на фактор апоптоза – стауроспорин – PKR не фосфорелируется, а вызывает расщепление HuR с помощью своего «нижестоящего» эффектора FADD, который в свою очередь активирует именно каскад каспаз – каспаза 8/каспаза 3.
Кроме того, исследование подтвердило модель, согласно которой в ответ на смертельный стресс PKR активирует FADD/каспаза 8/каспаза 3 каскад для запуска расщепления HUR, а появление HuR-CP может само по себе вызвать апоптоз (хотя данный механизм остался не раскрытым).
Экспериментальная методика
Культивирование клеток, трансфекция. Использовались клетки HeLa CCL-2 (American Type Culture Collection), PKR, GCN2 (белок, серин-треонин-протеинкиназа, которая дает сигнал PKR, а также играет роль в метаболизме аминокислот клетки, [2]); PERK-нокаут (фармакологический метод, с помощью которого вызывают нарушения некоторых метаболических функций клеток, в том числе гликозирование, баланс Ca2+, [3]); фибробласты мышиных эмбрионов (дикий тип), выращенные в среде Eagle (содержит L-глутамин, бычью сыворотку 10%, пенициллин/стрептомицин). S51A (клетки, выращенные в среде, указанной выше для HeLa, с повышенным содержанием заменимых аминокислот и других соединений). FADD-нокаутирующие и PKR-нокаутирующие малые интерферирующие РНК (спиральные РНК) – для трансфекции клеток (в соответствии с инструкцией происзводителя РНК). Инкубация после трансфекции шла 48 часов, после этого образцы были собраны.
Подготовка клеточных экстрактов и иммуноблот. Была применена стандартная методика постановки вестерн-блота (метод для определения определенных белков клетки). Метод был применен для выявления HuR, Ras-GAP SH3 домен-связывающий белок (G3BP), FADD, Thr(P)-PKR, каспазы 8, каспазы 3, GST и некоторых других белков.
AP(antennapedia)-сопряженное производство белка. Был создан комплекс – AP/GST-вектор, созданный для клонирования HuR-CP 1 и 2. Амплификация HuR-CP была произведена с помощью праймеров с подобранной последовательностью (ее можно увидеть в тексте статьи). Вектор был экспрессирован в клетках, элюцию белков производили в буфере из 300 мкл Tris (pH 8.8), 120 мкл NaCl, 10 мкл глутатиона для первой элюции и 20 мкл для второй.
Лечение клеток и оценка гибели клеток. Клетки обрабатывали стауроспорином (1 мкл) за 1 час до лечения. Для лечения клеток использовали смесь: polyinosinic-polycytidylic acid; okadaic acid; Z-IETD-fmk. Необходимые белки очищали (проводили элюции). Клетки промывали фосфатным буферным раствором, окрашивали аннексин V (по инструкции производителя). Гибель клеток оценивали по окрашиванию аннексина V (иммуноферментный анализ), а также по результатам вестерн-блоттинга для каспазы-3 и некоторых других продуктов. Результаты обрабатывались с помощью программного обеспечения ImageQuant. Статистический анализ проводили с использованием GraphPad и Microsoft Excel.
Результаты
Выявление зависимости расщепления HuR и, соответственно, апоптоза клетки от PKR, FADD и каспазы 8.
Выявление связи между расщеплением HuR и проапоптотической активностью клеток дало возможность определить один из типичных для всех тканей киназный ответ. Различные стрессы вызывают активацию четырез различных киназ GCN2 (amino acis starvation), PERK, PKR (при вирусной активности и внешнем стрессе), гем-регулирующий ингибитор (в кровяных клетках).
Киназы могут включаться в каспаза-завимисимое расщепление HuR. Это выяснили с помощью измерени экспрессии исследуемых соединений и доказали тем фактом, что в клетках с нокаутом PKR происходит уменьшение распада HuR примерно на 85 %. Исследователи разобрали механизм передачи сигнала от PKR к HuR.
Ученые отметили, что в клетках, где обнаруживались продукты распада HuR (HuR-CP), обнаруживались также фосфорелированные формы PKR, и сделали вывод о том, что PKR является промотором расщепления HuR, а также что этот процесс является зависимым от фосфорелирования.
Перед исследователями встала проблема определения посредников между PKR и HuR-CP. Было замечено, что PKR также активирует JNK, p38, pp2A, но ингибирующее действие на эти факторы, однако, не воздействовало на расщепление HuR. После подобного рода наблюдений ученые обнаружили один важный путь апоптоза, активируемый PKR. Оказалось, что PKR может вызывать активность FADD, который в свою очередь, активирует накопленную в клетке прокаспазу-8. Используя малые интерферирующие РНК (и, соответственно, эффект РНК-интерференции) в клетках HeLа, ученые выяснили что наличие FADD важно для расщепления HuR.
Каспаза-8 является следующей после FADD в эффекторной части каскада реакции при апоптозе (это было отмечено в первом разделе данной страницы). При обработке клеток каспаза-8-спецеифичным ингибитором было замечено уменьшение расщепления HuR.
Была предпринята попытка ингибирования каспазы 3, которая, как правило, является следующей за каспазой 8 в сигнальном пути. При этом HuR также не расщеплялся, что коррелируется с данными предыдущих исследований, в которых говорится о зависимости расщепления HuR от каспазы 3. Аналогичные данные о каспазе 7 получены в настоящей статье и предыдущих работах.
Таким образом, доказали, что расщепление HuR является одним из процессов в каскаде PKR (где PKR – рецептирующий белок) и одним из факторов повышения апоптоза в ответ на сигналы.
HuR-CP. Завершающей ступенью эксперимента было исследование взаимосвязи между HuR-CP – продуктами расщепления HuR – и собственно апоптозом клетки, а также возможность происхождения апоптоза без PKR/FADD/каспаза-8 пути, активирующего распад HuR.
При постановке эксперимента клетки HeLa с ингибированными каспазами 8 и 3 обрабатывали белками, соединенными с AP-комплексами (AP – от antennapedia) для прохождение через клеточные мембраны. Отдельно клетки обрабатывались HuR, HuR-CP1, HuR-CP или одновременно HuR-CP1 и HuR-CP2. Гибель клеток оценивали с помощью метода проточной цитометрии (flow cytometry). Было показано, что HuR-CP2 могут вызывать апоптоз в отсутствие каспазы 8, а также что PKR-расщепление HuR является ключевым событием, которое вызывает клеточную смерть.
Также было замечено, что сами соединения HuR-CP могут вызывать активацию каспаз 3 и 7.
На основе совокупности представленных данных исследователи создали модель каскада реакций проапоптотического расщепления HuR и описанного пути апоптоза. Схема такого пути представлена на рисунке ниже:
Cписок литературы
1) «Protein Kinase RNA/FADD/Caspase-8 Pathway Mediates the Proapoptotic Activity of the RNA-binding Protein Human Antigen R (HuR)», Christopher von Roretz and Imed-Eddine Gallouzi. Ссылка на текст статьи.
2) «The PERK Eukaryotic Initiation Factor 2A Kinase Is Required for the Development of the Skeletal System, Postnatal Growth, and the Function and Viability of the Pancreas». Ссылка на текст статьи.