Построение и визуализация электронной плотности (ЭП)
Структура 1BL8
В данной работе будут использованы данные о пространственной структуре белка 1BL8, калиевого канала из Streptomyces lividans. Информация о данной структуре представлена в таблице 1.
Таблица 1. Информация о структуре 1bl8.
| PDB | 1bl8 |
| EDS | 1bl8 |
| Длина | 97 аа |
| PDBeFold | Число находок для выравнивания структур (параметры по умолчанию): 193 |
| Некоторые структурные гомологи* |
4h37 (Listeria monocytogenes); 2kb1 (Escherichia coli); 2q69 (Bacillus cereus); 3eff (Mus musculus); 4hz3 (Methanothermobacter thermautotrophicus str. Delta H)
|
* - гомологи с RMSD > 0,8 и долей выровненных остатков (относительно длины 3tui) до 90%
Изображение ЭП вокруг полипептидной цепи
Структура 1bl8 и файл с электронной плотностью были загружены в PyMol. Для визуализации электронной плотности использована команда isomesh. В качестве уровня для построения поверхности использовались значения: 1, 1.5 и 2. Далее на рисунках представлены изображения электронной плотности белка.
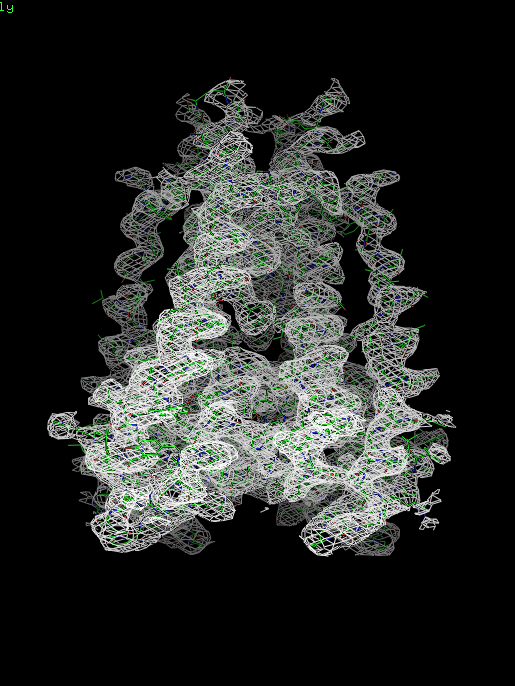
Рис. 1.1. Изображение электронной плотности вокруг полипептидной цепи (для уровня изолиний 1.0 σ на указанном расстоянии от выбранного множества – 1bl8, параметр carve = 1,5)
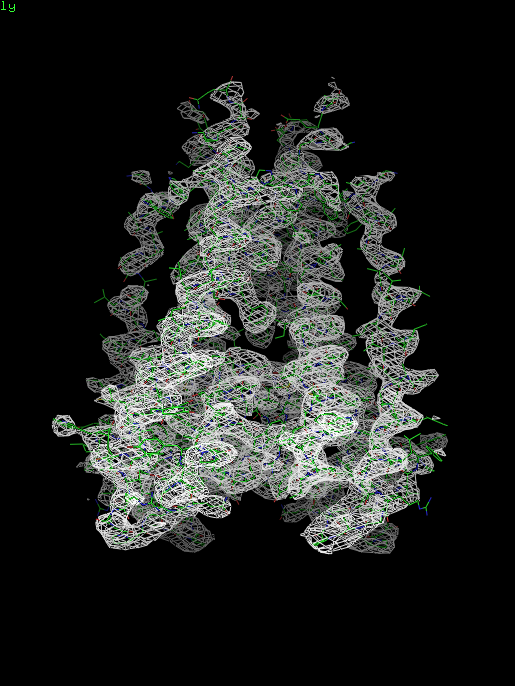
Рис. 1.2. Изображение электронной плотности вокруг полипептидной цепи (для уровня изолиний 1.5 σ на указанном расстоянии от выбранного множества – 1bl8, параметр carve = 1,5)
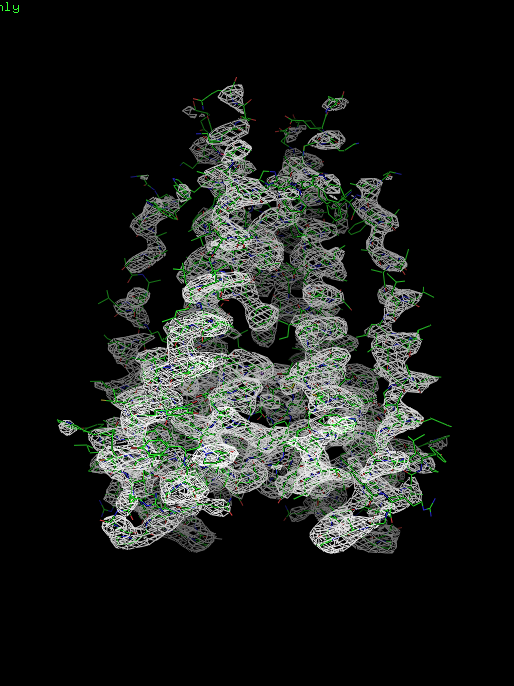
Рис. 1.3. Изображение электронной плотности вокруг полипептидной цепи (для уровня изолиний 2.0 σ на указанном расстоянии от выбранного множества – 1bl8, параметр carve = 1,5)
При рассмотрении полученных выше и далее картин распределения электронной плотности при разных значениях уровня видно, что при увеличении значения, показываются более электронноплотные участки.
Изображение ЭП вокруг аминокислотных остатков
Далее представлена электронная плотность вокруг нескольких остатков полипептидной цепи с различными уровнями подрезки.
Были рассмотрены два остатка: 52 остаток аргинина, находящегося в наружней боковой части цели, и 67 остаток триптофана, находящегося "в центре" белка.
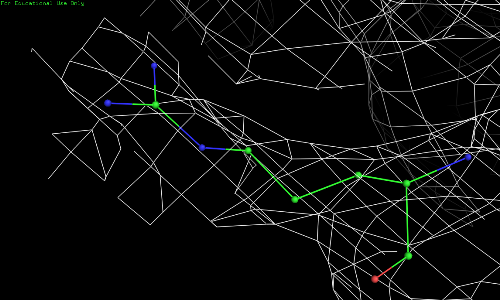
Рис. 2.2. ARG-52, уровень подрезки 0,5.
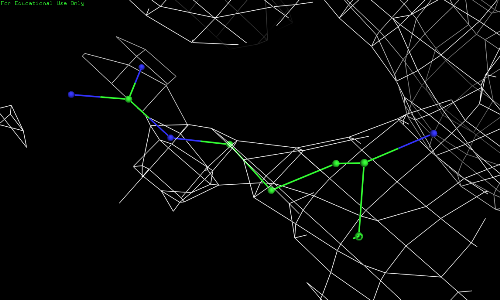
Рис. 2.3. ARG-52, уровень подрезки 1.
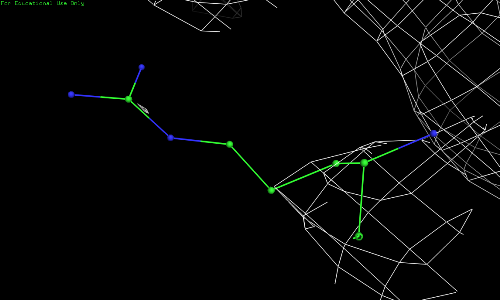
Рис. 2.4. ARG-52, уровень подрезки 1,5.
Видно, что по сгущению электронной плотности нельзя определить положение атомов радикала 52 остатка аргинина.
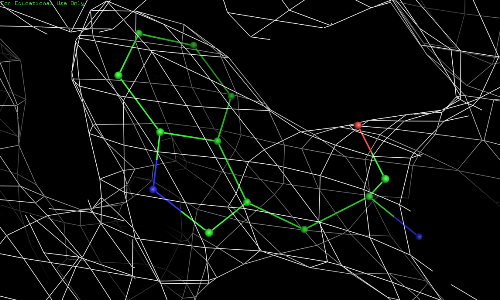
Рис. 3.1. TRP-67, уровень подрезки 0,5.
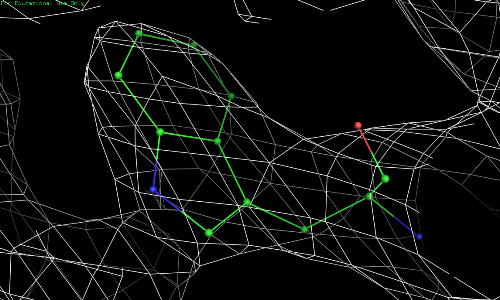
Рис. 3.2. TRP-67, уровень подрезки 1,0
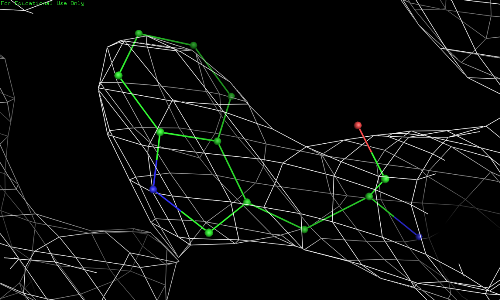
Рис. 3.3. TRP-67, уровень подрезки 1,5.
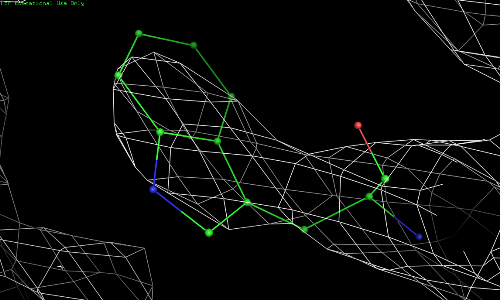
Рис. 3.3. TRP-67, уровень подрезки 2.
Видно, что атомы 67 остатка триптофана намного лучше вписываются в электронную плотность.
Таким образом, разрешение структуры 1bl8 не является достаточным, для того чтобы различить отдельные атомы или даже боковые цепи. Тем не менее, разрешения хватает для описания остова полипептидной цепи. Для остатков, расположенных не на краях белка, данные об электронной плотности позволяют судить о довольно точном определении положения атомов.