ФББ 2013-2014
ФББ 2013-2014
Водородные связи, поддерживающие альфа-спирали.

Рис. 1. Все альфа-спирали цепи A. Показаны в модели cartoons.
Водородные связи играют важнейшую роль в поддержании вторичной структуры белка. При образовании этого вида связи атом водорода обобществляется между двумя электроотрицательными атомами (например, кислородами в воде). Водород одной молекулы находится ближе к электроотрицательному атому другой молекулы, чем это может позволить Ван-дер-Ваальсово взаимодействие.
По отдельности водородные связи очень слабы, но за счёт того, что в белке они образуются в огромных количествах, суммарно их вклад в поддержание вторичной структуры очень велик. Верхний предел длины водородных связей в белках - 3,5 А.
В белках водородные связи образуются между карбонильной группой одного аминокислотного остатка и аминогруппой другого. В альфа-спиралях водородные связи создают каркас, образуясь между i остатком и i+4 остатком.
На рисунке 2 изображена альфа-спираль цепи А, образованная 18ю остатками - с 67 [GLY] до 84 [LYS]. Количество витков - 5, количество остатков - 18. Тогда количество аминокислотных остатков на один виток - 3,6.
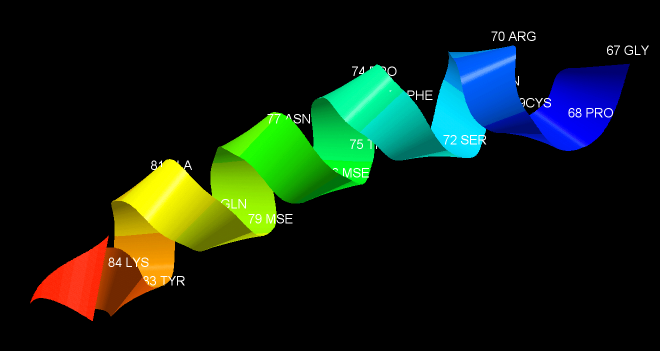
Рис. 2. Альфа спираль, образованная остатками 67-84. Подписаны все остатки, спираль показана в модели cartoons. Покраска - командой color group.
На рисунке 3 показаны водородные связи, которые создают структуру спирали. Шариковой моделью (cpk 150) показаны атомы, участвующие в образовании этих водородных связей. Связь образуется между килородом карбонильной группы и водородом аминогруппы. Тонкой проволочной моделью (wireframe) показаны радикалы. Видно, что они не образуют остовных водородных связей.
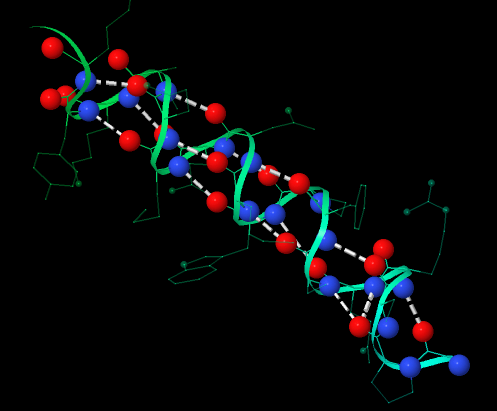
Рис. 3. Альфа спираль, образованная остатками 67-84. Остовные водородные связи.
В каждой из цепей исследуемого белка есть 5 участков, находящихся в конформации альфа-спирали. Они окружают один бета-лист, про который пойдёт речь в следующем параграфе. Таким образом, каждая цепь моего белка - α/β цепь и белок в целом можно назвать - α/β белком. Такой тип укладки очень распространён в природе. Пример белка с похожей укладкой - CheY (pdb 3CHY) .
Также белки с похожей укладкой легко найти в базе данных PDB по запросу Flavodoxin.
Водородные связи, поддерживающие бета-листы.
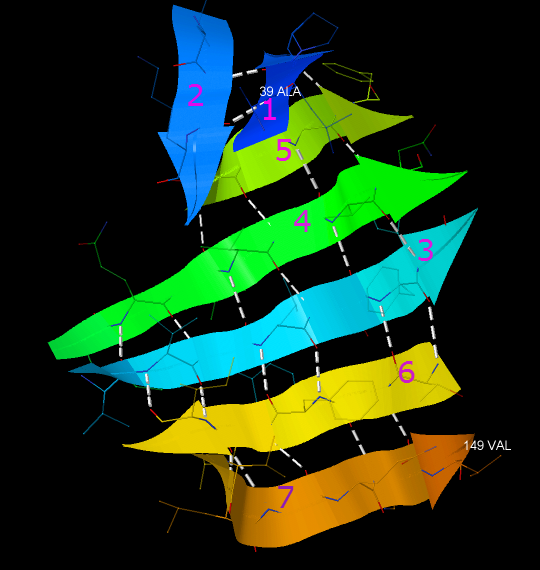
Рис. 4. Бета-лист цепи A белка с идентификатором 3GL3. Номерами 1-7 обозначены тяжи, составляющие лист. Также обозначены первая и последняя аминокислота, входящие в состав листа (39 [ALA] и 149 [VAL] соответственно).
В кажой цепи белка дисульфидного обмена Chlorobium tepidum TLS бета-лист расположен в центре. В его состав входит бета-шпилька (тяжи 1 и 2 на рисунке 4) и ещё 5 тяжей (тяжи 3-7 на рисунке 4). Более подробное описание шпильки - в следующем параграфе.
Как мы видим из рисунка 4, некоторые тяжи уложены параллельно (например, 3 и 4), некоторые - антипараллельно (например, 6 и 7). В целом бета-лист находится в конформации "греческий ключ".
Структура бета-листа также поддерживается водородными связями. На рисунке 5 в шариковой модели (cpk 150) показаны атомы, между которыми образуется водородная связь (кислород карбонильной группы и водород аминогруппы).
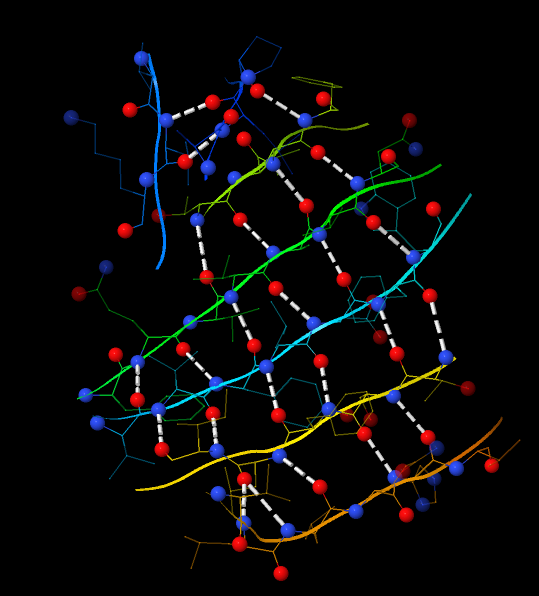
Рис. 5. Бета-лист цепи А. Показаны 7 тяжей и водородные связи, которые держат их вместе.
Общее количество водородных связей, которые поддерживают вторичную структуру альфа-спиралей и бета-листов можно определить с помощью Jmol:
select helix or sheets calculate hbonds
В случае исследуемого белка число таких водородных связей - 252.
Водородные связи в бета-шпильках и бета-поворотах.
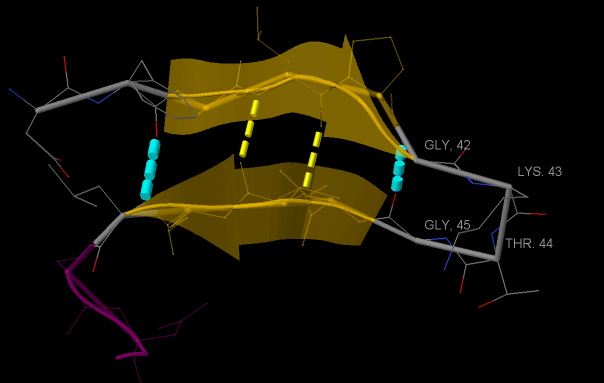
Рис. 6. Бета-шпилька (жёлтые полупрозрачные тяжи в модели cartoons) и бета-поворот (серый цвет, модель backbone). Водородные связи в бета-шпильке обозначены жёлтым цветом, в остальных участках цепи - голубым.
Вернёмся к рисунку 4. Тяжи 1 и 2, обозначенные на нём, образуют бета-шпильку. Её образование становится возможным за счёт бета-поворота (см. рисунок 6). Аминокислотные остатки, создающие бета-поворот, подписаны на рисунке 6 - это 42 [GLY], 43 [LYS], 44 [THR] и [45] GLY.
Стоит также отметить, что бета-поворот очень часто связывает антипараллельные бета-тяжи или бета-шпильки.
Водородные связи образуются не только для поддержания альфа-спиралей и бета-листов. Они могут образовываться в глобуле белка и между участками первичной структуру или связывать между собой разные участки, формирующие третичную структуру. Такие водородные связи также можно вычислить с помощью Jmol. В нашем случае их 40.
Рассмотрим более подробно водородную связь не в альфа-спирали и не в бета-листе. На рисунке 7 показаны аминокислотные остатки [111] ALA, [112] GLU и [113] PHE. Донором водорода является NH группа остатка фенилаланина, а акцептор - килород карбонильной группы остатка аланина. Длина связи - 0,303 нм.
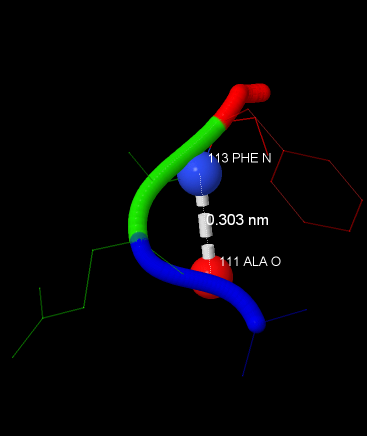
Рис. 7. Водородная связь между остатками [111] ALA и [113] PHE из цепи C. Показаны донор, акцептор и длина связи.