ФББ 2013-2014
ФББ 2013-2014
Гидрофобное ядро белка дисульфидного обмена Chlorobium tepidum TLS
Гидрофобные взаимодействия возникают, потому что гидрофобные группы слипаются вместе из-за действия воды. Вода отталкивает гидрофобные молекулы, т.к. не может образовать с ними водородную связь. Поэтому строение белковой глобулы, в целом, таково: внутри находится ядро из наиболее гидрофобных аминокислот (ароматические, алифатические неполярные), а на поверхности расположены более гидрофильные аминокислоты.
На рисунке 1 моделью spacefill показаны самые гидрофобные аминокислоты. Мы видим, что внутри глобулы их больше всего, хотя и на поверхности они тоже есть.
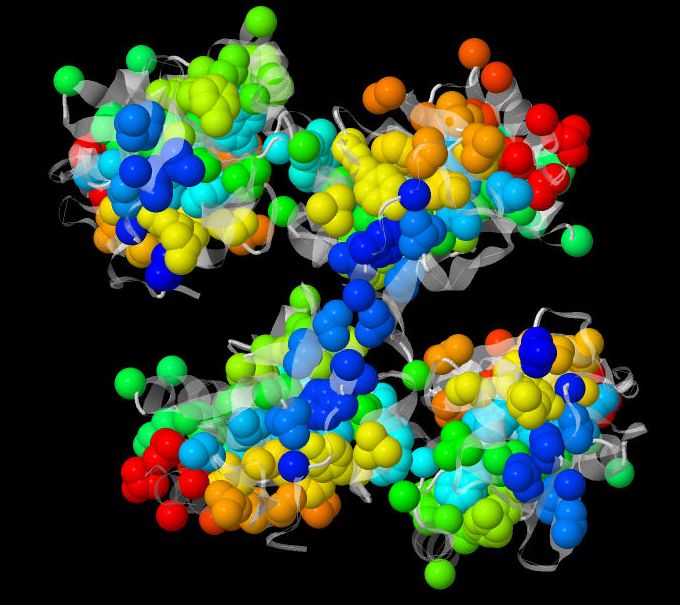
Рис. 1. Гидрофобное ядро исследуемого белка. Радужные шарики (модель spacefill) - гидрофобные аминокислоты; color translucent - гидрофильные аминокислоты.
Гидрофобные взаимодействия можно найти с помощью Jmol. Рисунок 1 был получен с помощью набора команд, предложенного на лекции (из презентации наших преподавателей):
restrict protein color white color translucent 0.8 select (ala or leu or ile or val or met or phe or tyr or trp) and not (*.O or *.N or *.C or *.CA)
Также гидрофобные взаимодействия можно найти с помощью Protein Interactions Calculator. Полный список гидрофобных взаимодействий, полученных с помощью этого калькулятора, можно скачать по ссылке.
Стэкинг-взаимодействия в белке дисульфидного обмена Chlorobium tepidum TLS
Стэкинг-взаимодействия возникают между ароматическими системами. Наиболее широко они распространены в ДНК, но и белках тоже встречаются. В белках их могут давать ароматические аминокислоты - Phe, Tyr, Trp.
Искать стэкинг-взаимодействия в белке мы будем с помощью выше упомянутого Protein Interactions Calculator. Результаты для цепи A:
|
58 |
TYR |
A |
75 |
TRP |
A |
|
61 |
PHE |
A |
127 |
TYR |
A |
|
62 |
TRP |
A |
105 |
PHE |
A |
|
73 |
PHE |
A |
105 |
PHE |
A |
|
73 |
PHE |
A |
113 |
PHE |
A |
|
75 |
TRP |
A |
151 |
PHE |
A |
|
127 |
TYR |
A |
136 |
PHE |
A |
Графические изображения некоторых из этих взаимодействий представлены на рисунке 2. Как видно из угла между взаимодействующими ароматическими системами - это Т-стэкинг.
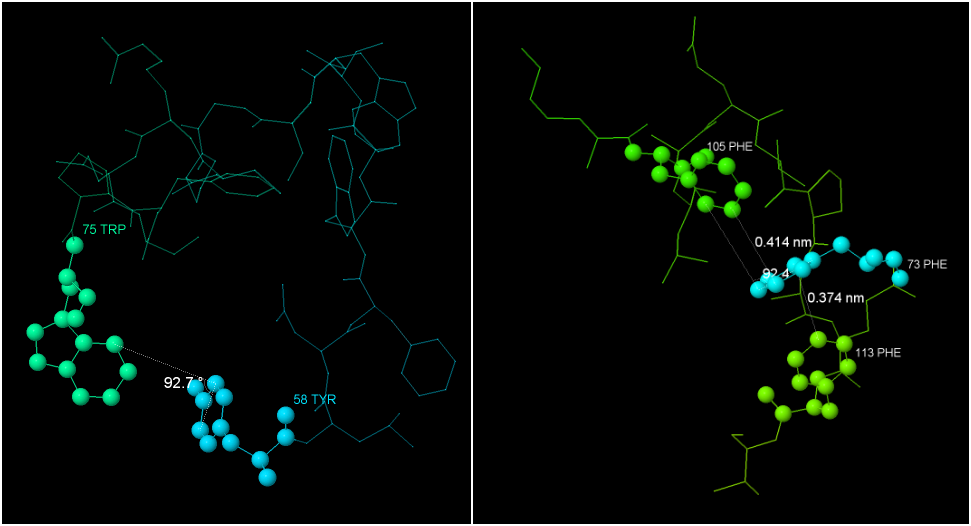
Рис. 2. Стэкинг-взаимодействия в белке дисульфидного обмена Chlorobium tepidum TLS. Справа - T-стэкинг между 58 [TYR] и 75 [TRP]. Моделью cpk 100 показаны 2 аминокислотных остатка, участвующих во взаимодействии. Обозначен угол между ароматическими системами. Слева - стэкинг 105 [PHE] - 73 [PHE] - 113 [PHE]. Обозначены расстояния между ароматическими системами.