ФББ 2013-2014
ФББ 2013-2014
Описание областей контакта c лигандами в структуре белка с неизвестной функцией (PDB: 3GBY)
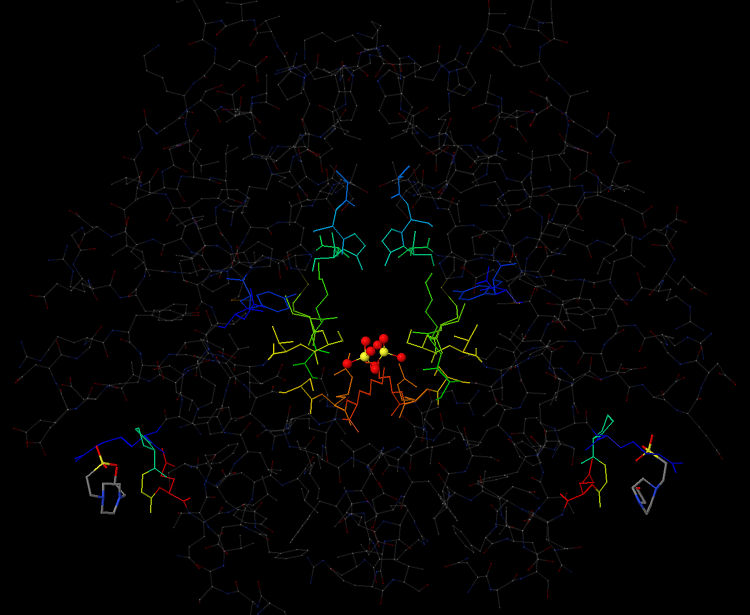
Рис.1. Общий вид белка 3GBY. Яркими цветами выделены области контакта белка с лигандами и сами лиганды - SO4 (2-) и EPE. Лиганд-анион SO4(2-) показан в шариковой модели, лиганд EPE - в проволочной (wireframe 30).
Белок с идентификатором 3GBY имеет 3 сайта связывания лигандов. Один из них, связывающий два аниона SO4(2-) расположен в центре, в области контакта двух CBS-доменов. Два других расположены "на краях" каждого домена и связывают лиганд EPE. Рассмотрим каждый сайт отдельно.
Сайт связывания лиганда SO4(2-)
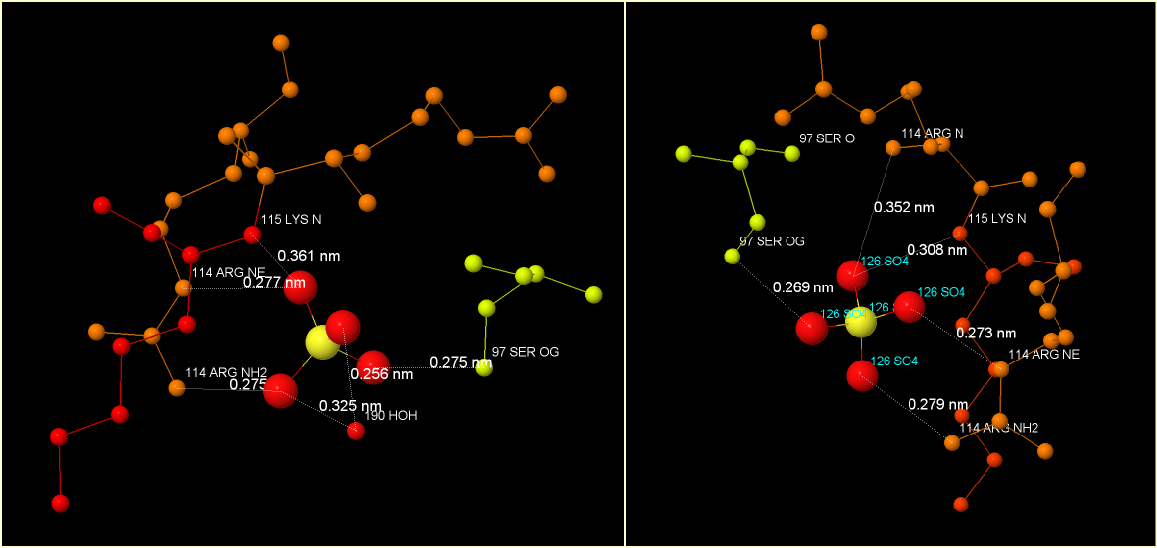
Рис.2. Сайт связывания двух анионов SO4(2-). Показаны водородные связи между атомами кислорода лиганда и аминокислотными остатками [97] Ser, [114] Arg, [115] Lys. Также одна из групп SO4(2-) образует водородные связи с водой ([190] HOH). Подписаны расстояния между атомами, названия атомов.
Лиганд-анион SO4 (2-), скорее всего, взялся из буфера, а в природе этот сайт связывает другую молекулу. Чтобы понять какую, я обратилась к сайту string-db.org, который строит граф функциональных связей данного белка с другими белками в клетке на основе совместной экспрессии, совместного присутствия в клетке и других факторов.
Как показали результаты (приведённые на рисунке 3), ген белка CT1051 экспрессируется вместе с генами 5-формилтетрагидрофолат цикло-лигазы ( что это ), полифосфат киназы (ppk2), рибоза-5-фосфат изомеразы и пептидазы класса M20/M25. Вместе эти гены составляют оперон, а значит, скорее всего, их функции в клетке тесно взаимосвязаны.
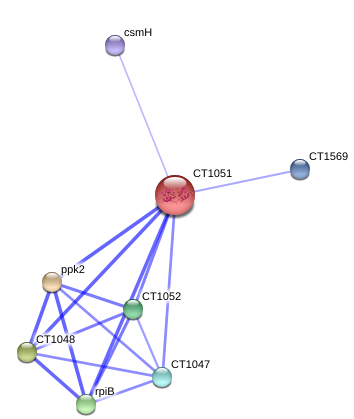
Рис.3. Граф белков, предположительно взаимодействующих с исследуемым белком (на рисунке это CT1051 в центре). Расшифровка аббревиатур: ppk2 - полифосфат киназа; CT1048 - 5-формилтетрагидрофолат цикло-лигаза; rpiB - рибоза-5-фосфат изомераза; CT1052 - пептидаза семейства M20/M25/M40.
Из этих данных понятно следующее — рассматриваемый белок скорее всего связан с фосфатным обменом. Также на это указывает домен, входящий в состав белка — CBS домен. Ознакомившись со статьями по этому домену, я пришла к выводу, что чаще всего он связывает АТФ/АДФ/АМФ, особенно часто он это делает в форме гомодимера, как в нашем случае. CBS-домены очень распространены в природе, их обнаруживают в белках с совершенно разными функциями. При этом они встречаются у всех групп живых организмов, в том числе и у человека.
В том месте, где связалось SO4 (2-) из буфера, скорее всего должны были быть фосфатные группы какого-то из вышеназванных нуклеотидов. Они связываются водородными связями с Ser [97], Lys [115], Arg [114], путём обобществления водорода -OH группы серина или NH-групп лизина и аргинина. Помимо фосфатных групп, в нуклеотиде могут образовывать водородные связи -OH группы рибозы и электроотрицательные N в аденине. Эти атомы могут также взаимодействовать с другими аминокислотными остатками, за счёт чего связывание лиганда будет более прочным. Также может происходить стэкинг между тирозином и ароматической системой аденина, хотя, на мой взгляд, тирозин расположен слишком далеко от возможного положения нуклеотида.
Здесь мы подошли к важному вопросу — какую же функцию имеет наш белок с «неопределённой функцией». В базе данных pdb и genome (ncbi) информации о функции белка не содержится, но в базе данных RefSeq указано, что это гистидиновая киназа. Немного поискав информацию про этот тип киназ, я узнала, что в прокариотах они входят в состав системы сигнальной трансдукции, чаще всего являются в этой системе сенсорами, которые потом передают информацию дальше на регуляторный белок. За счёт наличия различных доменов у сенсорных и регуляторных белков они могут реагировать на изменение уровня разных веществ в клетке (например, фосфатов, как в нашем случае).
Пришлось ознакомится со статьями на эту тему. Первое, с чего я начала — это поиск консервативных сайтов гистидиновых киназ в моём белке. Из этого «анализа» удалось понять, что гистидин в активном центре расположен консервативно и скорее всего после связывания нуклеотида происходит автофосфорилирование остатка гистидина, что меняет конформацию белка и приводит к передаче сигнала.
Результаты BLAST по последовательности аминокислот оказались довольно предсказуемыми: наибольшее сходство наблюдалось либо с белками с неуказанной функцией, либо с белками, которым в базе данных RefSeq присвоены функции гистидиновых киназ. Результаты BLAST по нуклеотидной последовательности были очень пессимистичными — хоть какое-то приличное совпадение было только с геном бактерии из того же рода (Chlorobium tepidum parvum).
Чаще всего гистидиновые киназы являются мембранными белками, однако в случае белка CT1051 нет никаких признаков, что он заякорен в мембране.
Сайт связывания лиганда EPE
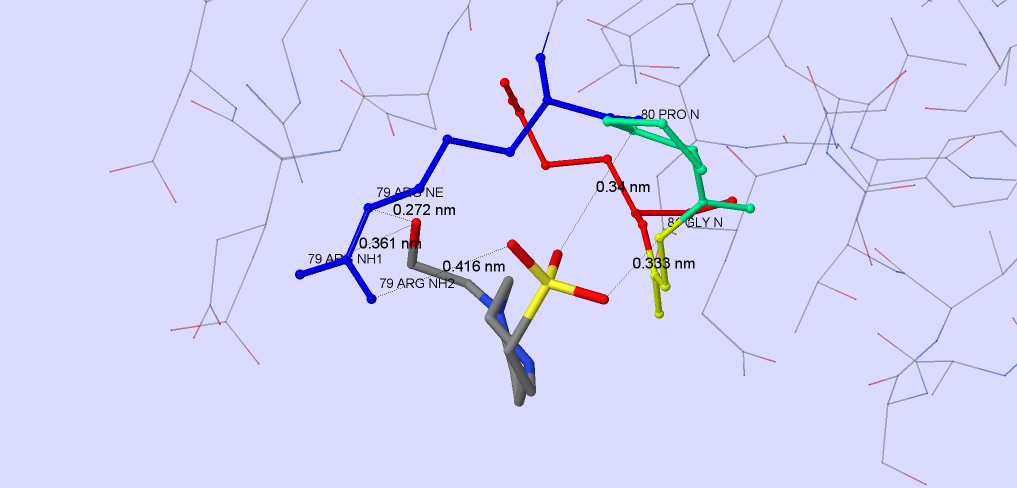
Рис.4. Сайт связывания лиганда EPE. Показаны остатки, участвующие во взаимодействии с лигандом. Лиганд показан в проволочной модели и стандартных цветах (color cpk). Водородные связи образуются между лигандом и [79] Arg, [80] Pro, [81] Gly.
Скрипт, воспроизводящий рисунок 4 находится здесь.
EPE (4 (2-гидроксиэтил)-1-пиперазин этансульфоновая кислота) – это лиганд из буфера, в котором кристаллизовали белок. В номенклатуре PDB отнесён к типу HET. Скорее всего он был добавлен в раствор, чтобы ингибировать белок. Биологического смысла этот лиганд не несёт, однако он позволяет сделать предположение о том, какого рода молекулы могут садиться на данный сайт в живых системах.
Для этого рассмотрим химическое строение EPE. Как мы видим, этот лиганд имеет сильно полярную группу SO4 (2-), она образует большое количество водородных связей с остатком аргинина. За счёт образования дополнительных водородных свзяей с двумя другими остатками (рисунок 4), лиганд ещё прочнее связывается с белком.
Исходя из данных по взаимодействию этого белка с другими белками, я думаю, что данный сайт может взаимодействовать с какой-нибудь частицей, содержащей PO4 (3-), поскольку белок явно задействован в фосфатном обмене. Анион PO4(3-) по геометрии похож на анион SO4(2-) - оба представляют из себя тетраэдры, из-за этого я считаю такое взаимодействие возможным.
Я думаю, что данный сайт может функционировать как регуляторная область в белке. Она либо принимает какой-то сигнал извне и реагирует на это таким изменением конформации белка, что основной сайт становится активным (или наоборот неактивным), либо же после связывания лиганда с основным сайтом эта область реагирует на изменение конформации, связывая какой-нибудь вещество. Для меня последовательность действий пока что не ясна, однако я думаю, что EPE-сайт играет скорее вспомогательную роль, а не основную.
Ещё одна деталь привлекла моё внимание — структура каждой цепи неполная. По данным NCBI в каждой цепи этого белка должно быть 224 аминокислотных остатков, в нашей же структуре их по 128. Во-первых, это значит, что никакого окончательного вывода о функции мы сделать пока что не можем, т. к. потеряна примерно половина настоящей структуры. Во-вторых, надо спросить у геномного браузера, что там мог быть за домен.
Рис.5. Структурное выравнивание, проведённое средствами NCBI. Видно, что после CBS-домена в цепи определяется также ACT-домен, которого нет в расшифрованной структуре. Это грустно.
Сделав это, я увидела, что у этого белка в каждой цепи должен был быть ещё ACT-домен, про который я не успела прочитать ничего, кроме того, что он часто связывает аминокислоты, тем самым участвуя в их метаболизме.
Проект генно-инженерного эксперимента с белком с неизвестной функцией (PDB идентификатор: 3GBY)
Отталкиваясь от предположения, что это всё-таки гистидиновая киназа, я бы сделала следующее:
1) Не стала бы заменять остаток аспартата на селенметионин для определения структуры. То, что именно эта замена была сделана, видно из выравнивания на рисунке 5 (буквой X обозначается аспарагиновая кислота или аспарагин). Мне кажется, тут очень неудачно выбрано место, куда вставлять селенметионин, потому что часто в гистидиновых киназах прокариот после автофософорилирования гистидина происходит перенос фосфата на аспарагиновую кислоту. При чём по выравниванию видно, что вставка была произведена рядом с гистидином. Я думаю, нужно либо сменить метод расшифровки структуры, либо использовать для стабилизации CBS-домена какой-нибудь лиганд, который может связаться с сайтом в центре. Селенметионин же можно вставить вместо какой-нибудь аминокислоты в ACT-домене, чтобы его структуру можно было увидеть и понять, как он функционально связан с CBS-доменом.
2) Можно заменить остаток гистидина на какую-нибудь гидрофобную аминокислоту и посмотреть, как будет функционировать этот фермент. Интересно заменить именно его, т.к. он не участвует непосредственно в связывании лиганда, но на него переносится фосфат.