2013-2014
2013-2014
База данных STRING
Группа зелёных бактерий, включающая в себя род Chlorobium, эволюционно обособленна. Для неё характерны некоторые уникальные особенности строения и метаболизма. Известно, что они могут осуществлять фотосинтез с помощью хлоросом - специальных органелл, в состав которых входит бактериохлорофилл и каротиноиды. В качестве источника электронов для фиксации углерода эти бактерии используют соединения серы. Про обмен углеродов у Chlorobium известно очень мало.
В прошлом семестре мне довелось работать с белком с неизвестной функцией, имеющим PDB идентификатор 3GBY. Он расположен в локусе CT1051. Ранее этот белок был записан как "белок с неизвестной функцией", теперь он определён в класс гистидиновых киназ (автоматическое определение по сходству последовательностей). Для того, чтобы проверить эту информацию, воспользуемся базой данных String. В ней найдём наш белок CT1051 - получили геномное окружение. Найдём теперь гомологи CT1051 у самых филогенетически близких Chlorobium tepidum организмов. Например, у Chlorobaculum parvum гомолог нашего белка определяется как "сигнальный белок с CBS доменами". Помимо этого, геномное окружение гомологичного белка состоит из ферментов тех же классов, что и геномное окружение CT1051 в Chlorobium tepidum. Из этого можно сделать вывод, что скорее всего и CT1051 выполняет сигнальную функцию.
На рисунке 1 представлен граф взаимодействий белков с CT1051 на первой уровне близости в режиме evidence. Зелёный цвет линий, соединяющих вершины графа, говорят нам о том, что доказательство взаимодействия получено только на уровне соседства генов в геноме.
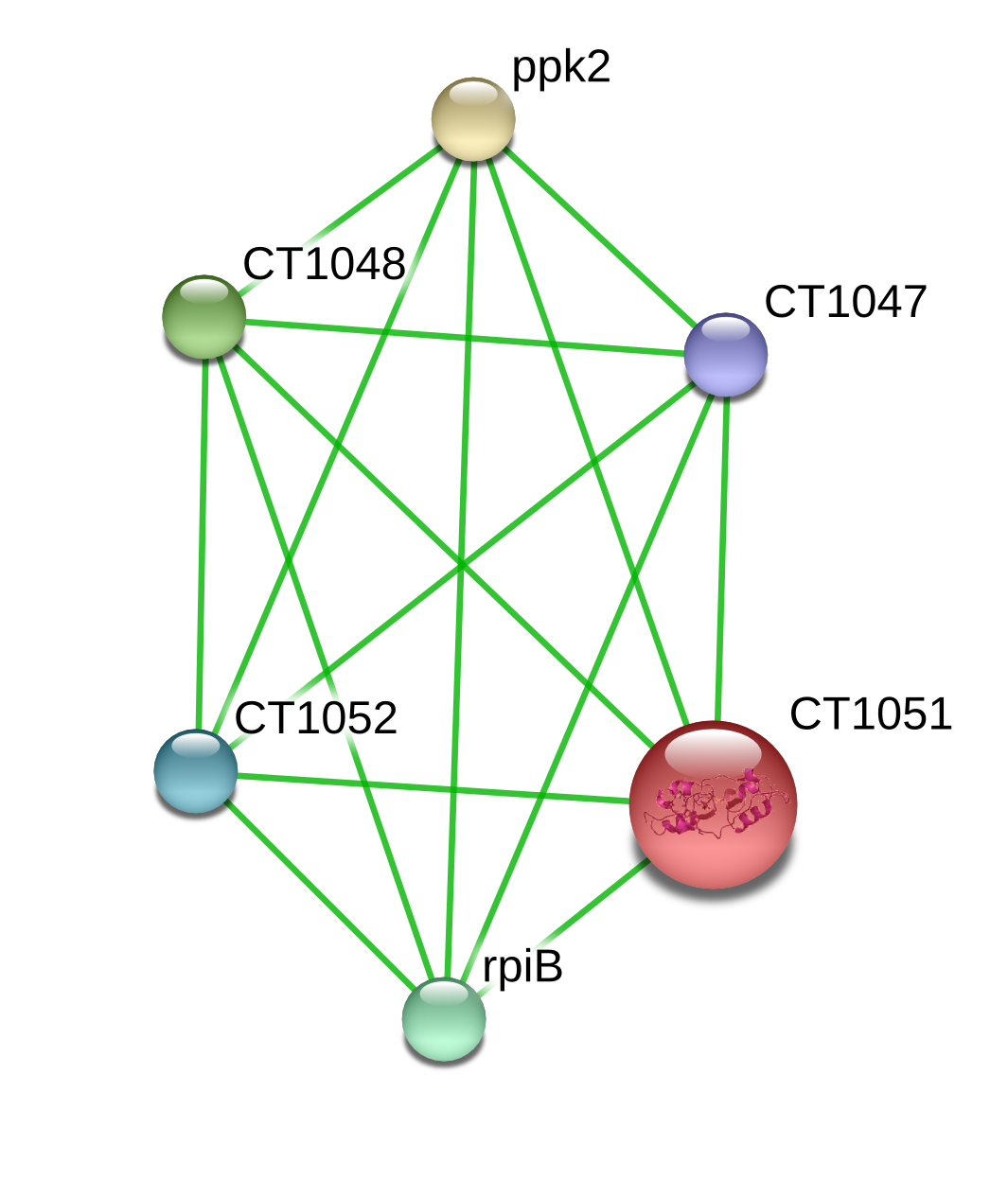
Рис.1. Граф белок-белковых взаимодействий на первом уровне близости для белка CT1051.
Теперь рассмотрим граф взаимодействия других белков с CT1051. На первом уровне близости с белком CT1051 взаимодействуют следующие белки:
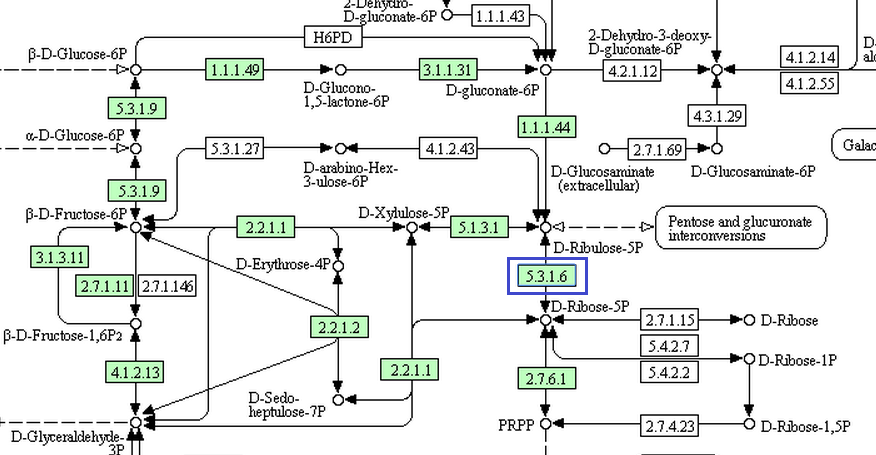
Рис.2. Часть пентозофосфатного пути, в котором участвует rpiB. rpiB показан синим квадратом.
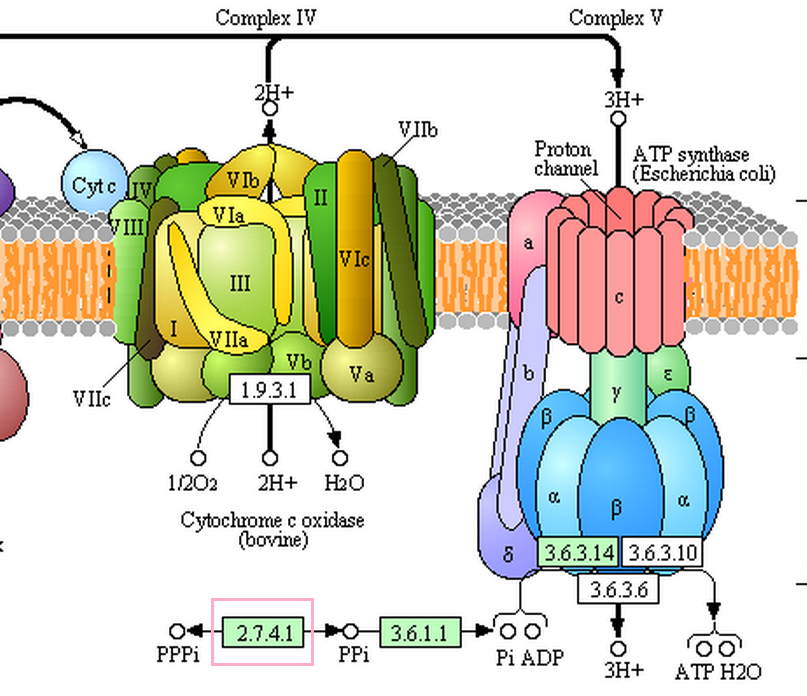
Рис.3. Часть пути окисительного фосфорилирования, в котором участвует ppk2. ppk2 показана розовым квадратом
Все гены белков, находящихся на первом уровне близости с CT1051 транскрибируются вместе с ним, то есть они входят в один оперон. Из функционального описания белков не ясно, какой процесс они могут регулировать/осуществлять совместно. У филогенетически близкого к Chlorobium tepidum организма - Chlorobaculum parvum - существует такой же оперон. Значит, эти белки всё-таки должны работать вместе, но знаний для определения их роли в клетке Chlorobium tepidum нам не хватает.
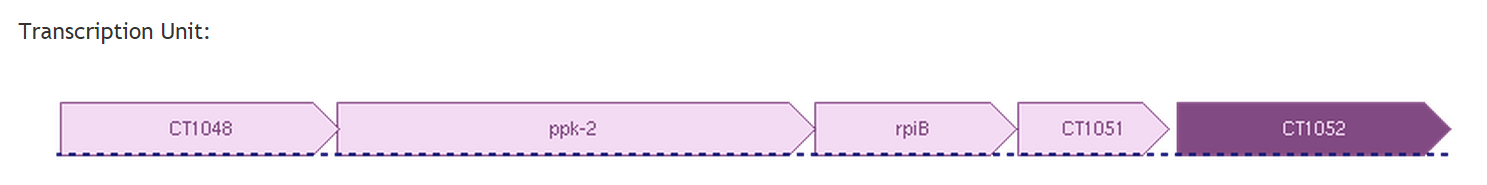
Рис.4. Оперон, в который входит CT1051
Теперь проверим геномное окружение для нашего белка у других организмов. Оно представлено на рисунке 5. Как видно, есть 6 генов, 5 из которых образуют оперон в силу своей однонаправленности. Эти гены уникальны для группы Chlorobium и Pelodiction: другие бактерии, эукариоты и археи не имеют гомологичных генов. На рисунке 5б представлено развёрнутое дерево. Интересно, что эти 5 генов либо присутствуют все в виде оперона, либо не присутствуют вообще. Единственное исключение - у Chloroherpeton thallassium нет гена CT1052 (M20/M25/M40 пептидаза).


Рис.5. Геномное окружение CT1051 в Chlorobium tepidum и гомологичных ему белков в других организмах. Фиолетовым цветом обозначен CT1047 - гипотетический белок, зелёным - CT1048 - 5-формилтетрагидрофолат циклолигаза, жёлтым - CT1049 - ppk2, салатовым - CT1050 - rpiB, красным - CT1051 - белок с неизвестной функцией (скорее всего сигнальный белок), синим - CT1052 - M20/M25/M40 пептидаза.
Далее был получен график совместной встречаемости, представленный на рисунке 6. Закрашенность квадрата прямо пропорциональна уровню достоверности гомологии. Полнота квадратика отражает степень встречаемости данного белка у организмов. Как видно из рисунка 6, степень встречаемости у всех организмов клады Chlorobi/Pelodiction высокая, совместная встречаемость внутри клады также на высоком уровне. Все эти данные ещё раз подтверждаают, что образуется оперон из 6 генов, которых объединяет совсместная функция.

Рис.6. График совместной встречаемости гомологов белков из геномного окружения