Описание структуры THE CRYSTAL STRUCTURE OF CYTOCHROME C' FROM RUBRIVIVAX GELATINOSUS AT 1.5 A RESOLUTION AND PH 6.3
Петренко Павел
Факультет биоинженерии и биоинформатики, Московский Государственный Университет имени М.В.Ломоносова
Структура в целом
The Crystal Structure of Cytochrome C' - это гем-содержащий белковый комплекс, выделенный из пурпурных несерных бактерий. Он относится к классу цитохромов и содержит в структуре гем типа с. Комплекс белка образован двумя идентичными полимерными цепями Cytochrome c' (цитохрома с'), в состав которых входят структуры Heme c (гем с). Таким образом, в одну биологическую единицу входит одна полимерная цепь с одной структурой гема с. В связи с тем, что цепи А и В одинаковы, как и структуры C и D, далее будет рассмотрена одна из биологических единиц.
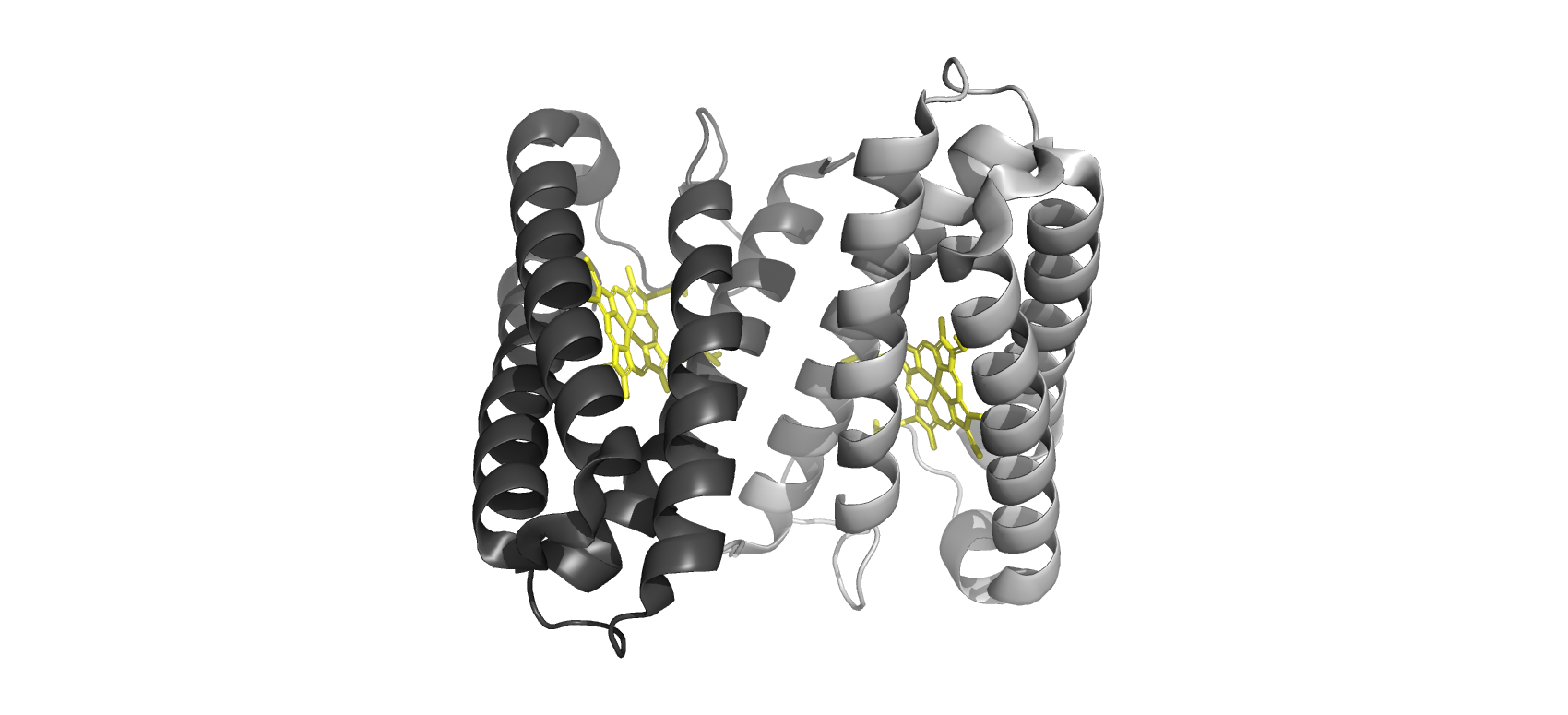
Отдельные цепи
Данные UniProt:
uniprot_id: P00142
Название: Cytochrome c'
Выделен из: Перимембранного пространства пурпурных несерных бактерий Rubrivivax gelatinosus.
Функция: Их точная функция неизвестна. Однако, предположительная молекулярная функция - управляемое движение электронов от одного молекулярного комплекса к другому, приводящее к передаче энергии и/или редуксно-окислительному преобразованию химических видов. Эта функция имеет фундаментальное значение для различных биологических процессов, включая клеточное дыхание и фотосинтез, а также многочисленные ферментативные реакции, участвующие в метаболизме. Вторая функция - связывание с гемом, соединением, состоящим из железа, комплексированного в кольце порфирина (тетрапиррола), и удержание иона железа (Fe).
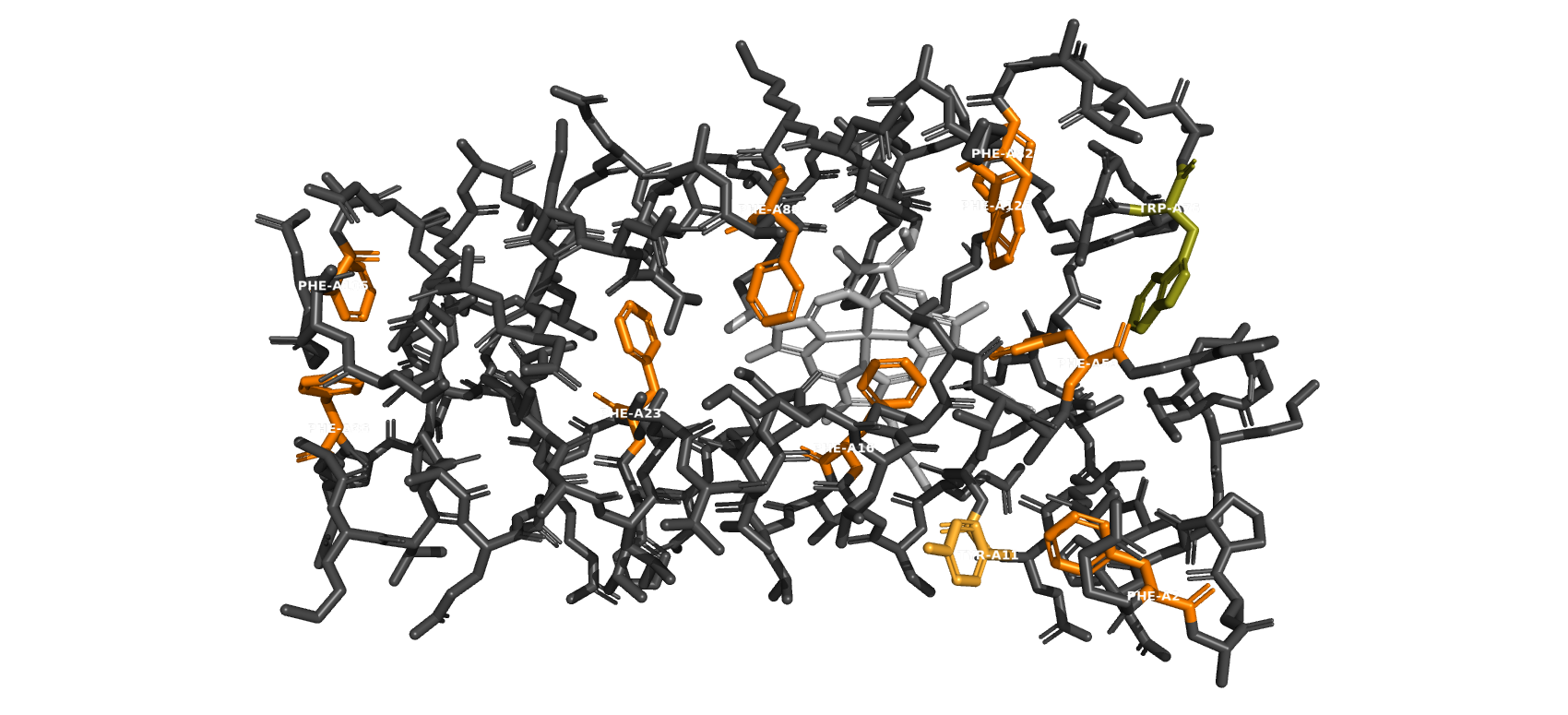
По аминокислотной последовательности цепи А и В идентичны, в каждой цепи 6 α-спирали и 1 β-слой (согласно базе PDB β-слои отсутствуют).
Каждая цепь состоит из 129 аминокислот и не содержит мутаций относительно базы Uniprot. В базе PDB мутаций также нет.
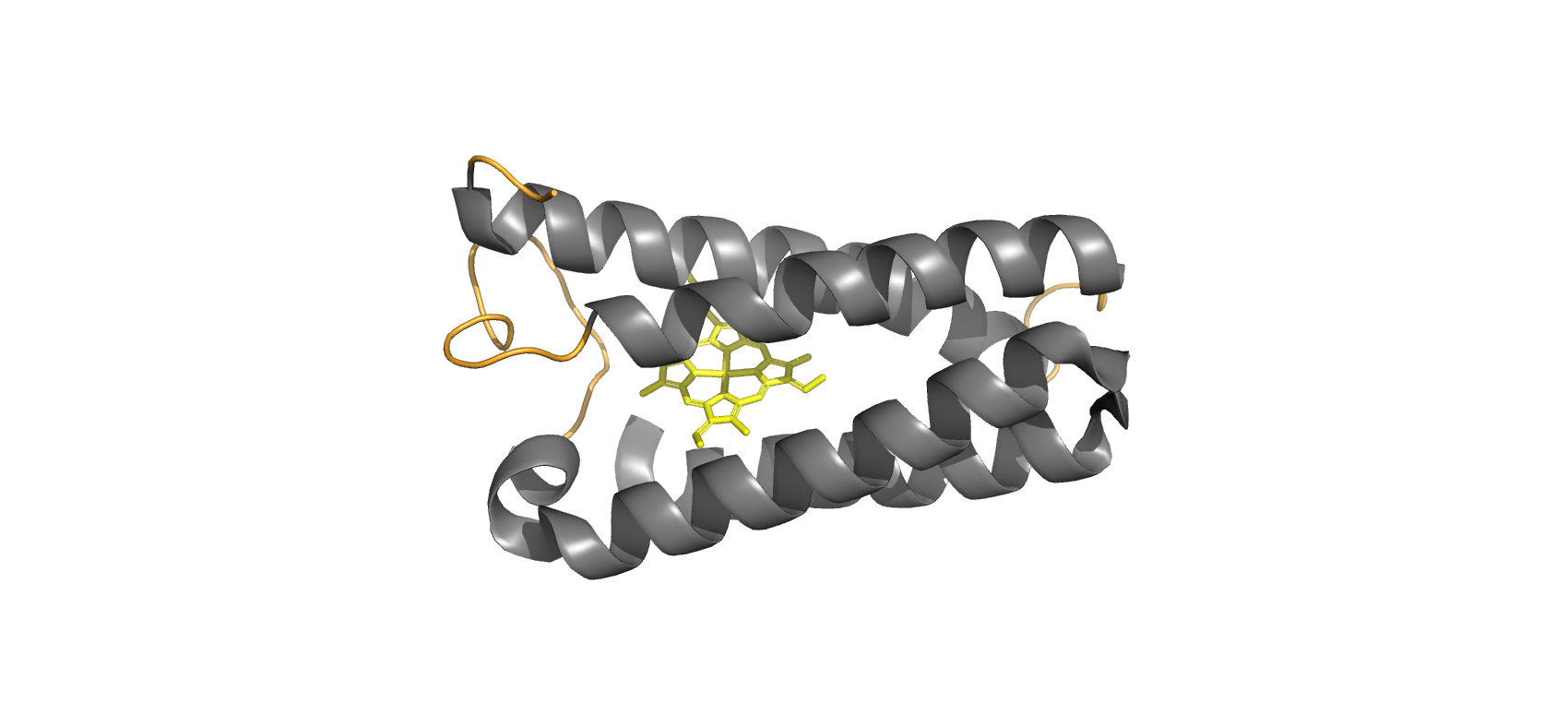
Серым покрашены альфа-цепи, оранжевым - петли, жёлтым - гем С, бета-листов нет.
Малые молекулы
Данные UniProt:
Краткое наименование: HEC
Полное наименование: HEME C (Гем с)
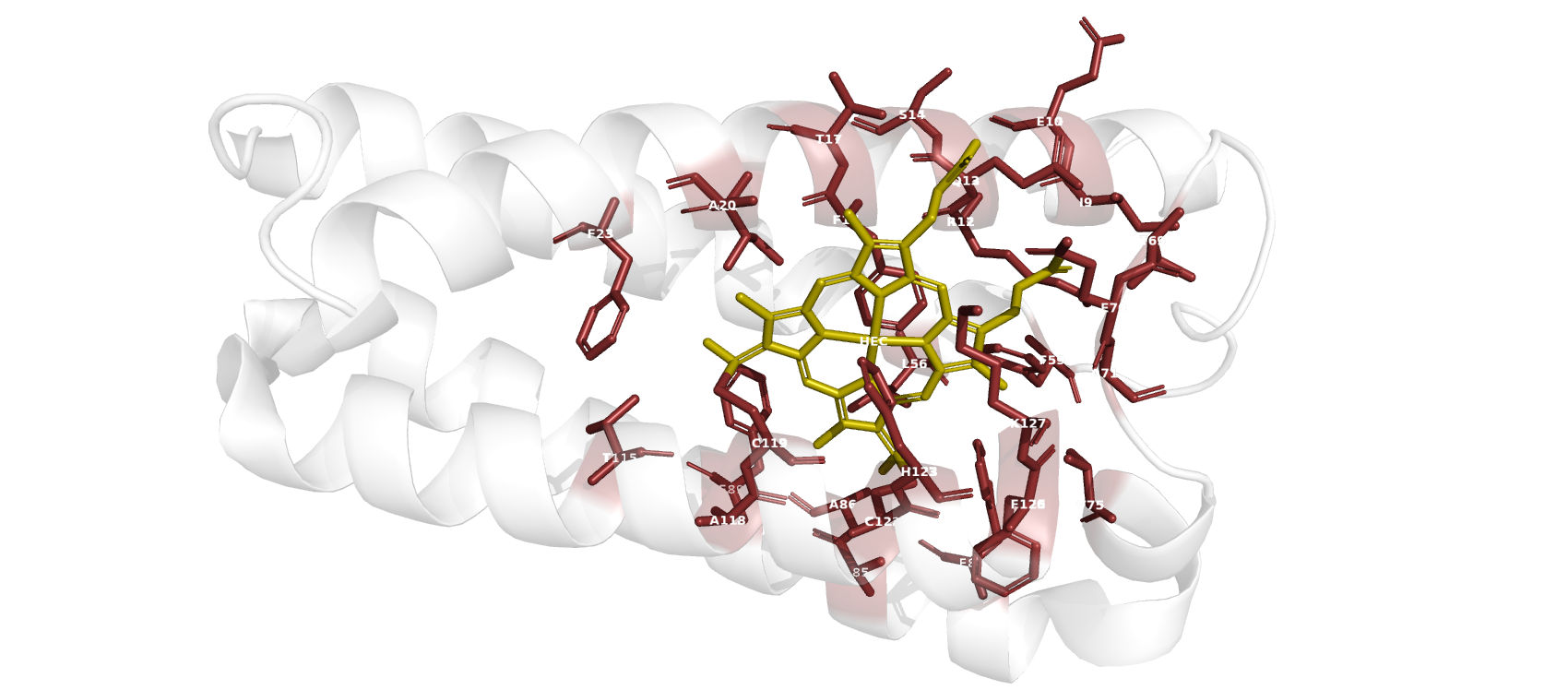
Взаимодействия между аминокислотными остатками
Водородная связь, затрагивающая атомы остова белка
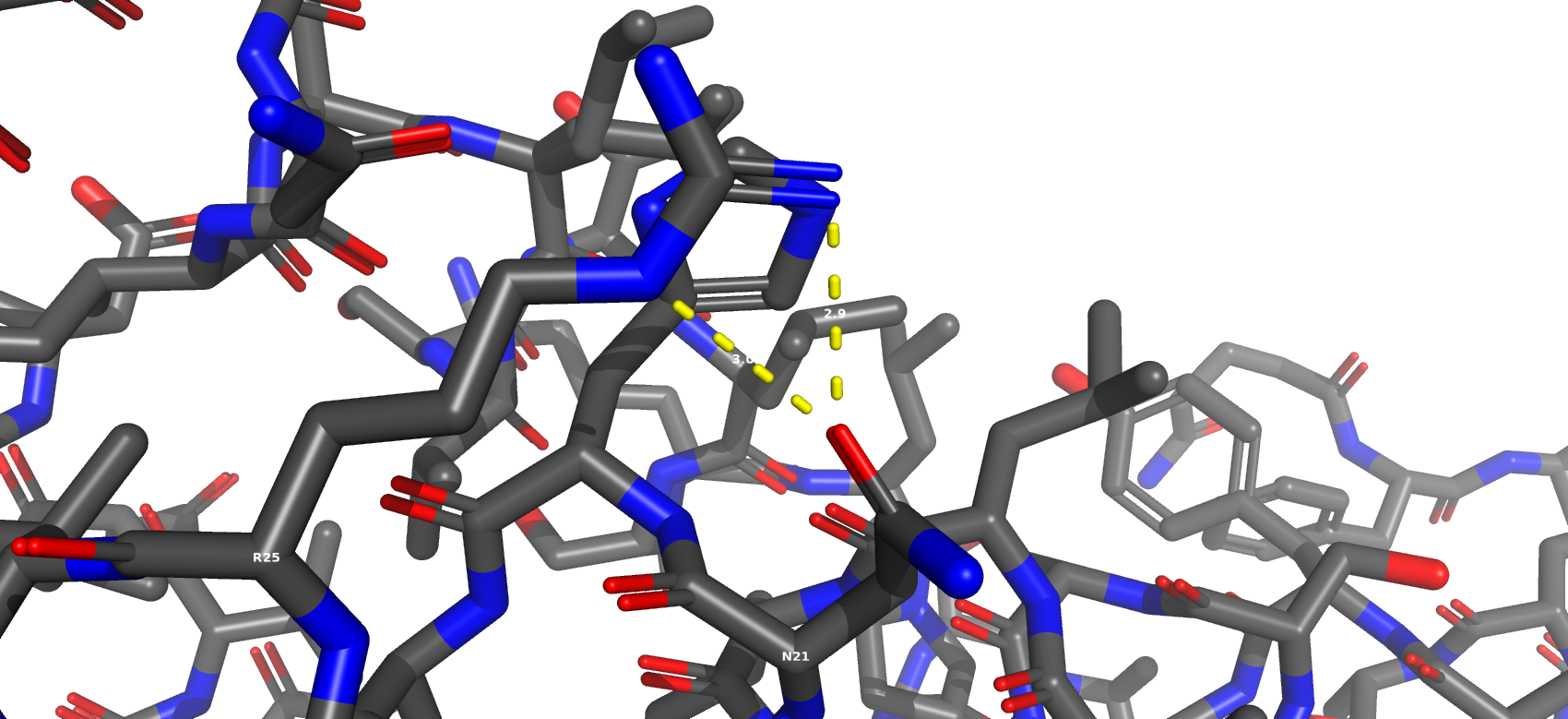
Водородная связь, затрагивающая атомы боковых радикалов аминокислот
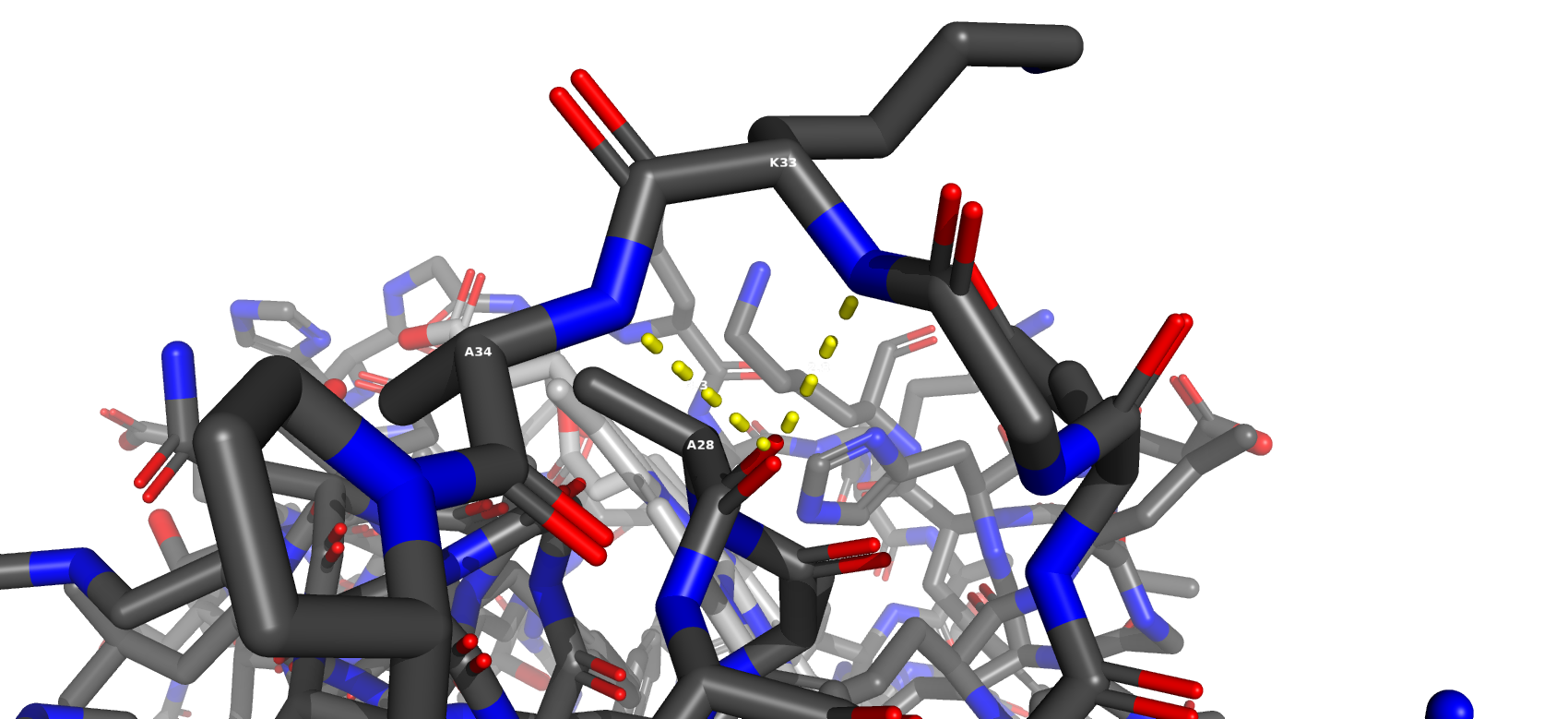
Солевой мостик
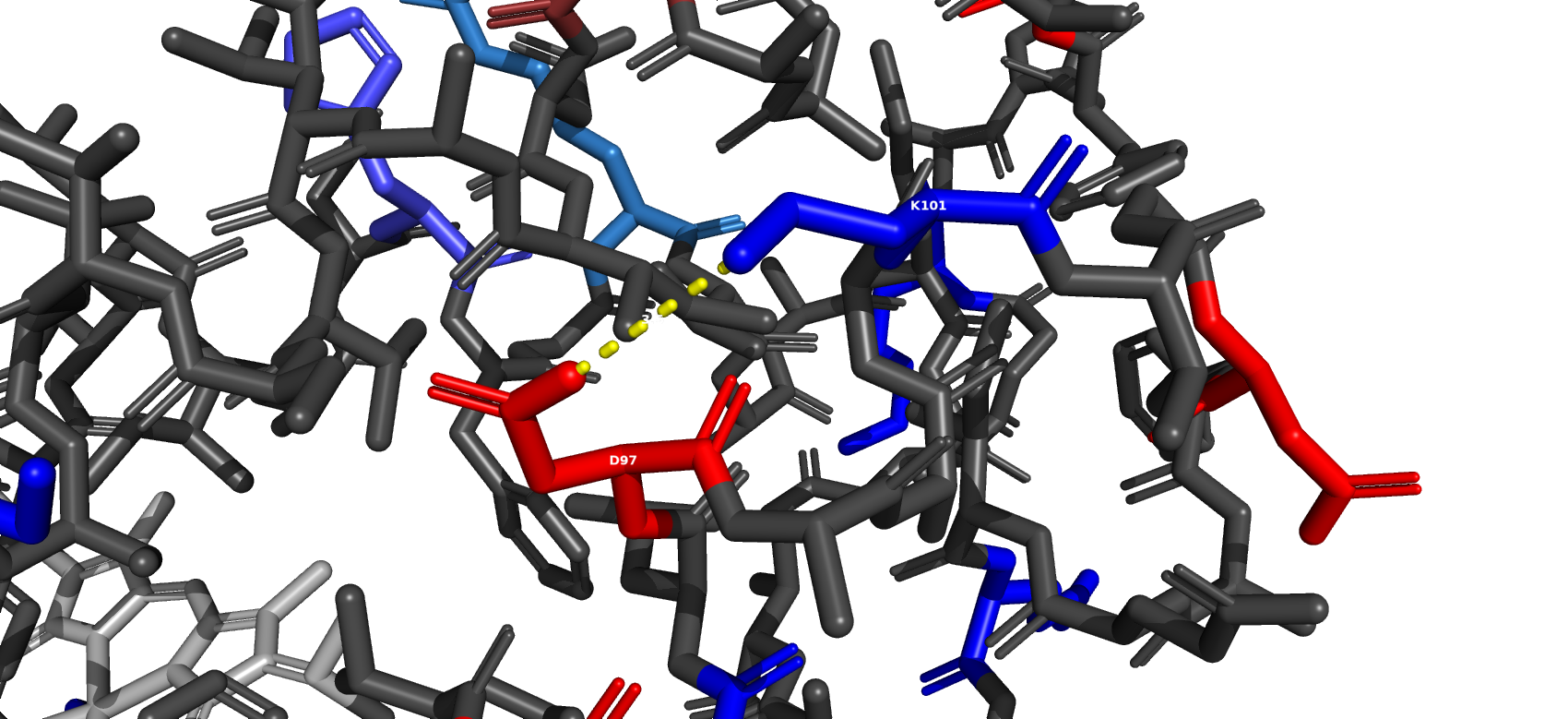
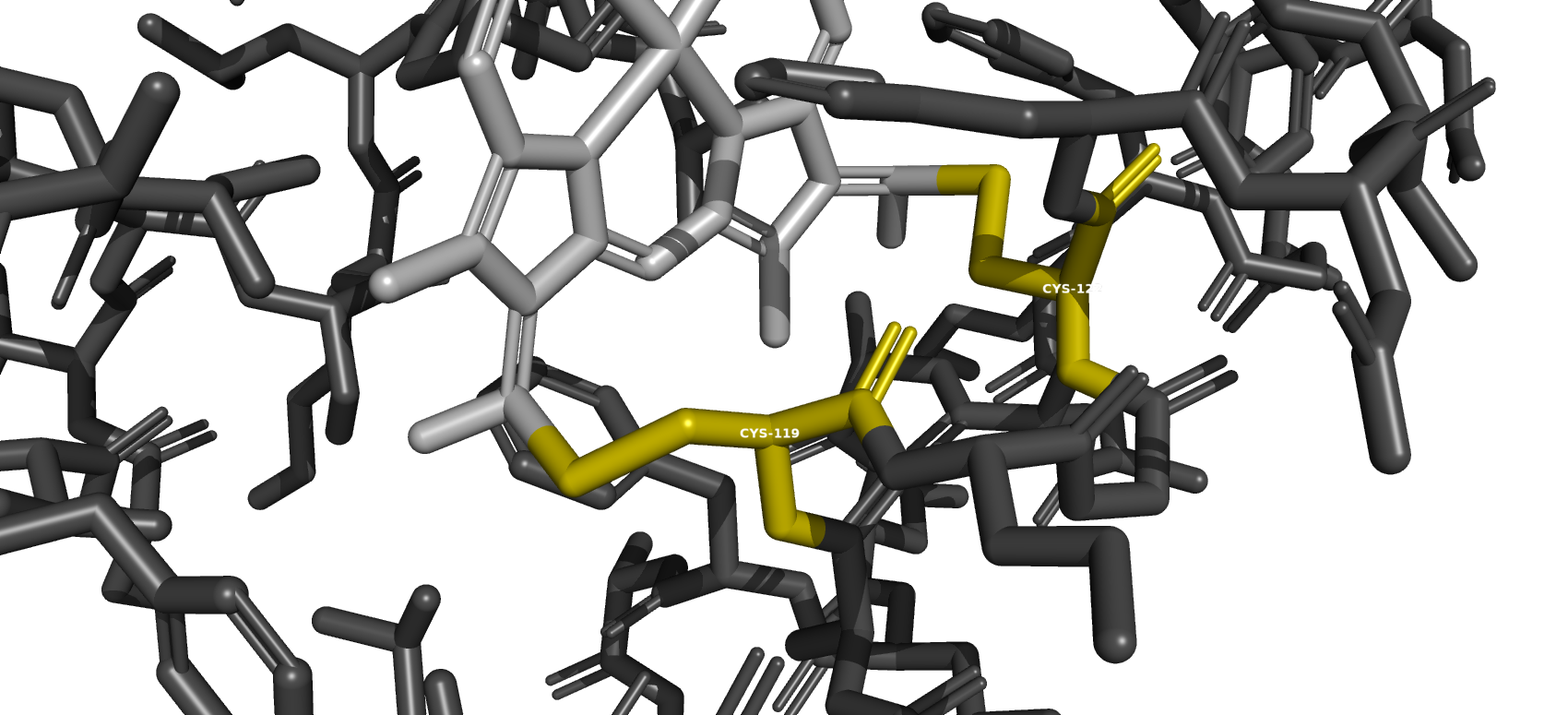
Дисульфидная связь
Дисульфидных связей в молекуле нет
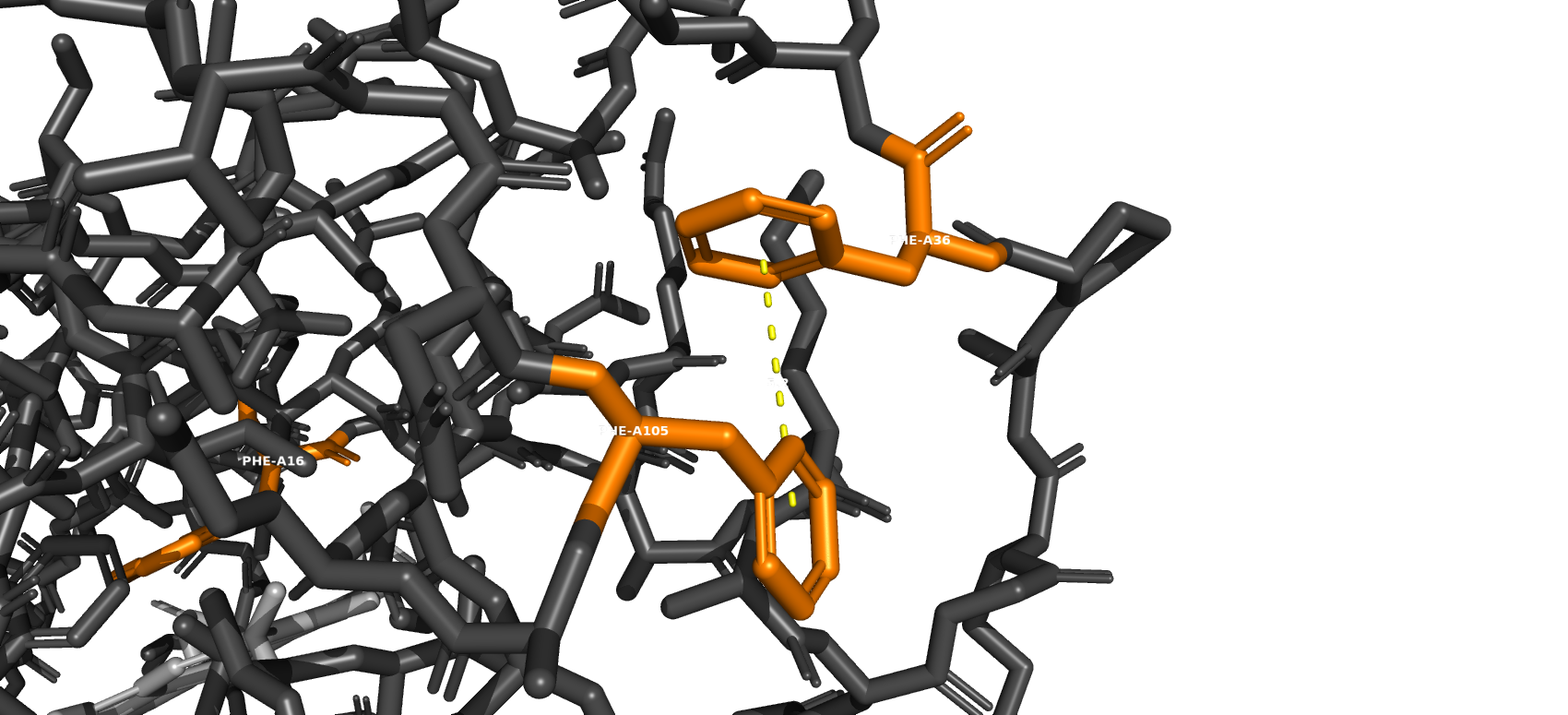
Стекинг
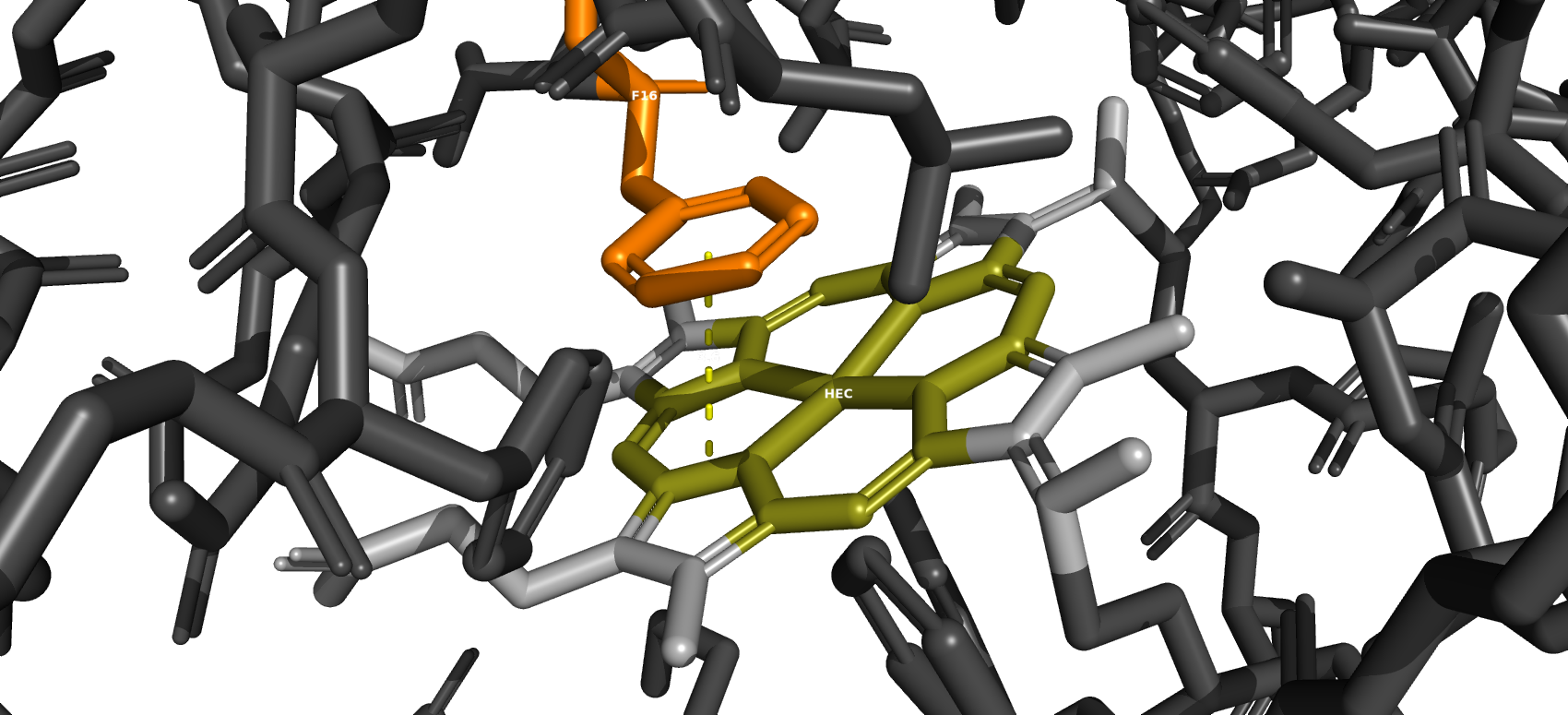
Стекинг-взаимодействия в данной молекуле маловероитны из-за геометрического расположения ароматических колец таких аминокислот как фенилаланин, тирозин и триптофан относительно друг друга. Однако некоторые ароматические кольца расположены достаточно близко, чтобы всё-таки предположить о возможности стеккинг-взаимодействий. Также был найден участок взаимодействия фенилаланина (F13) с лигандом.