Практикум 3
Атлас контактов куриного белка LGP2
Идентификатор белкового комплекса в PDB[0]
(PDB ID): 5JAJ
UniProtKB - G0YYQ5 (G0YYQ5_CHICK)
Выбранный нами белок был найден у Gallus gallus(рис. 1) и представляет интерес для областей науки, изучающих
механизмы иммунного ответа.
Белок LGP2 является РНК-зависимой АТФ-азой, играющей ключевую роль в качестве части цитозольного рецептора,
индуцирующего иммунный
ответ[1] против РНК вирусов, таких как Influenza A virus
, Flavivirus ,
Sendai virus .
Рисунок 1. Gallus gallus

Наравне с MDA5[2](ген, ассоциированный с развитием меланомы) и RIG-I[3]
(ген, индуцируемый ретиноевой кислотой),
LGP2 составляет семейство белков RLR, сходных с RIG-I рецепторов.
Белок имеет два домена: АТФ- связывающий и С-терминальный репрессорный домен, посредством которого происходит
взаимодействие с RIG-I хеликазой.[4]
На Branchiostoma japonicum было показано, что LGP2 и RIG-I являются важными участниками врождённого внутриклеточного
иммунитета.[5]
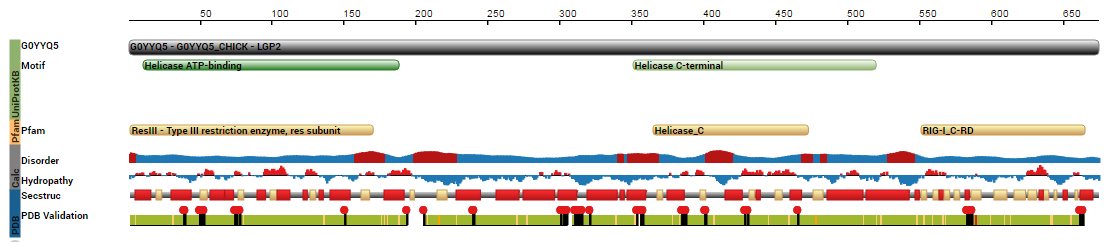
АТФ-связывающий домен содержит 10 альфа-цепей, 6 бета-тяжей. Из рисунка 2 видно, что АТФ-связывающий домен более
упорядочен,
чем С-терминальный репрессорный домен. Также риснок 2 показывает, что суммарная гидрофобность белка внутри доменов выше,
чем в междоменных пространствах.
LGP2 взаимодействует с Хеликазой-С, RIG-I и рестрикционным белком третьего типа. Будучи несигнальным чувствительным
к оксидативному стрессу белком, LGP2
обнаруживает
способность как к положительному, так и к отрицательному регулированию MDA5 и RIG-I соответственно. Это может объясняться тем, что
chLGP2 и chMDA5
имеют сходные последовательности с
осевыми повторами.
RIG-I, в основном, чувствителен к 5ppp концевым dsРНК (5ppp-dsRNA), тогда как MDA5 активируется более длинными dsРНК.
Следовательно, оба белка обеспечивают различное по сайтам, но
чрезвычайно важное функционально узнавание вирусных РНК.[6]
Рисунок 2. Обзор физико-химических особенностей LGP2
Апплет 1. Общие представления о белке
Общие представления о белке
Апплет 1 демонстрирует структурную организацию белка LGP2.
Белок имеет следующие параметры ширины к высоте: 7.9 нм / 4.6 нм. Длина белковой части- 681 аминокислотных остатков.
Первая визуализация показывает расположение и качество цепей молекулы. Можно заключить, что LGP2 содержит три цепи: две
рнк и одну белковую. Белок имеет 20 альфа-спиралей и 24 идентифицируемые бэта-цепи.
Раскарска по вторичной структуре на второй визуализации показывает наличие альфа-спиралей и бета-слоёв. На визуализации
три
заметно, что альфа-спирали, образующие
каркас и служащие для поддержания стабильной структуры, находятся во всём объёме белка, тогда как бета-тяжи
располагаются преимущественно у
поверхности и в местах поворота белковой цепи. Поворот осуществляется посредством изменения вторичной, более
жёсткой, структуры или
её отсутствия в местах, требующих малых углов. По карте белка можно сопоставить места поворотов, связей,
3/10 спиралей и других элементов вторичной структуры (Смотрите ниже).
Визуализация четыре демонстрирует Ван-дер-Ваальсову модель белка,
отражающую Ван-дер-Ваальсовы
радиусы атомов, раскрашенных по химическим элементам. В РНК и показанных остатках аминокислот белка представленны
С, N, O, S, P.
На следующей визуализации оранжевым выделена РНК. Двойная правозакрученная спираль РНК имеет плотные гидрофобные
контакты с молекулой белка.
На поверхности белка заметен, возможно, активный центр для посадки АТФ с выделенной зелёным АДФ.
РНК и лиганды в
объёме белковой молекулы,
показанные на визуализации шесть, выполняют важные каталитические и стабизализационные функции.
Карта белка

Описание
Данная карта отражает вторичную структуру белка LGP2. Верхней линией показана первичная структура белка, образующая элементы
вторичной структуры. Такое картитрвание позволяет наглядно демонстрировать строение бклка, а также проследить за взаиморасположением
элементов, указанных в легенде. Например, бэта-цепи, альфа-спирали, 3/10-спирали и связи.
Вторая линия указывает на сайты взаимодействия белка с другими молекулами.
Третья линия показывает места, подвергшиеся посттрансляционным модификациям и ключевыми взаимодействиями, влияющими на структуру.
Четвёртая и пятая линии демонстрируют информацию о аминокислотном составе и длине участка.
Отличительной особенностью белка 5JAJ является наличие связи между частями цепи А, стабилизируемой ионом цинка. Цинк связак
через цистеиновый цинковый палец. По имеющимся данным, подобные биологические мотивы могут быть использованы в качестве
молекулярного переключателя.[7]
Таблица 1. Процентное распределение аминокислот в белке
| Аминокислота |
Количество остатков в структуре |
Доля от аминокислот, % |
| Неполярные, алифатические (37,0%) |
| Gly | 41 | 6,0 |
| Ala | 51 | 7,5 |
| Val | 51 | 7,5 |
| Leu | 63 | 9,3 |
| Met | 16 | 2,3 |
| Ile | 30 | 4,4 |
| Ароматические (7,5%) |
| Phe | 25 | 3,7 |
| Tyr | 20 | 2,9 |
| Trp | 6 | 0,9 |
| Полярные, незаряженные (27,9%) |
| Ser | 41 | 6,0 |
| Thr | 35 | 5,1 |
| Cys | 18 | 2,6 |
| Pro | 21 | 3,1 |
| Asn | 27 | 4,0 |
| Gln | 48 | 7,0 |
| Положительно заряженные (15,4%) |
| Lys | 30 | 4,4 |
| Arg | 51 | 7,5 |
| His | 24 | 3,5 |
| Отрицательно заряженные (12,2%) |
| Asp | 26 | 3,8 |
| Glu | 57 | 8,4 |
Апплет 2. Описание белок-белковых контактов
1. Описание гидрофобных ядер белка.
Гидрофобные R-группы некоторых аминокислотных остатков избегают контактов с водным окружением и стремятся собраться вместе внутри глобулярной структуры,
где они защищены от соприкосновения с водой. Это явление и называется гидрофобным взаимодействием.
При помощи сервиса CluD были получены данные об атомах, входящих в состав гидрофобного ядра,
и их количество. По расчётам сервиса в белке 27 ядер, но только 3 из них достаточно большие (остальные 24 не больше 31 атома).
В первом ядре 964 атома (оно будет рассмотрено подробнее всего), во втором 167 и в третьем - 154. Это составляет 14,5%, 2,5% и 2,3% от
всех атомов структуры (6638) соответсвенно.
Суммарно гидрофобная часть белка - 19,4%
В составе 1 и 3 гидрофобных ядер аминокислотные остатки, а во 2 ядро входят как аминокислоты, так и азотистые основания,
направленные внутрь спирали РНК из-за гидрофобных взаимодействий.
2. Водородные связи.
Объединение макромолекулы помимо ковалентных связей часто происходит при помощи значительно более слабых взаимодействий,
например, водородных связей, энергия которых составляет всего лишь несколько ккалорий (энергия ковалентных связей достигает 80-100 ккал/моль).
В альфа-спирали полипептидный остов образует плотные витки вокруг длинной оси молекулы, тогда как R-группы аминокислотных
остатков выступают из спирального остова наружу. В бета-тяжах ориентация остатков чередуется вверх-вниз. Периодичность альфа-спиралей
приблизительно 0,54 нм, а бета-тяжей 0,70 нм. [8]
3. Стэкинг взаимодействия.
Cтэкинг взаимодействия - это гидрофобные связи, которые возникают при таком расположении
Ароматических молекул, которое напоминает расположение монет в стопке и поддерживается ароматическими взаимодействиями.
Часто наблюдается в ДНК, РНК, белках. [9]
Такие взаимодействия обусловлены дополнительным перекрыванием пи-электронов, существует Т-образная ориентация, сэндвич,
параллельное смещение.
Подобные взаимодействия были найдены между [PHE]309, 328 и [TYR]310 цепи нашего белка. На схеме показано их положение
относительно друг друга на остове альфа-спирали. В Jmol не предусмотрено измерение двугранных углов,
поэтому на экран выведены торсионные углы между ароматическими ядрами, приблизительно равные двугранным. Угол
между ароматикой [TYR]310 и [PHE]328 приблизительно 9 градусов, можно говорить о параллельном смещении.
Торсионный угол между [TYR]310 и [PHE]309 - 55 градусов, мы видим T-образную ориентацию.
4. Солевой мостик.
Солевой мостик — относительно слабая ионная связь между положительно и отрицательно заряженными боковыми цепями аминокислот белка.
Солевые мостики добавляют стабильности структуре белков[10]
. Солевые мостики возникают между положительно и отрицательно заряженными боковыми радикалами аминокислотных остатков,
поэтому, чтобы найти солевые мостики, нужно найти близко расположенные отрицательно заряженные аминокислотные остатки (Asp и Glu)
и положительно заряженные (Arg, Lys и His). Используем это при работе в Jmol
и находим подходящий контакт.
Апплет 3. Описание нк-белковых контактов
1.Взаимодействие РНК и LGP2
Белки, вступающие в контакт с нуклеиновыми кислотами, могут делать это посредством ряда механизмов: водородных
связей, гидрофобных взаимодействий и др. Так, белок, скользя по РНК или ДНК, может непрямым способом считыветь
генетическую информацию
и специфично связываться с определённой последовательностью или её частью для реализации функции
(например, ТАТА-связывающий белок).[11]
LGP2 взаимодействует с РНК посредством сближения гидрофобных ядер молекул. Первая визуализация первого скрипта
демонстрирует
расположение общего для РНК и белка гидрофобного ядра. При помощи сервиса
CluD были получены данные, используя которые
можно показать расположение гидрофобного ядра молекул. Видимо, ядра РНК и белка расположены настолько близко, что алгоритм
сервиса считает их единым объектом, несмотря на различное происхождение и строение. Это может свидетельствовать о
том, что именно
гидрофобное взаимодействие удерживает молекулы вместе.
2. Бороздки РНК и окружение
Скрипт демонстрирует молекулу двухцепочечной РНК с раскрасмой по большой и малой бороздке зелёным и синим соответственно.
С помощью выделения обозначены остатки аминокислот, расположенные не расстоянии меньшем, чем 5 ангстрем.
Видно, что заряженные группы аминокислотных остатков взаимодействуют, в основном, с Y цепью малой бороздки РНК.
В области сахаро-фосфатного остова заметно большее количество молекул воды. Авторам хотелось обратить на это особое внимание.
Продолжив
выполнение скрипта до конца, Вы можете убедиться, что вода частично скрывает гидрофобное ядро, взаимодействует с
сахаро-фосфатным
остовом и заряженными остатками белковой цепи, что, по- видимому, является остаточным после стабилизации взаимодействия
явлением. Гидрофобные ядра белка и РНК не везде привыкают плотно, что разрешает невытеснение молекул воды.
3. Информация о донорах и акцепторах на большой и малой бороздках
В данной визуализации отражено положение доноров и акцепторов протонов на большой и малой бороздках двойной
цепи РНК. На обеих бороздках доноры и акцепторы указаны зелёным и синим цветом соответственно.
4. Информация о водородных связях
РНК, как и белок, в основном, поддерживают свою вторичную структуру за счёт водородных связей. В четвёртой визуализации
выделены атомы, между которыми теоретически возможно образование водородных связей. Показана потенциальная возможность
образования связей между девятью точечными участками белковой цепи
и сахаро-фосфатным остовом РНК.Критерием выделения является
близость пространственного расположения,
что не вполне верно. Однако даже этот избыточный выбор не свидетельствует в пользу наличия связей.
Апплет 4. Описание лиганд-биомолекулярных контактов
Описание лиганд-биомолекулярных контактов
В данном белке присутствуют несколько видов лигандов.
Ион цинка в данном белке соединяет два участка одной цепи через образование мотива цинкового пальца.
В рассматриваемом случае цинк связан с четырьмя остатками цистеина. Цинковый палец – это пример мотива,
позволяющего белкам связывать ДНК и РНК и работать с этими биополимерами. Его ассоциация с тиольными группами
цистеина может, в том числе, менять активность белка в зависимости от редокс-потенциала клетки и конццентрации
оксида азота(II). [12]
Ион алюминия встречается в этом белке в типичном для этого элемента виде гексакомплекса. Он образует четыре координационных
связи с фторид-анионами, одну с кислородом фосфатной группы АДФ, и одну с кислородом воды.
Рядом с ионом алюминия расположен ион магния. В его координационной сфере три атома кислорода молекул воды, два фторид-аниона
и один кислород фосфатной группы АДФ. Вообще, магний часто ассоциирован с ДНК и РНК, помогает стабилизированию их структуры,
участвует в переносе фосфатных групп и гидролизе фосфодиэфирных связей. Похоже, что в рассматриваемом белке его функция связана
с фосфорилированием других белков, входящих в систему врожденного противовирусного иммунитета курицы.
[13]
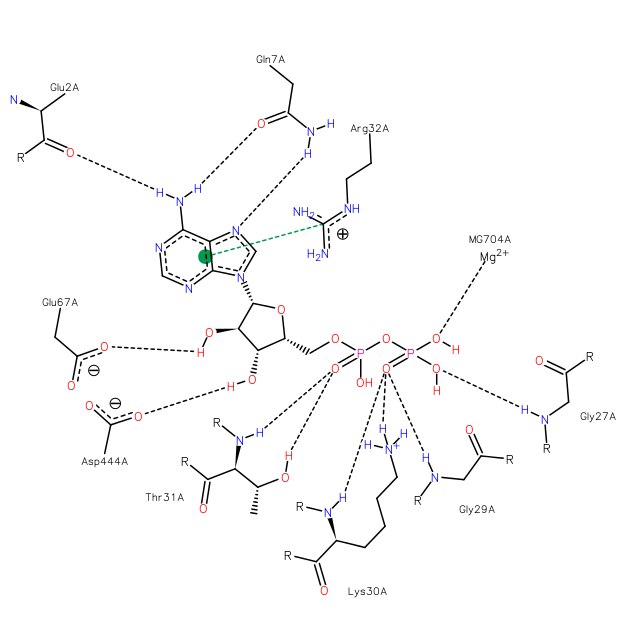
Аденозиндифосфат – одна из форм самой распространенной энергетической валюты в клетке. Её присутствие в данном белке
говорит о том, что анализ структуры белка произвели в момент после гидролиза АТФ. Гидролиз АТФ сопровождается высвобождением
энергии, которая может использоваться для работы различных молекулярных машин. Но у АДФ остается высокоэнергетическая связь,
которая тоже может гидролизоваться для выделения энергии. Взаимодействия различных аминокислот с АДФ показаны на этом изображении.
Рисунок 3. Взаимодействия различных аминокислот с АДФ
Этиленгликоль – простейший из многоатомных спиртов. В этом белке все три молекулы этиленгликоля расположены у поверхности.
Возможно, они помогают повысить растворимость белка.
Второй входящий в состав белка ион магния находится рядом с РНК. Он образует тетраэдрический комплекс с тремя анионами фтора
и кислородом молекулы воды. Судя по всему, он стабилизирует взаимодействие белка и РНК.
Таблица 2. Информация о лигандах
| Название по IUPAC | Химическая формула | PubChem ID | Молярная масса (g/mol) | Брутто-формула (Наведите курсор на картинку) | Код лиганда |
| [(2R,3S,4R,5R)-5-(6-aminopurin-9-yl)-3,4-dihydroxyoxolan-2-yl]methyl phosphono hydrogen phosphate | C10 H15 N5 O10 P2 |
6022
| 427,2 | |
ADP |
| tetrafluoroalumanuide | AlF4- |
5311325 | 102,97
| |
ALF |
| magnesium;trifluoride | F3Mg- |
447728 | 81,3 |
|
MGF |
| zinc(2+) | Zn+2 |
32051 | 65.38 |
|
ZN |
| ethane-1,2-diol | C2 H6 O2 |
174 | 65,41 |
|
EDO |
| magnesium(2+) | Mg2+ |
888 | 24,3 |
|
MG |
Для выполнения данного практикума были использованы следующие материалы и методы:
1.Язык HTML
2.База данных NNCBI
3.База данных UniProt
4.База данных PDB
5.Сервис BLAST и expasy.org
6.JMOL- программа для визуализации данных о биологических объектов
Для выполнения скриптов были использованы следующие команды:
<"
pause
select all
wireframe off
cpk off
spacefill on
cartoons off
colour cpk
echo 4 The Van-der-Waals representation of the protein colored by chemical elements
pause
select RNA
color orange
select rna and not :X and not :Y
color green
echo 5 The Van-der-Waals representation of the protein with colored RNA
pause
select protein
spacefill off
ribbons 20
select rna
color chain
delete water
select ligands
label %e
set fontsize 13
echo 6 The spacefill representation of the RNA colored by chains with ligands
pause
set echo top center
font echo 16 serif timesnewroman
colour echo black
script dna.def
restrict :X or :Y AND NOT LIGAND
select :X or :Y AND NOT LIGAND
center selected
spacefill on
colour cpk
select mjg
colour green
select mig
colour blue
echo 1. RNA colored by grooves (minor blue and major green)
pause
select none
select protein
backbone on
wireframe off
select within(5.0, :X or :Y) and not (:X or :Y)
wireframe 100
colour orange
echo 2. RNA colored by grooves with wireframe protein within 5.0 A
delete water
select :X or :Y AND NOT LIGAND
restrict :X or :Y AND NOT LIGAND
center selected
wireframe 150
cpk 200
colour cpk
select hamjg
colour coral red
select hdmjg
colour blue
select mjg and not hamjg and not hdmjg
colour grey
echo 1. The major groove colored by green donor and blue acceptor atoms
pause
select :X or :Y AND NOT LIGAND
restrict :X or :Y AND NOT LIGAND
center selected
spacefill 150
cpk 200
colour cpk
select hamig
colour coral red
select hdmig
colour blue
select mig and not hamig and not hdmig
colour grey
echo 2. The minor groove colored by green donor and blue acceptor atoms
pause
delete water
select all
cartoon off
cpk off
wireframe off
define ok within(3.5, (:X or :Y and not ligand )) and not (:X or :Y)
define okd within(3.5, protein) and (:X or :Y and not ligand)
select ok or okd
hbonds calculate
hbonds 50
select :X or :Y and not ligand
cpk on
color [92, 87, 255]
select okd
colour orange
select protein
backbone 60
colour grey
select ok
colour red
echo 1. Hypothetical protein-RNA hbonds
pause ">
7.Clud- сервис для поиска гидрофобных ядер молекул
8.Ресурсы сети Интернет
Личный вклад
Авторы отказываются от взаимных претензий.
Атлас составили Бусыгин Сергей, Кравченко Павел, Миронова Екатерина.
Миронова Екатерина работала над разделом белок-белковых контактов и таблицей процентного распределения аминокислот в белке.
Кравченко Павел работал над разделом нк-белковх взаимодействий, таблицей лигандов и написанием отчёта.
Бусыгин Сергей работал над разделом лиганд-биомолекулярных контактов.
Ссылки на источники
- LGP2 in Wikipedia
- MDA5 in Wikipedia
- RIG-I in Wikipedia
- Программный обзор особенностей LGP2
-
Антивирусная функция и молекулярная структура рецептора LGP2 на примере Branchiostoma japonicum
- Структурный анализ РНК-связывающего комнлекса LGP2 и MDA5
- Обзор молекулярного переключателя
- Ленинджер А. Л44 Основы биохимии: В 3-х т. Т. 1. Пер. с англ.-М.: Мир, 1985
- Stacking in Wikipedia
- Oxford dictionary of biochemistry and molecular biology, 2006
- TATA in Wikipedia
- The 4-cysteine zinc-finger motif
- Magnesium in Health and Disease
- NCBI обзор LGP2
- Роль LGP2 в развитии иммунного ответа на примере клеток Ctenopharyngodon idella
- Adenosine triphosphate
- Учеб. для вузов, Под ред. Е.С. Северина., 2003. 779 с. ISBN 5-9231-0254-4

©
Бусыгин Сергей,
Кравченко Павел,
Миронова Екатерина
2017



