Информация о белке
Для выполнения работы был выбран белок рибонуклеотид редуктаза.
Общая информация:
- PDB ID: 3R1R
- Белок для кристаллизации был выделен из Escherichia coli.
- Разрешение 2.5 ангстрема.
- Катализирует реакцию "2'-deoxyribonucleoside diphosphate + thioredoxin disulfide + H(2)O = ribonucleoside diphosphate + thioredoxin"
Кристаллографические характеристики белка из записи PDB:
CRYST1 224.610 224.610 336.630 90.00 90.00 120.00 H 3 2 72
- Первые три числа обозначают длины направляющих векторов ячейки: 224.610 224.610 336.630
- Вторые три числа обозначают углы между направляющими векторами:90.00 90.00 120.00
- Следующая буква и два числа обозначают кристаллогрфическую группу - H 3 2 72.
- Последнее число обозначает число молекул в ячейке: 72.
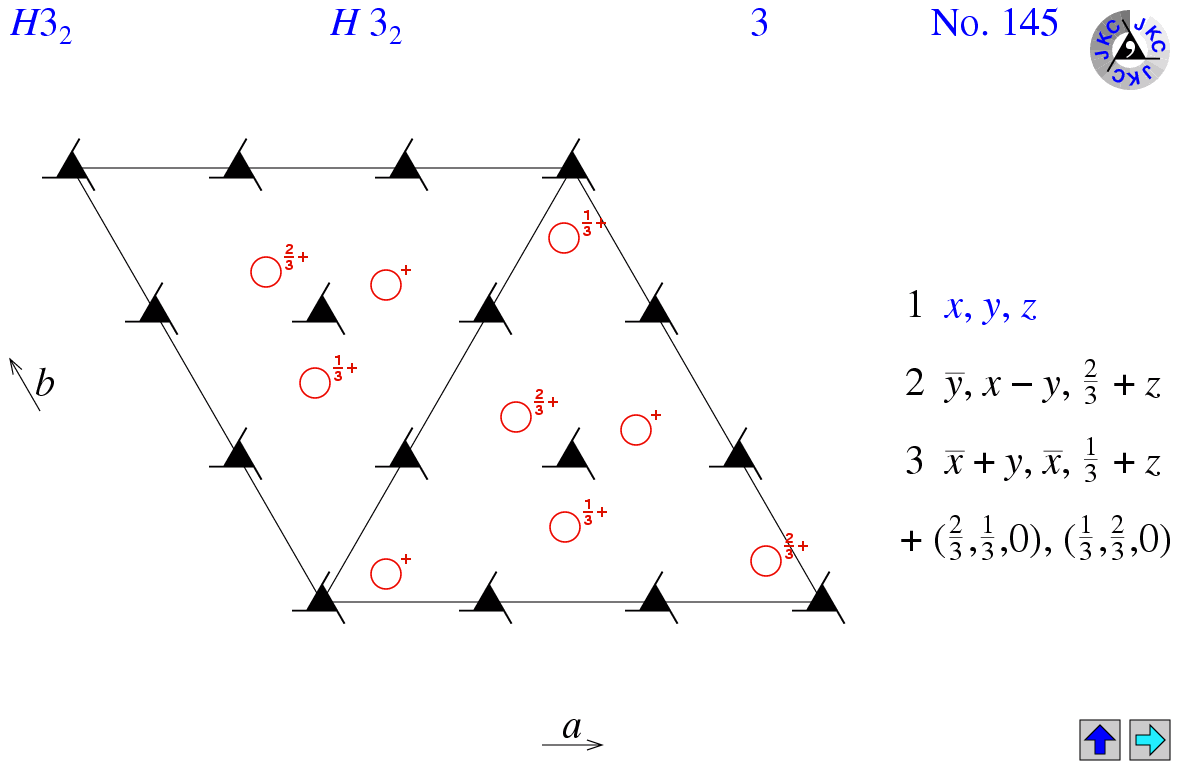 |
Рисунок 0. Информация о группе симметрии кристалла. Ацентрическая хиральная группа [5].
|
Структура белка была визуализирована с помощью программы PyMol.
Его изображение показано на рисунке 1. Белок состоит из 3х цепей, две из которых соединены тонкой перемычкой.
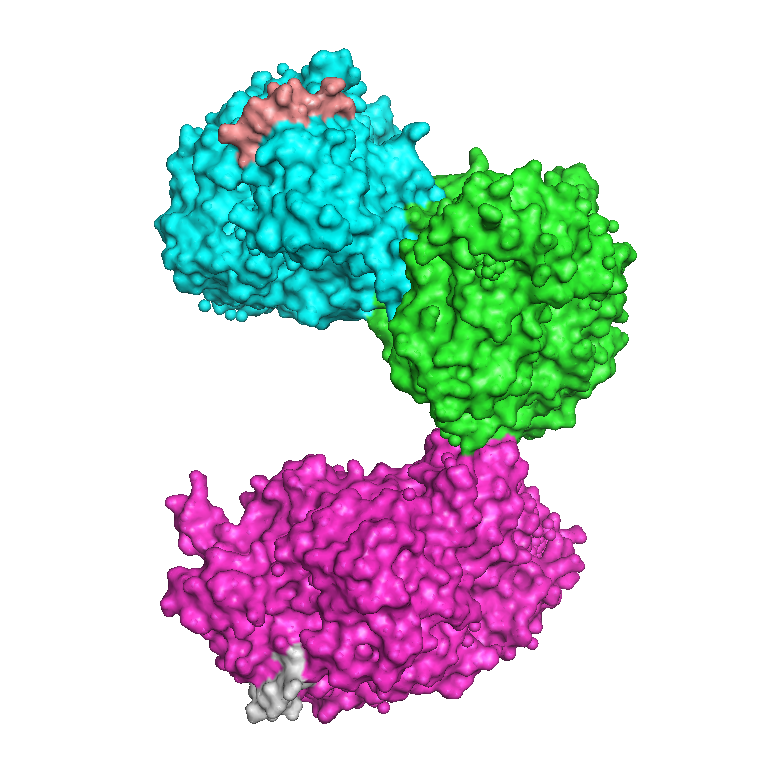 |
Рисунок 1. Изображение белка.
|
Взаимодействия белка с субъединицами из соседних ячеек
Положение белка в кристалле относительно элементарной ячейки показано на рисунке 2. Видно, что молекула находится на краю элементарной ячейки.
 |
Рисунок 2. Изображение белка внутри элементарной ячейки. Здесь и далее цепь А покрашена зеленым, В-бирюзовым, С-малиновым.
|
Было интересно посмотреть, как соседние белки расположены в кристалле при таком типе симметрии.
С помощью команды "symexp sym" в PyMol была воссоздана структура кристалла на расстоянии 5 А от белка. Она поэтапно рассматривается на рисунках 3 - 5.
 |
 |
 |
Рисунок 3. Изображение 2-х соседних белков с разных ракурсов. Исходный белок покрашен оранжевым. Видно, что бирюзовые цепи В соединяются по трое.
|
 |
 |
Рисунок 4. Изображение множественных контактов с разных ракурсов. Исходный белок покрашен оранжевым. Видно, что малиновые (С) цепи
соединяются по пять. Получается чередование: "пятимеры" чередуются с "тримерами" в одном слое.
|
Если посмотреть на образовавшуюся структуру сверху (рис. 4 нижняя панель), то видно, что субъединицы разных белков объединяются, формируя своеобразные упорядоченные ячейки.
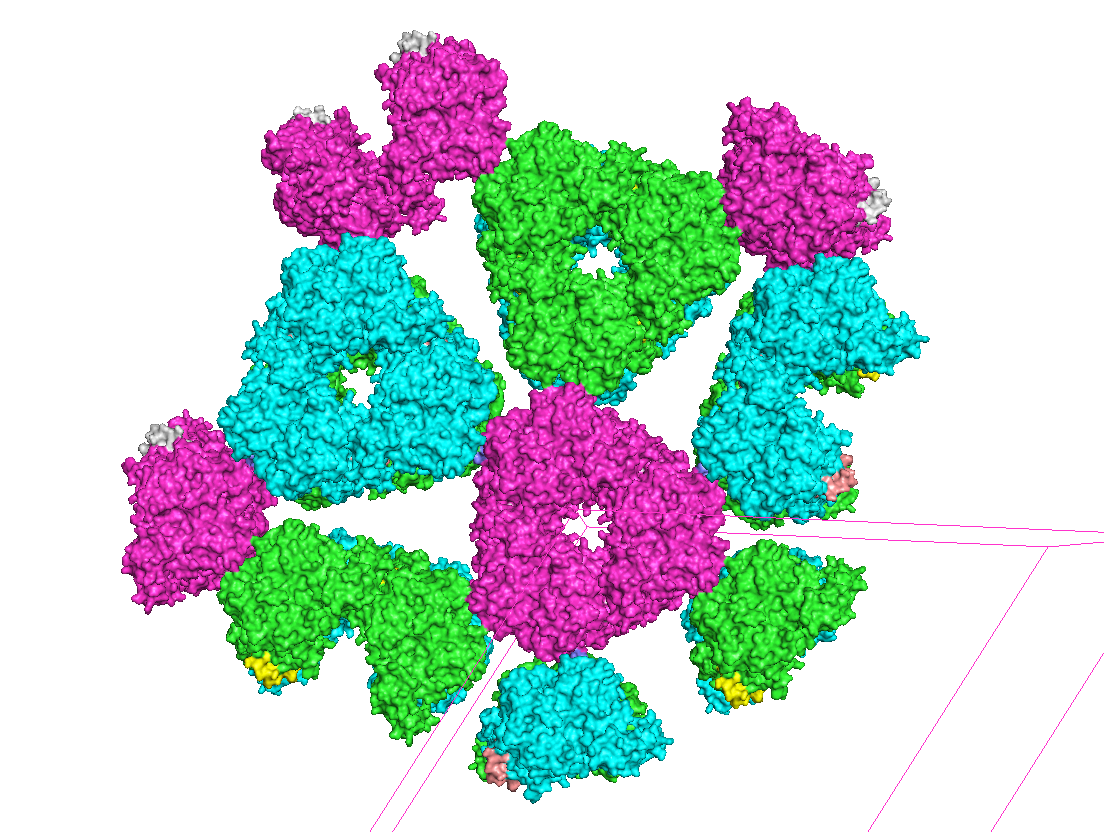 |
Рисунок 5. "Вид сверху".
|
интересно воссоздать большую область структуры кристалла. На рисунках 6 и 7 показаны белки, находящиеся на расстоянии 10 А от исходного.
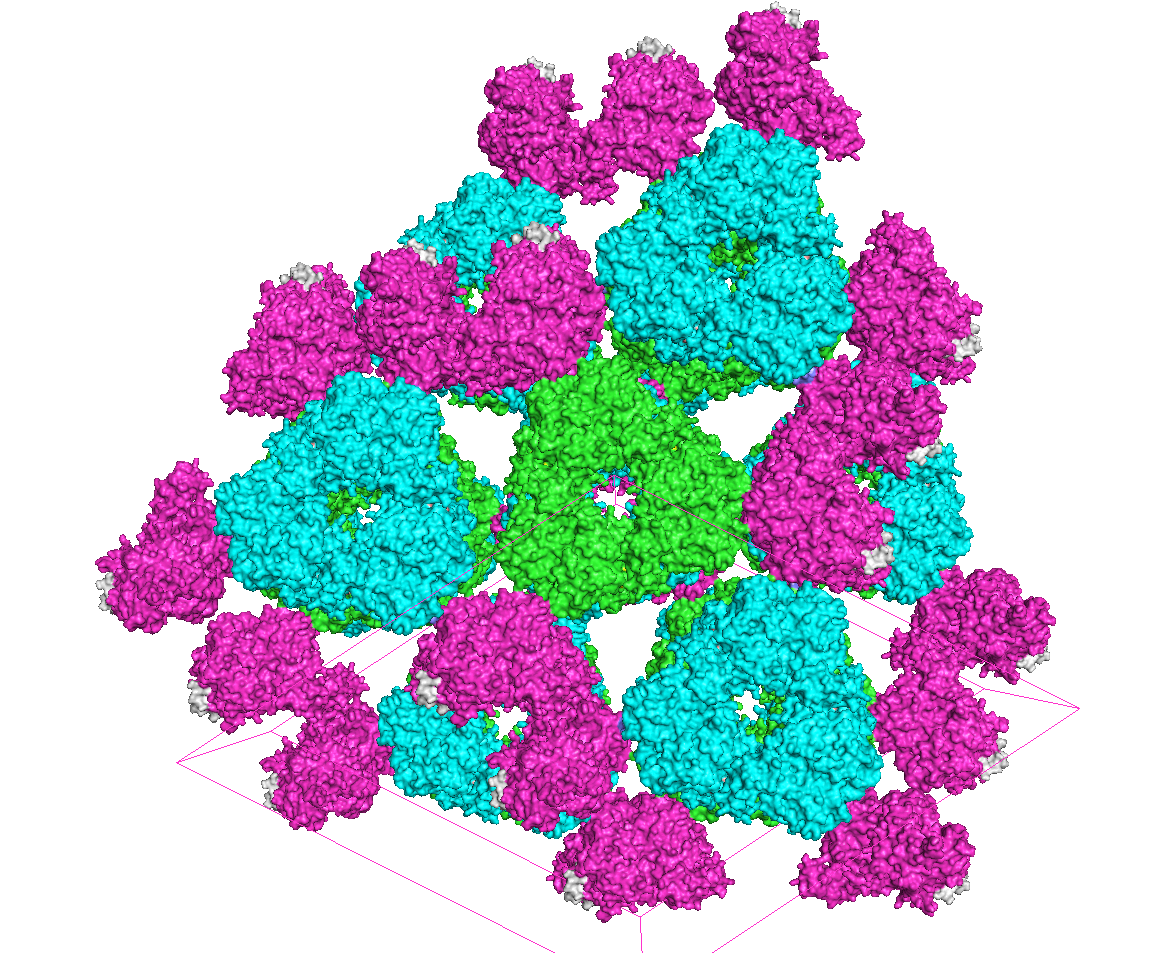 |
Рисунок 6.1 "Вид сверху".
|
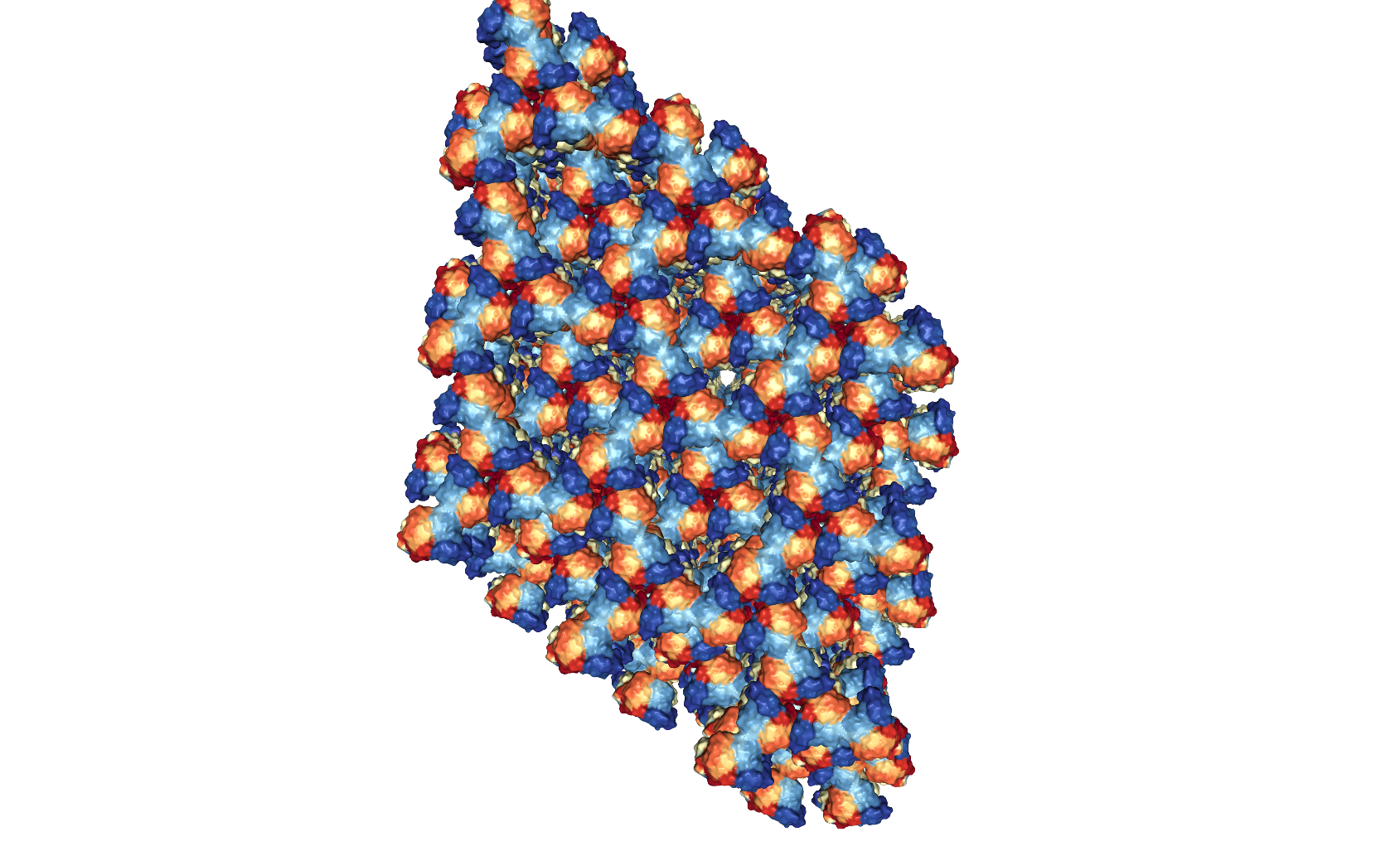 |
Рисунок 6.2 "Вид сверху". Визуализация поверхностей. [1]
|
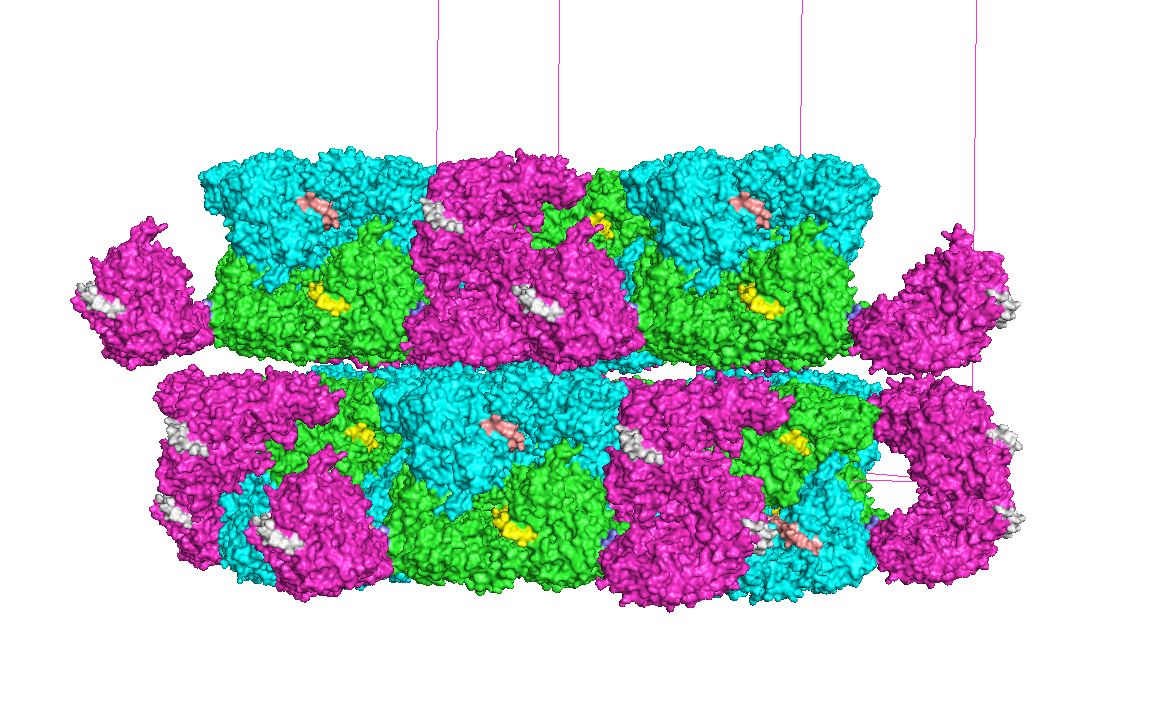 |
Рисунок 7. "Вид сбоку".
|
Видно, что белки образуют регулярные слои, расположенные друг относительно друга, вероятно, по следующему правилу: Цепь А всегда контактирует с цепью А,
цепь С с цепью В.
Взаимодействие белков в кристалле. Водородные связи
Думаю, логично будет попробовать найти гидрофобные контакты, водородные связи и полярные взаимодействия между соседними белками.
Гидрофобные контакты
Для визуализации гидрофобных контактов средствами Pymol была построена поверхность белка с визуализацией гидрофобных остатков.
 |
Рисунок 8. Изображение гидрофобной поверхности "мономера". Видно, что в некоторых местах наблюдается выход
гидрофобных остатков на поверхность белка.
|
 |
 |
Рисунок 9. Изображение вероятных гидрофобных контактов между белками одного слоя.
|
Была сделана попытка найти гидрофобные области, расположенные между белками одного слоя, но она потерпела неудачу. Исходя из результатов визуализации, на мой взгляд,
нельзя выделить какую-либо область, способную поддержать такого рода взаимодействие. При ближайшем рассмотрении оказывается, что ни на одном, ни на другом белке в месте контакта
не обнаруживается обширных гидрофобных областей.
Скорее всего, в клетке белки контактируют по-другому. Пример взаимодействия показан в
статье про рассматриваемый белок как белок месяца в PDB [6]. Там белки при замыкании в кольцо контактируют торцами, а не боковинами.
Значит, следует попытаться искать контакты между слоями.
 |
 |
Рисунок 10. Изображение вероятных гидрофобных контактов между белками разных слоев. Сверху между цепью С и В. Снизу - между А и А.
|
 |
 |
Рисунок 11. Изображение торцевых поверхностей вероятных гидрофобных контактов между белками разных слоев.
Сверху со стороны цепи С. Снизу - цепи А.
|
Между слоями гидрофобные контакты, на мой взгляд, видны лучше.
Полярные контакты и водородные связи
Для визуализации полярных контактов был выбран контакт между белками разных слоев. Было интересно, какую роль играют водородные
связи и полярные взаимодействия в удержании белковых слоев.
 |
Рисунок 12. Визуализация полярного контакта
|
 |
Рисунок 13. Визуализация водородных связей. Измеренные расстояния позволяют
предположить наличие водородных связей между остатками
C/HIS`23 и /B/ASP`27, /B/HIS`34 и /C/ASP`20. В обоих случаях, в зависимости от положения боковых цепей
аспарагиновой кислоты, возможно образование водородных связей с разными атомами кислорода. Образование сразу
четырех связей мне кажется также возможным.
|
Между двумя белками было найдено три потенциальных водородных связи, но этого недостаточно для удержания слоев белка в кристалле.
Видимо, эту функцию выполняют именно торцевые гидрофобные контакты.
Cтранное расположение белковых цепей в структуре ДНК-белкового комплекса 3HDD
Задание состояло в внимательном изучении ДНК-белкового комплекса 3HDD.
Данный белок был получен из организма Drosophila melanogaster.
Структура белка была визуализирована с помощью программы PyMol.
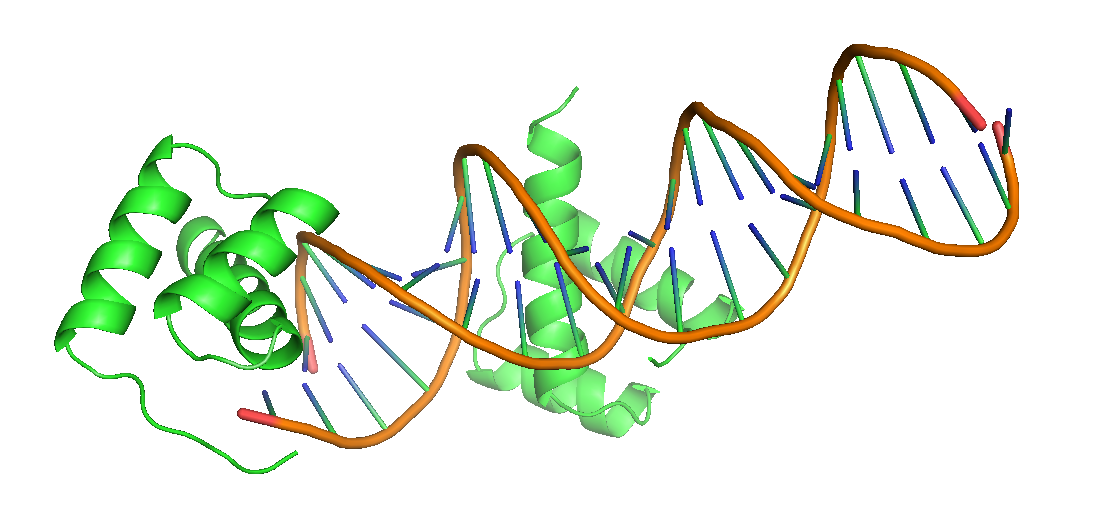 |
Рисунок 14. Изображение комплекса белок-ДНК.
|
Она состоит из фрагмента
двуцепочечной ДНК и двух белков. Также можно заметить, что одна из
альфа-спиралей левого белка находится с краю структуры и как-будто взаимодействует с концом ДНК, что очень настораживает.
Чтобы лучше понять природу этого взаимодействия была восстановлена структура соседних элементов элементарной ячейки кристалла.
Из рисунков 15 и 16 видно, что наблюдается двойственное взаимодействие: пептидная цепь взаимодействует не только со своим участком ДНК, но и с фрагментом
ДНК из соседней ячейки, а также образует протяженные тяжи из альфа-спиралей, скрепляющих участки ДНК между собой.
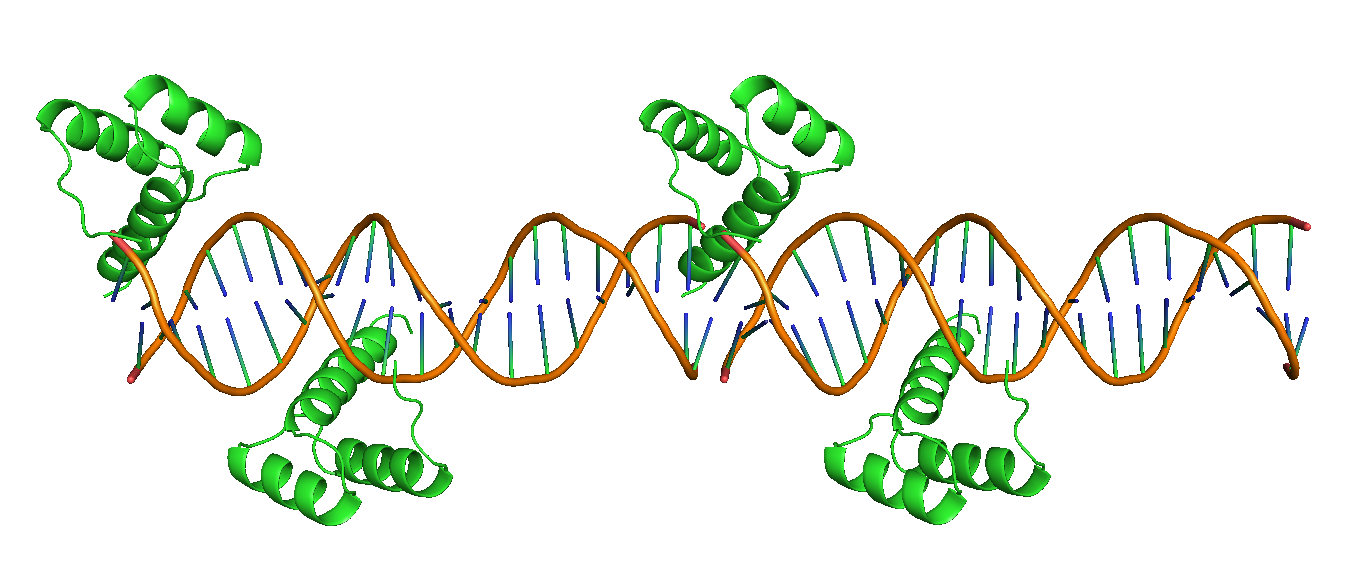 |
Рисунок 15. Изображение восстановленной соседней структуры.
|
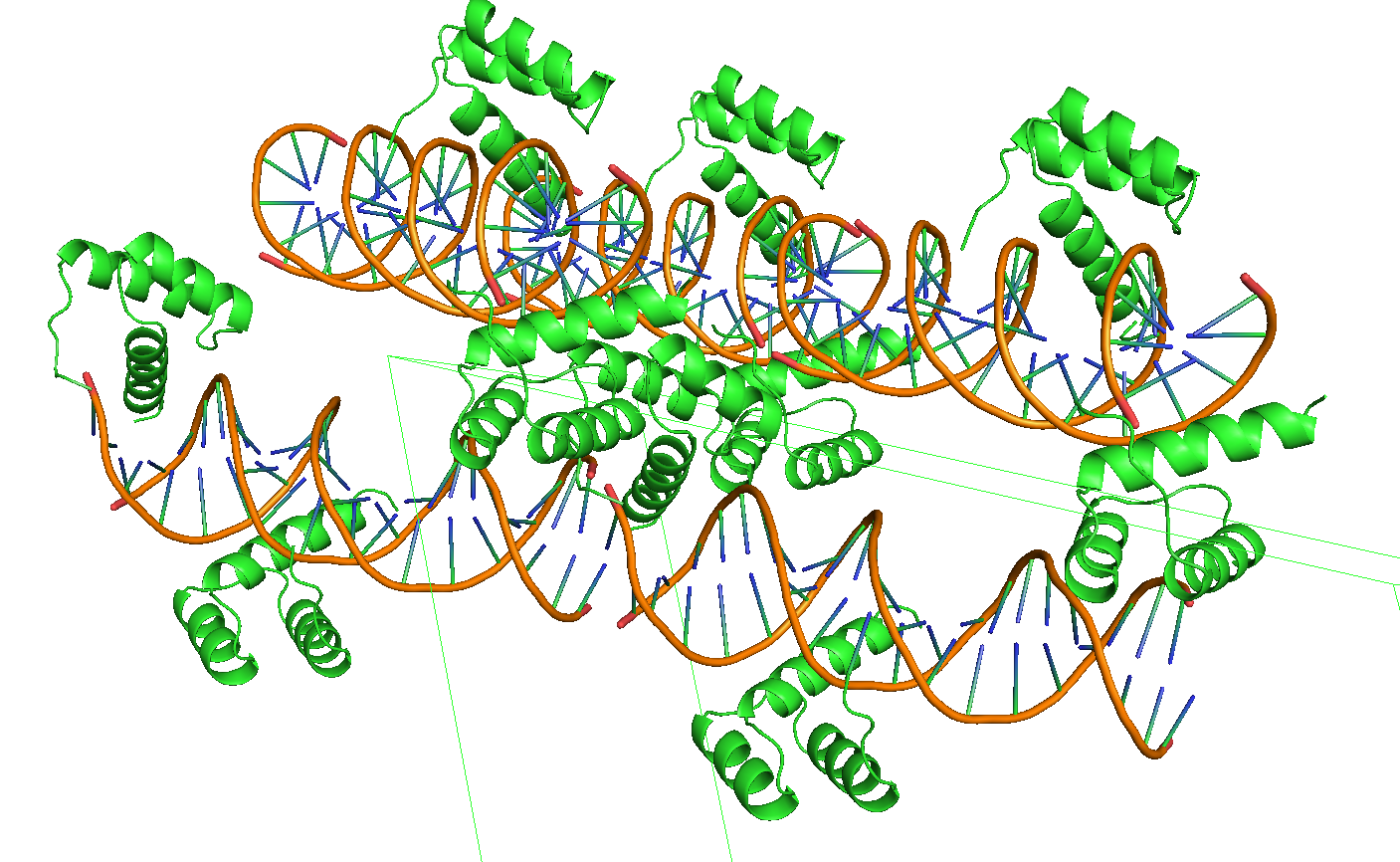 |
Рисунок 16. Изображение нескольких соседних структур на расстоянии 4А и внутри элементарной ячейки.
|
Возможно, белок in vivo существует в виде изображенного димера.
Возможно, данная странность является артефактом кристаллизации и не имеет биологического обоснования.
Выводы
Исходя из описанного в первом и втором практикумах, для грамотной работы с результатами рентгено-структурного
анализа всегда следует проверять качество полученной в эксперименте электронной плотности, анализировать совокупность структур в
восстановленной элементарной ячейке, а также обращать внимание на артефакты кристаллизации. Нужно хорошо представлять, какие конформации могут быть приняты белком, а какие
могут получиться в результате взаимодействия белка с соседями или с лигандами и ионами.
Ссылки
- PDB: 3R1R
- RCSB: 3R1R
- RCSB: 3hdd
- Space groups
- Space group H32
- Ring structure of 3R1R
























