Сравнние водородных связей в структурах белка, расшифрованных с помощью РСА и ЯМР
В данной работе нам предлагалось выбрать белок,
структура которого была расшифрована методами РСА и ЯМР.
Был выбран Phl p 2 - аллерген из растительной пыльцы. Это маленький белок, который имеет только несколько бета-листов.
ЯМР
Данный белок имеет расшифрованную с помощью ЯМР структуру (PDB ID: 1BMW).
Число моделей: 38;
Год релиза 1999.
РСА
Данный белок также имеет расшифрованную с помощью РСА структуру (PDB ID: 1WHO).
Разрешение: 1.9 ангстрем;
Год релиза 1997.
Сравнение структур
В целом, структуры, показанные на рисунке 1, выглядят похоже.
После выравнивания в Pymol [cealign 1who, 1bmw] становится заметно различие структур в свободных концевых областях и в относительно крупном неструктурированном участке.
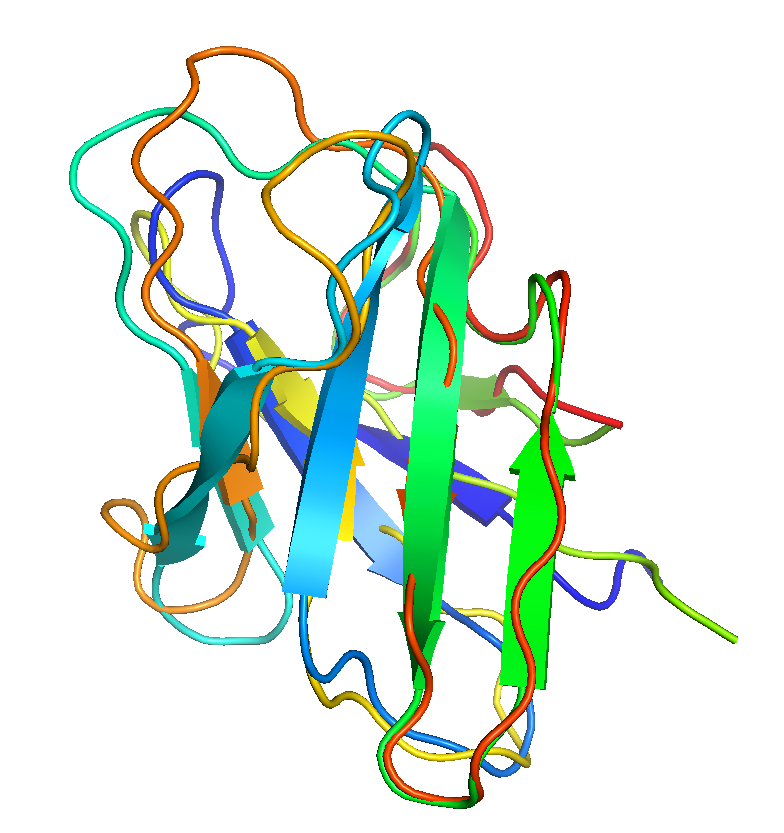 |
Были выбраны 3 различные водородные связи:
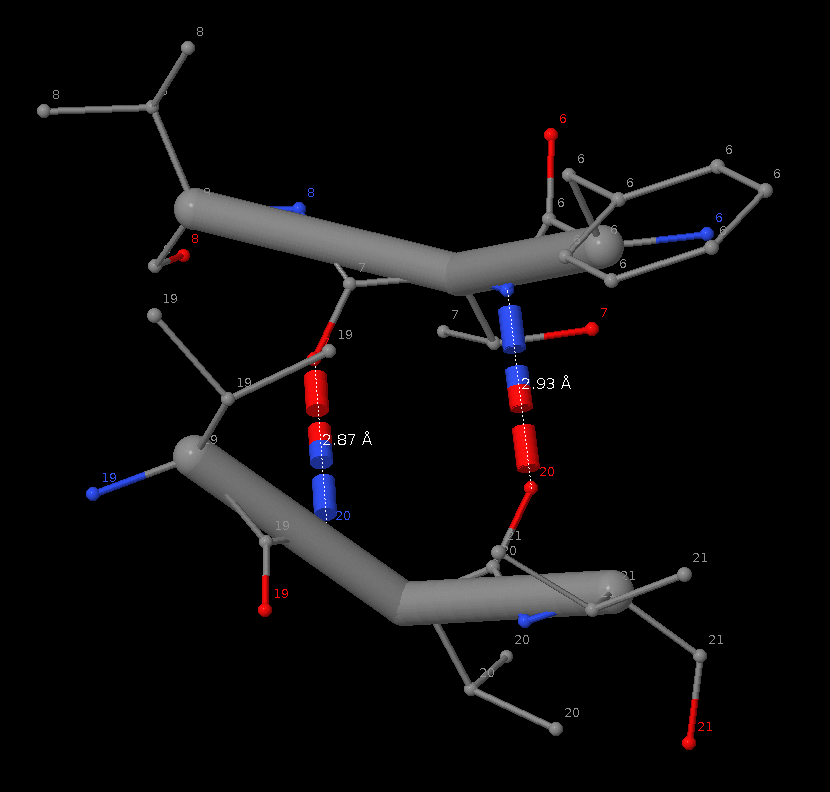
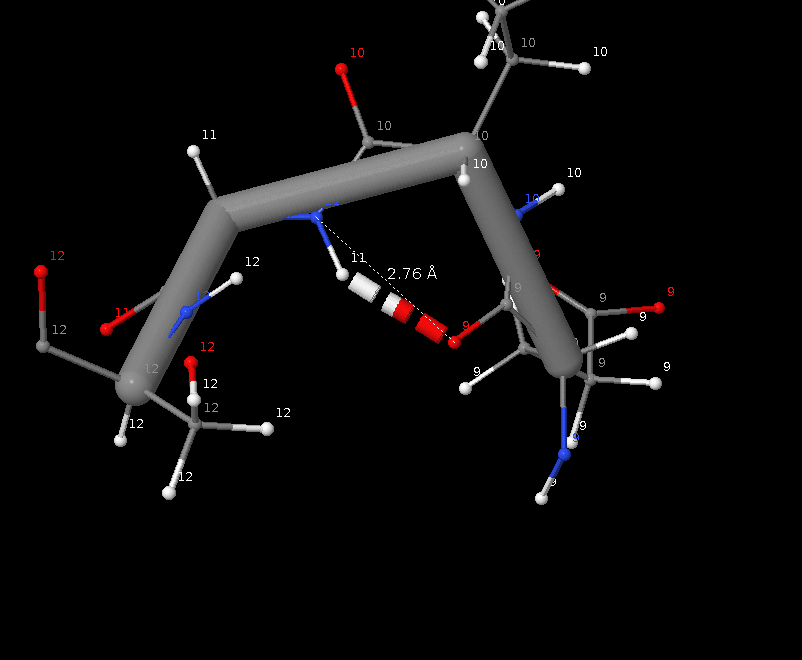
Остовная связь в ядре белка, в бета-листе (выбрана связь THR`7- LEU`20)
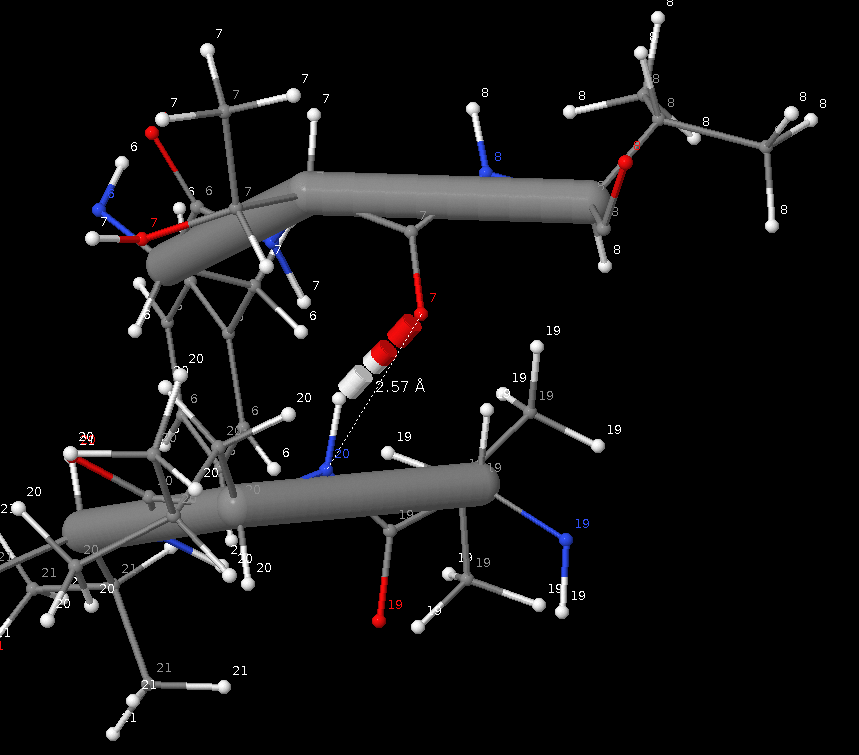
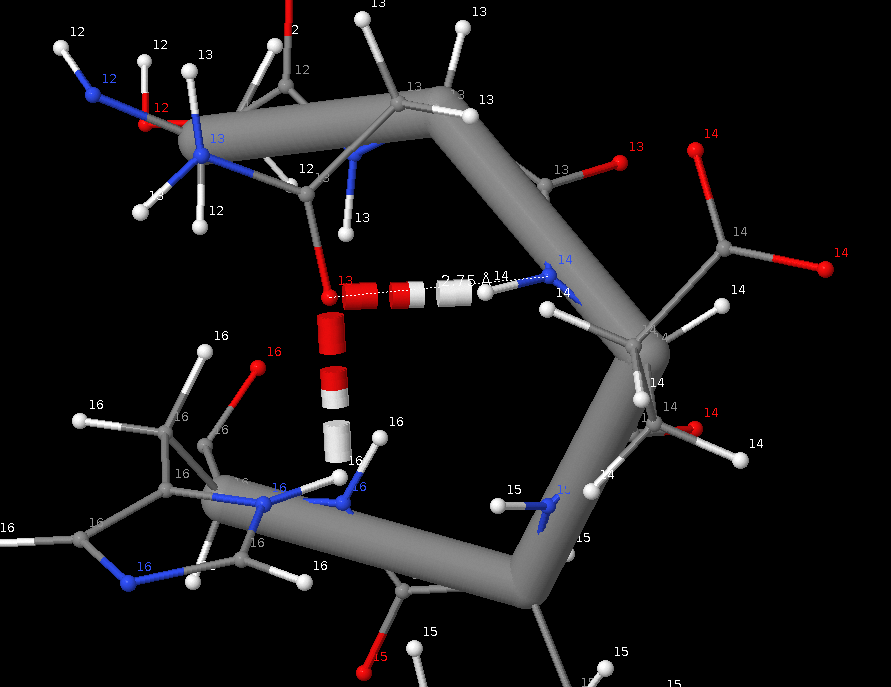
Связь боковых цепей в ядре белка (так как связей между боковми цепями в структуре РСА не было, а в структуре ЯМР таких связей не было в ядре, я взял водородную связь между
GLU`14 - ASN`13 из модели 1 ЯМР)
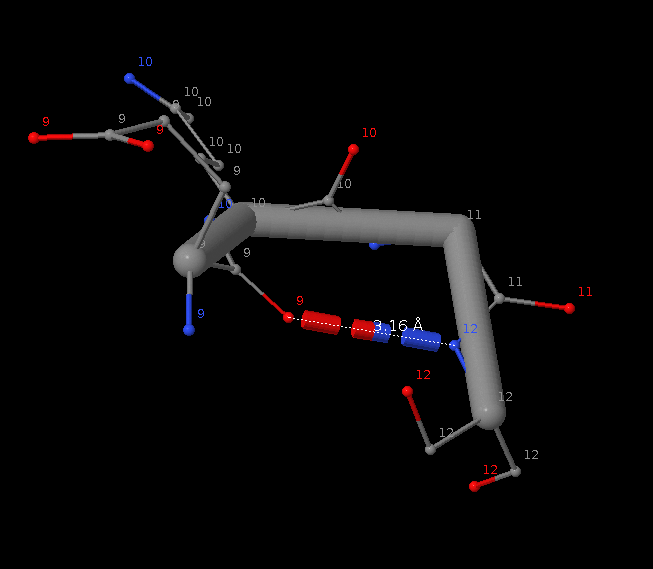
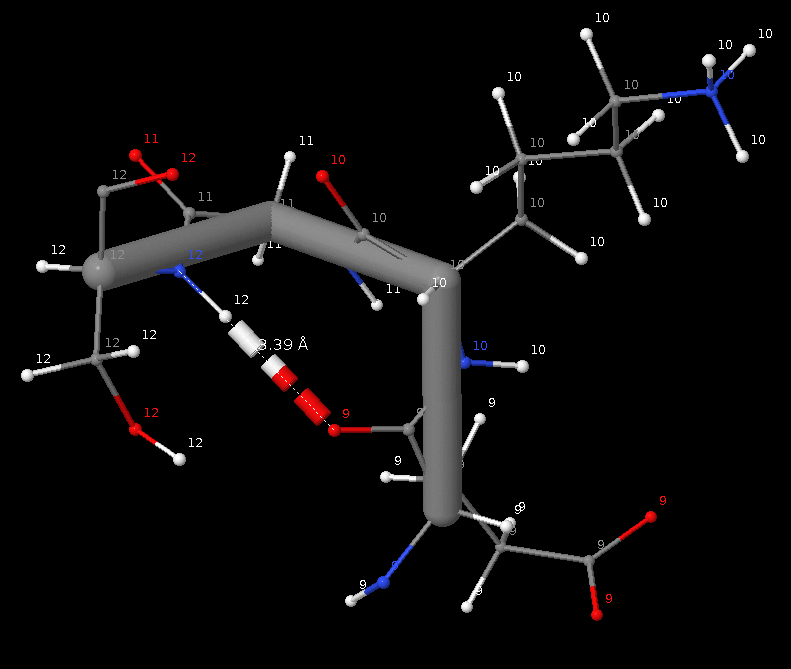
Связь в петлях, выходящих на поверхность глобулы (была выбрана связь SER`12 - GLU`9, как мне кажется, обеспечивающая стабилизацию поворота)
 |
 |
 |
 |
 |
 |
В таблице 1 представлены характеристики указанных взаимодействий. Расстояния везде измерялись между донором и акцептором водородной связи.
| Водородная связь (донор-акцептор) | Место расположения связи | РСА - длина связи (Å) | ЯМР - длина связи (Å) min | ЯМР - длина связи (Å) med | ЯМР - длина связи (Å) max | ЯМР - "поддержка" (%) | Ссылка на рисунок |
| LEU`20 - THR`7 | в бета-листе | 2.87 | 2.53 | 2.55 | 3.22 | 0.75 | 2.1, 2.2 |
| SER`12 - GLU`9 | петли, выходящие на поверхность глобулы | 3.16 | 2.94 | 3.03 | 3.39 | 0.2 | 3.1, 3.2 |
| GLY`11 - GLU`9 | петли, выходящие на поверхность глобулы | - | 2.58 | 2.83 | 2.97 | 0.2 | 3.3 |
| GLU`14 - ASN`13 | cвязь боковых цепей | - | 2.53 | 2.74 | 2.93 | 0.25 | 4 |
Все результаты измерений для воспроизводимости результатов содержатся в таблице. В расчет брались 20 первых моделей ЯМР.
Общий вывод
Из анализа полученных данных можно заключить, что наилучшее совпадение между структурами, полученными методами РСА и ЯМР, достигается в бета-листе.
Измеренный максимум поддержки водородной связи в структуре ЯМР вне бета-листа - 25%. При этом данная связь не наблюдалась в структуре РСА.
В целом, структуры по остовным водородным связям совпадают, а по связям вне бета-листов совпадают плохо.
Думаю, что объект для сравнения был выбран не совсем удачно. Лучше было бы выбрать более крупный белок, в котором можно было бы лучше сравнить водородные связи
между боковыми цепями в ядре белка.
Значения длин водородных связей в моделях ЯМР, в среднем, меньше, чем в моделях РСА, что может быть связано с большей нативностью
полученных моделей по сравнению с кристаллизованной белковой молекулой. Также в ЯМР количество водородных связей между моделями и по сравнению с РСА структурой
разнится по причине подвижности
белковых петель.
