Мембранные белки
Задание 1.
Для работы мне был выдан белок протон-ксилозный симпортер (XYLE_ECOLI, 4GBY), для которой я должен был создать репрезентативную
сборку гомологов. Для этого на сайте EBML EBI я задал поиск гомологов по
fasta-последовательности белка в базе данных UniProt Clusters на уровне идентичности 50%, задав количество находок в 200 штук.
Выданные результаты были выровнены по алгоритму Muscle (выравнивание результатов). Также было
получено выравнивание найденных последовательностей с выданным мне белком (алгоритм Muscle).
Проект JalView, содержащий полученные выше выравнивания.
При анализе полученных выравниваний было замечено, что некоторые последовательности очень сильно отличаются по длине от
остальных (при средней длине последовательности 450-500 аминокислотных остатков присутствовали последовательности, содержащие по
~1000). Таких последовательностей было две: UniRef50_B9GBB2 и UniRef50_K2T0R6. Также встречались короткие последовательности, в
которых отсутствовало большое количество вертикальных блоков выравнивания, характерных для остальных последовательностей.
| Последовательность |
Длина |
| UniRef50_W4Q3F1 |
222 |
| UniRef50_J9GN93 |
294 |
| UniRef50_A0A0S8EQS0 |
322 |
| UniRef50_X1E8A4 |
325 |
| UniRef50_G9YDE6 |
243 |
| UniRef50_A0A090NC03 |
285 |
| UniRef50_A0A170V4Q1 |
167 |
| UniRef50_I6F0W1 |
116 |
Используя в качестве репрезентативной последовательности данную мне преподавателем (она содержится в БД SwissProt и обладает
высоким аннотативным индексом - 5 из 5), можно решить, удалять или нет данные короткие последовательности. Так как они слишком
коротки, то все эти последовательности были из нового выравнивания удалены.
В белке имеется 12 трансмембранных альфа-спиралей.
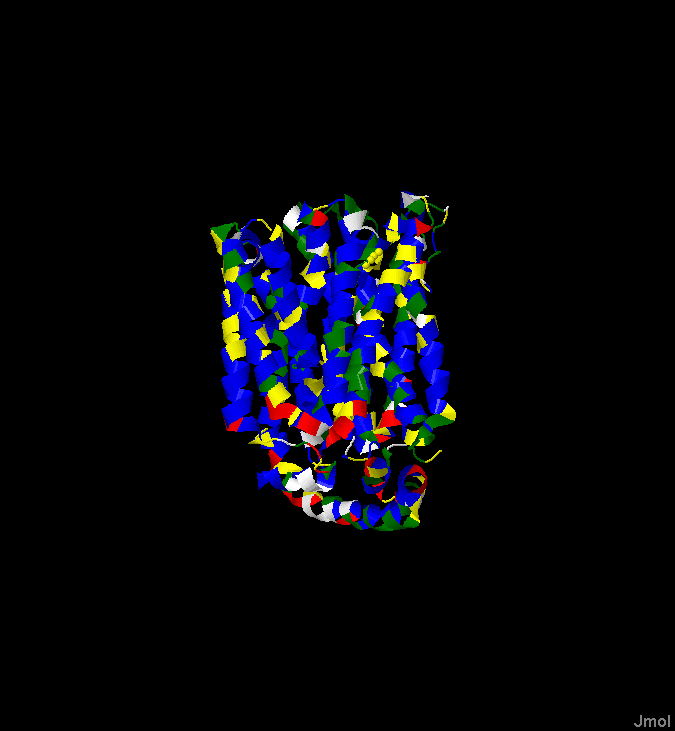
Рис. 1. Пространственная структура белка 4GBY. Синим отмечены гидрофобные аминокислоты (Ala, Trp, Phe, Val, Leu, Ile, Met), красным -
основные (Lys, Arg), зелёным - полярные (Ser, Thr, Asn, Gln), белым - кислотные (Asp, Glu), жёлтым - аминокислотные остатки,
о полярности которых нельзя судить однозначно (Tyr, Cys, Pro, Gly).
На рисунке видно, что трансмембранные альфа-спирали содержат много гидрофобных аминокислотных остатков, несколько меньшее
количество остатков с непонятной полярностью и совсем мало полярных и заряженных. Ориентируясь на покрашенное таким образом трёхмерное
изображение белка, можно найти участки белка, соответствующие трансмембранным альфа-спиралям. Однако можно поступить проще:
на странице сайта PDB, посвящённой моему белку, указаны
трансмембранные, цитозольные и периплазматические участки данного белка (обозначил трансмембранные альфа-спирали буквой "М" в
строке аннотации "TM_REAL" в проекте JalView).
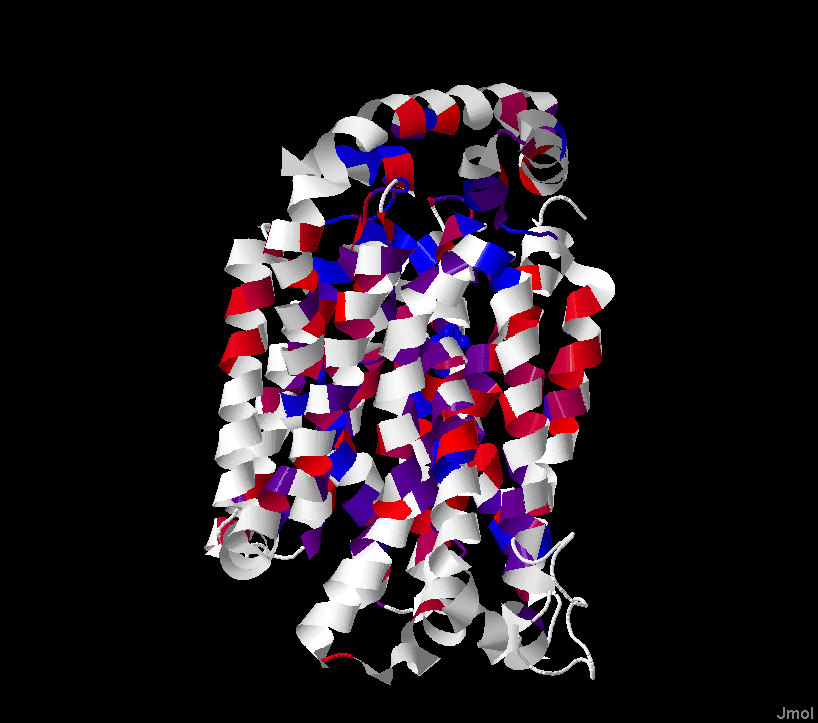
Рис. 2. Пространственная структура белка 4GBY, окраска по гидрофобности (JalView Hydrophobicity). Порог идентичности 30%.
Для предсказания трансмембранных участков я взял белок-гомолог GLF_ZYMMO. Найдя его последовательность и загрузив её на
вход программе TMHMM, получил предсказание. Предсказанные трансмембранные
участки отметил в строке аннотации "TM_PREDICTED" в проекте JalView).
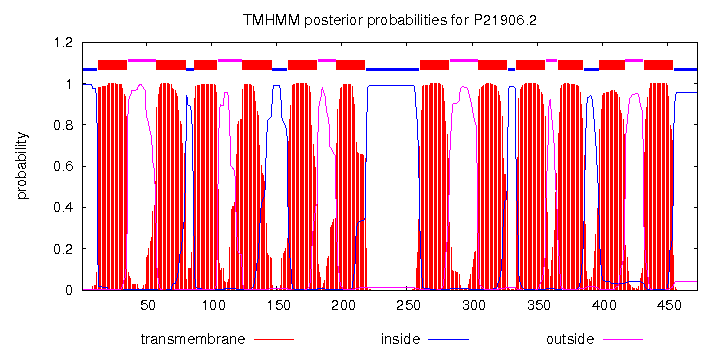
Рис. 3. Предсказание трансмембранных участков белка GLF_ZYMMO программмой ТМНММ.
В итоге, можно сказать, что в выравнивании трансмембранные участки "моего" белка часто пересекаются с предсказанными, при этом
они входят в состав одних и тех же консервативных блоков. Чаще всего в таких участках встречаются гидрофобные аминокислоты (что
логично). Также в трансмембранных участках встречаются полярные аминокислоты, возможно, они обращены в полость образуемого
белком канала и участвуют в переносе веществ.
Ссылка на главную страницу
© Головачев Ярослав


