Задание 1 |
| Для данного задания был выбран белок Ferric uptake regulation из Campylobacter jejuni (pdb: 4ets, с разрешение 2,1 А). |
| Фермент представляет собой гомодимер A2, с цикличной симметрией - C2, содержит 162 аминокислотных остатка. Данный белок имеет N-terminal DNA-binding домен и |
| C-terminal dimerization домен. DBD состоит из пяти последовательных a-хеликаз (a1, a2, a3, a3-2, и a4) и двухцепоченым антипараллельным b-листов (b1-b2). |
| Вершина b2 связана с DD при помощи шарнира 8-го остака. DD является смешанным-a/b доменом, где b3-b4-b5 образуют закрученный b-лист переходный участок, |
| расположенный между b4 и b5, возле a5-спирали. Структура заканчивается, короткой a-спиралью (a6), координированую атомом металла. |
|
| Данный белок отвечает за регуляцию концентрации железа внутри Campylobacter jejuni (статья доступна по данной ссылке).
|
| Как правило белки данного семейства осущесвляют регуляцию концентрации железа как транскрипцинные репрессоры: связавшись с ионом металла, они преобретают |
| спосбность связываться с ДНК и подавлять таким образом экспрессию гена, и наоборот, при низких концентрации металла, они меняют обратно свою конформацию |
| и перестают блокировать экспрессию гена. |
|
| Для построения изображения использовали следующие команды: |
| load 4ets.ccp4, 4ets |
| hide (resn HOH) |
| isomesh new_surface, 4ets, x, где new_surface- имя нового объекта с изображением поверхности, 4ets - имя объекта с электронной плотностью, |
| x - уровень - значения электронной плотности, по которым строится поверхность. |
| Получившиеся результаты визуализации электронной плотности с помощью программы PyMOL с различными уровенями подрезки |
 |
| Рис 1, x = 1 |
 |
| Рис 2, x = 1,5 |
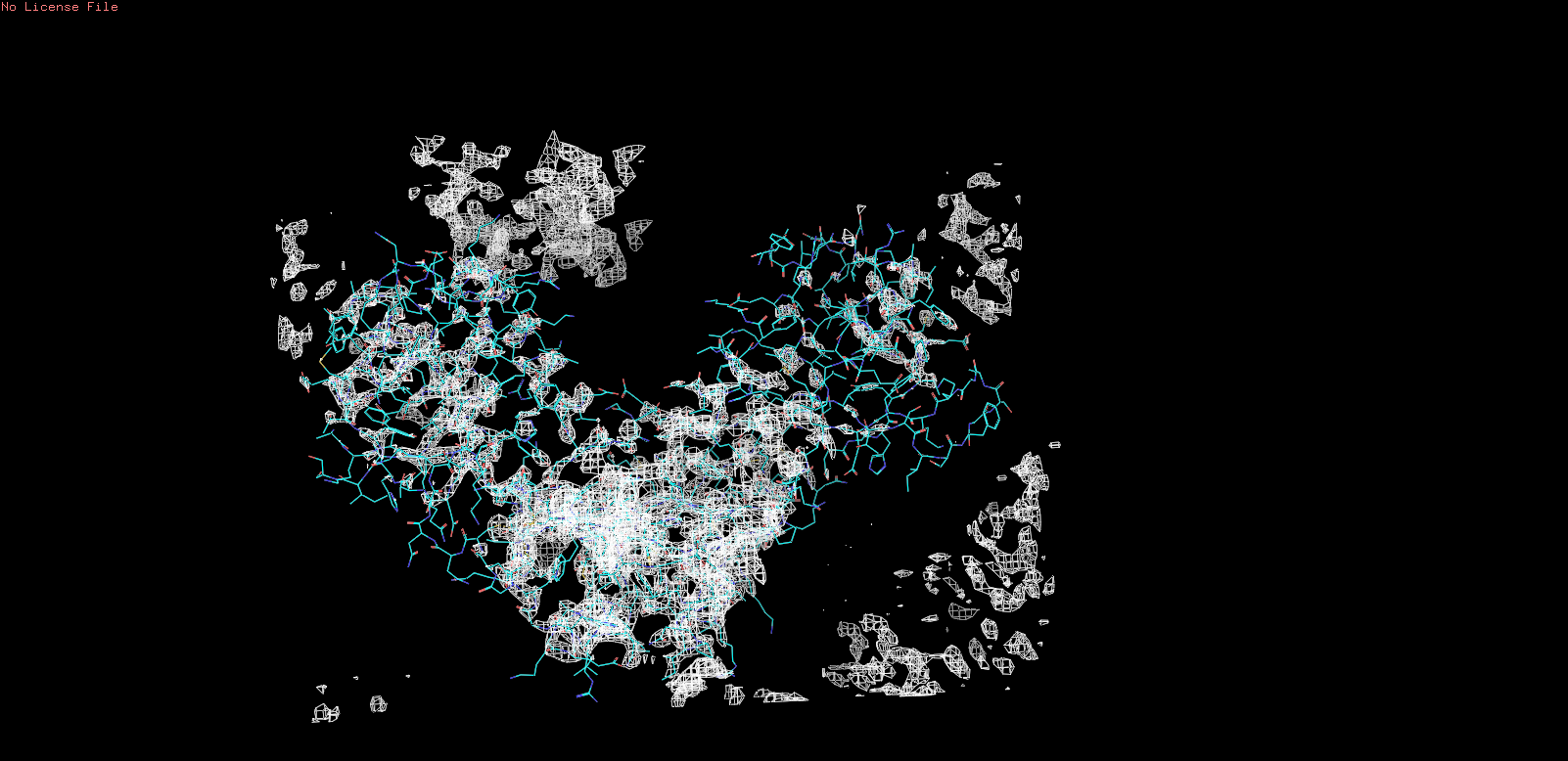 |
| Рис 3, x = 3 |
| |
Задание 2 |
| Были выбранны следующие аминокислотные остаткии: ala227, his237, tyr138 с аналогичными уровнями подрезки: |
|
| ALA |
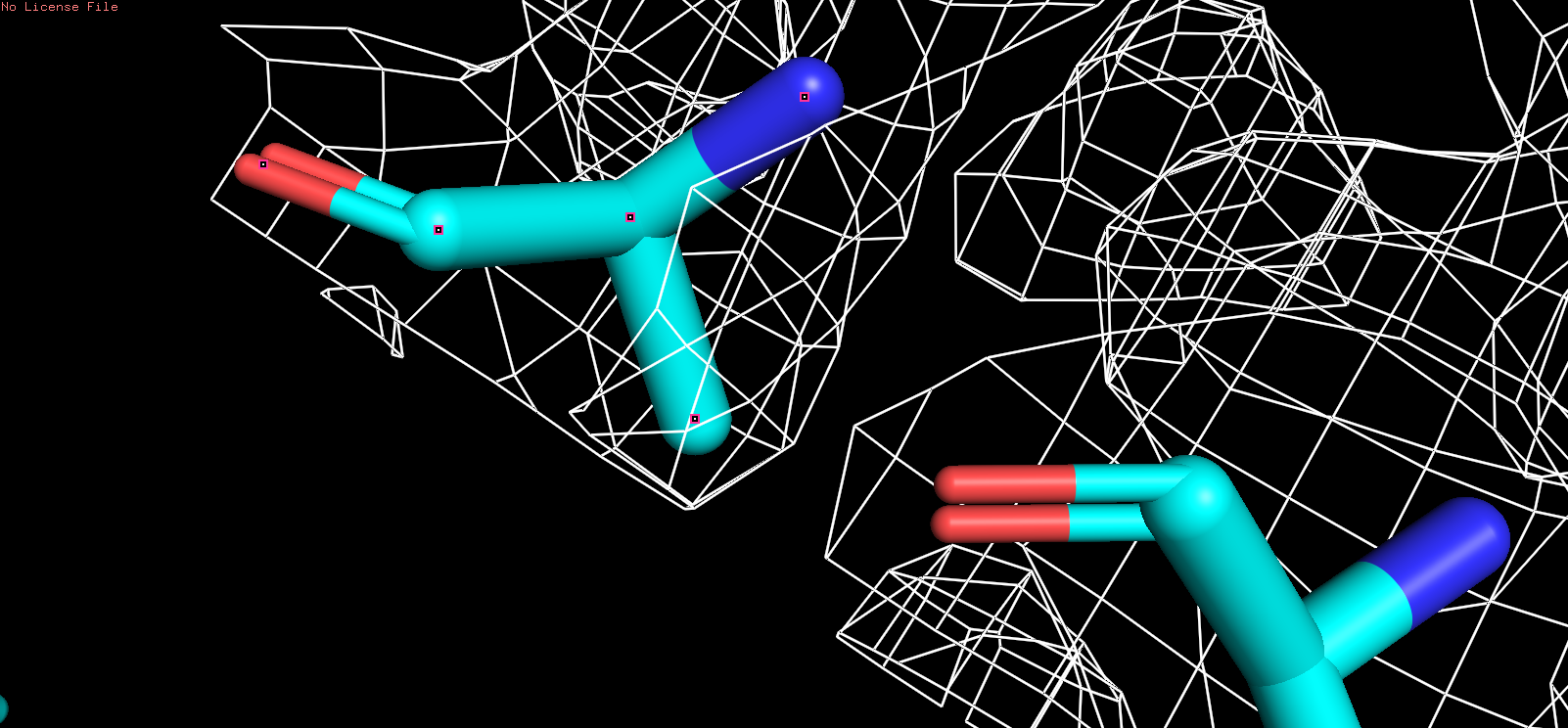 |
| Рис 4, x = 1 |
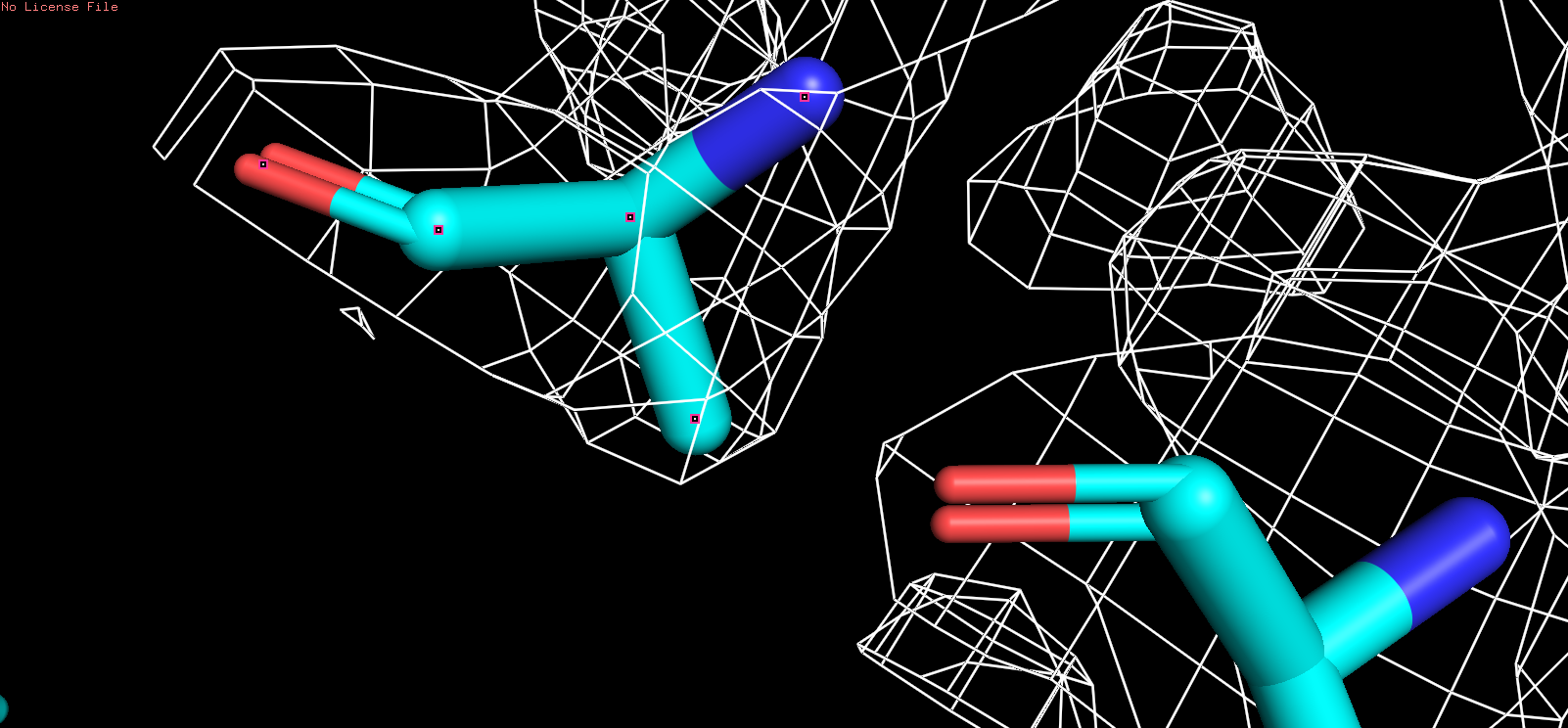 |
| Рис 5, x = 1,5 |
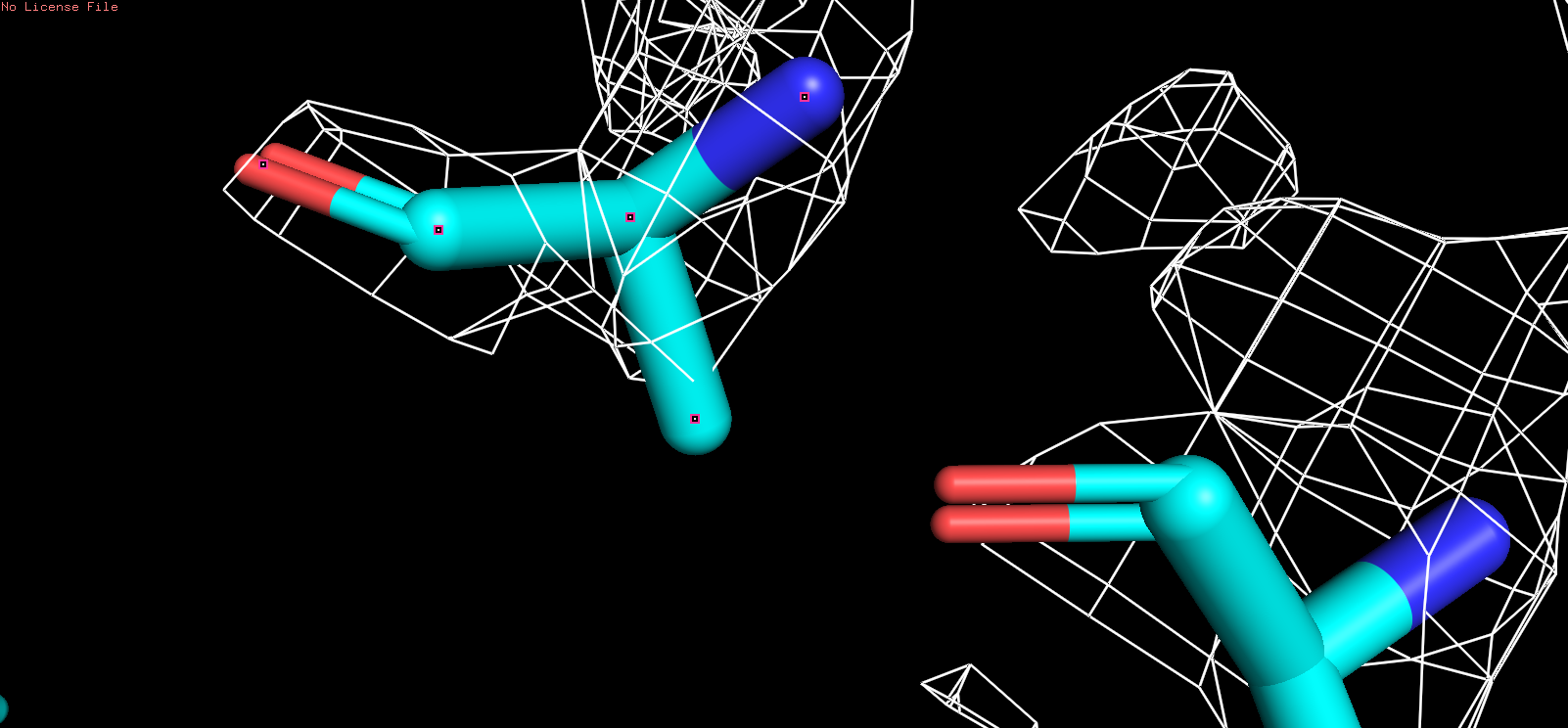 |
| Рис 6, x = 3 |
|
| HIS |
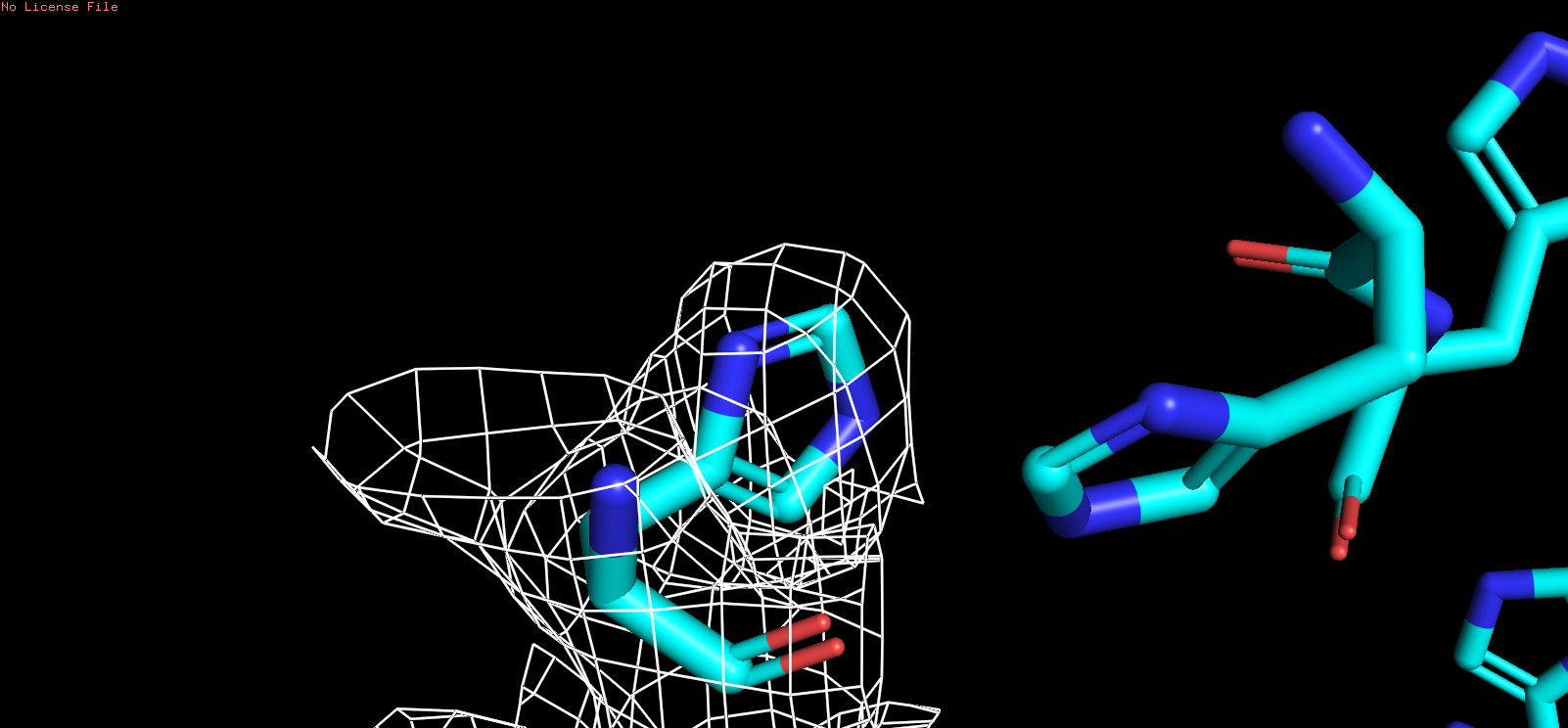 |
| Рис 7, x = 1 |
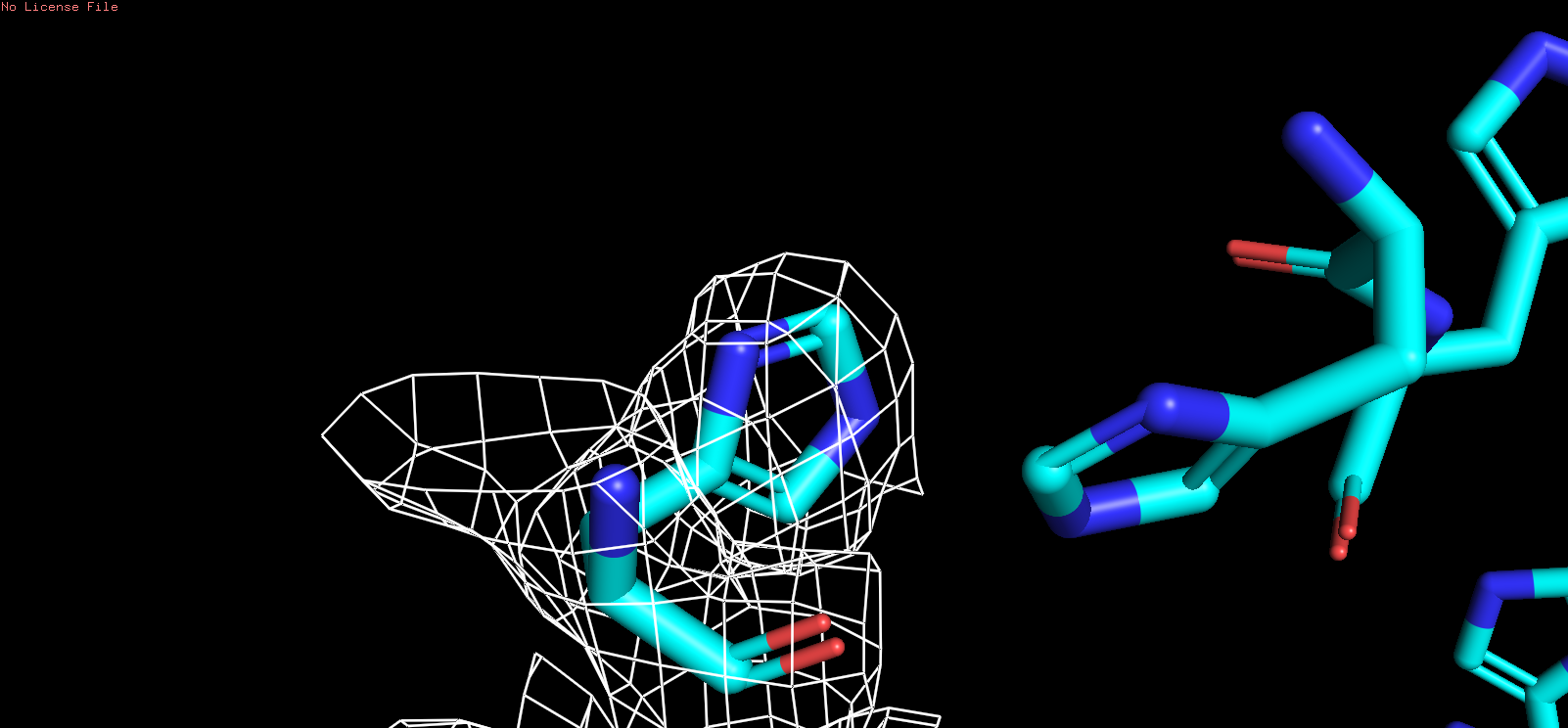 |
| Рис 8, x = 1,5 |
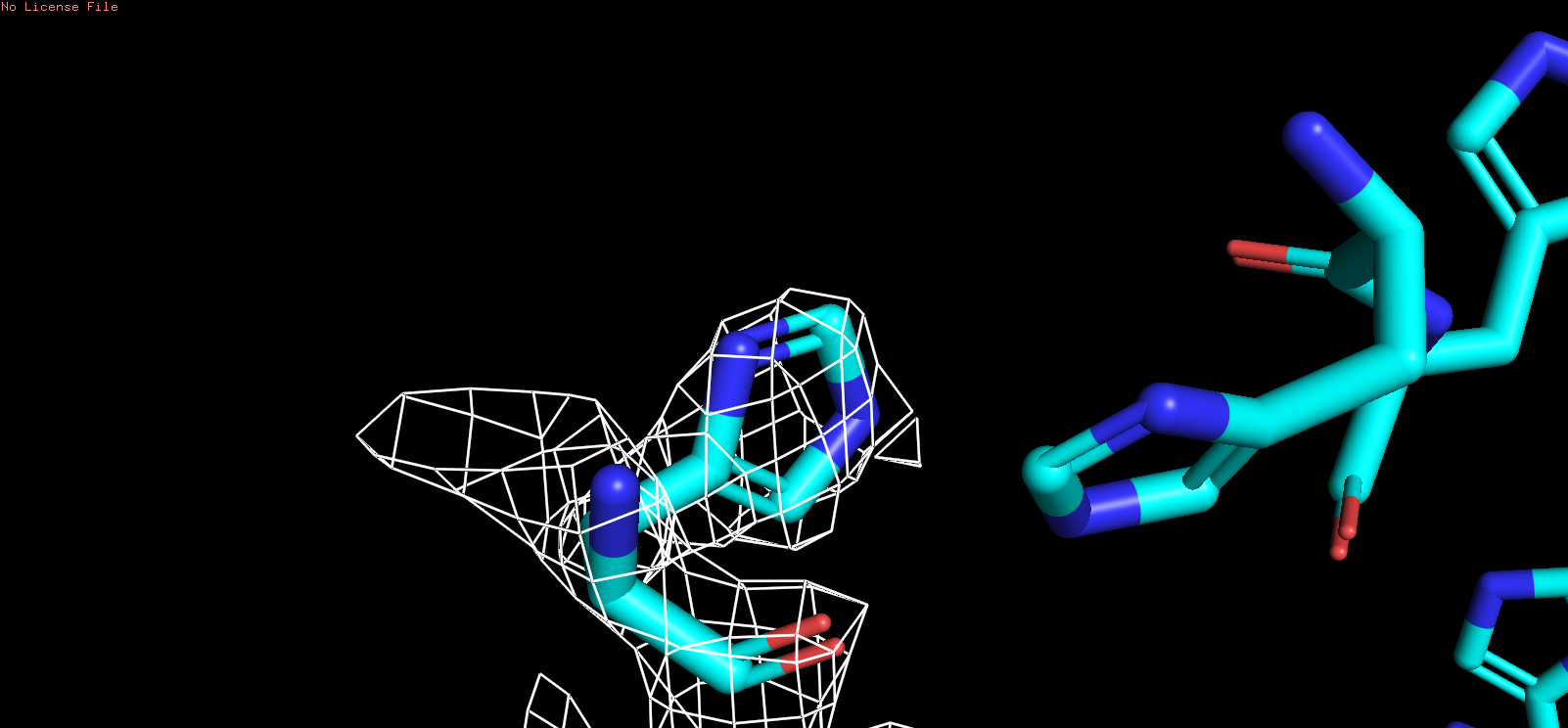 |
| Рис 9, x = 3 |
|
| TRP |
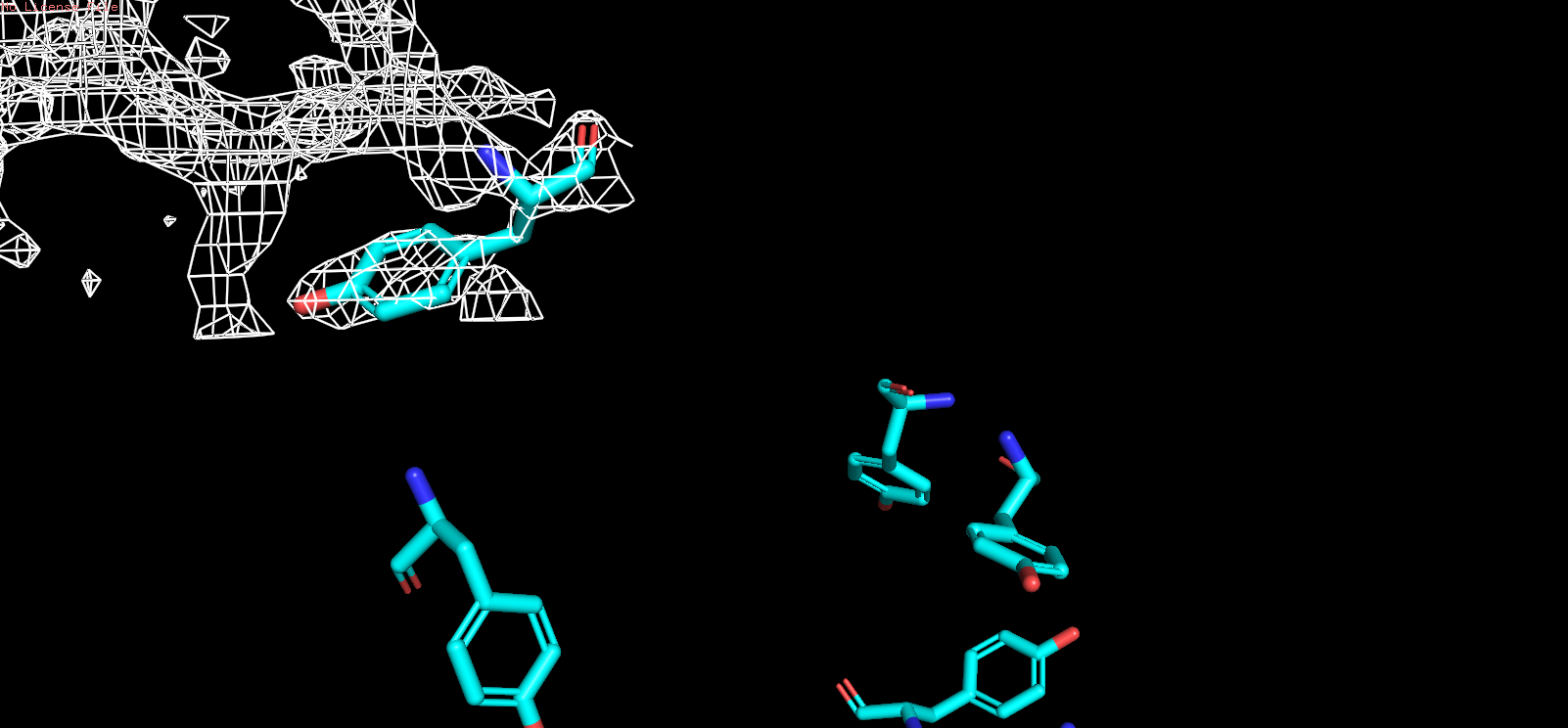 |
| Рис 10, x = 1 |
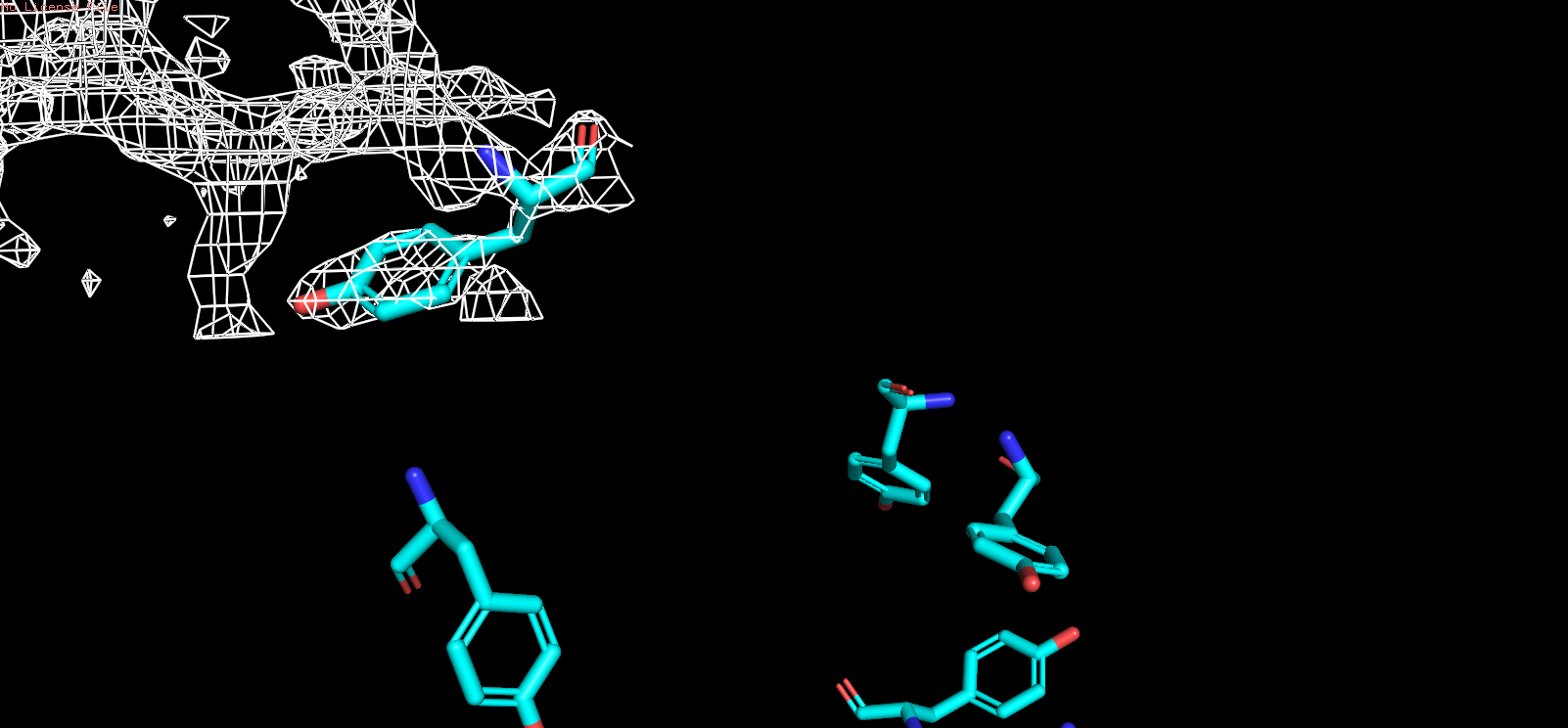 |
| Рис 11, x = 1,5 |
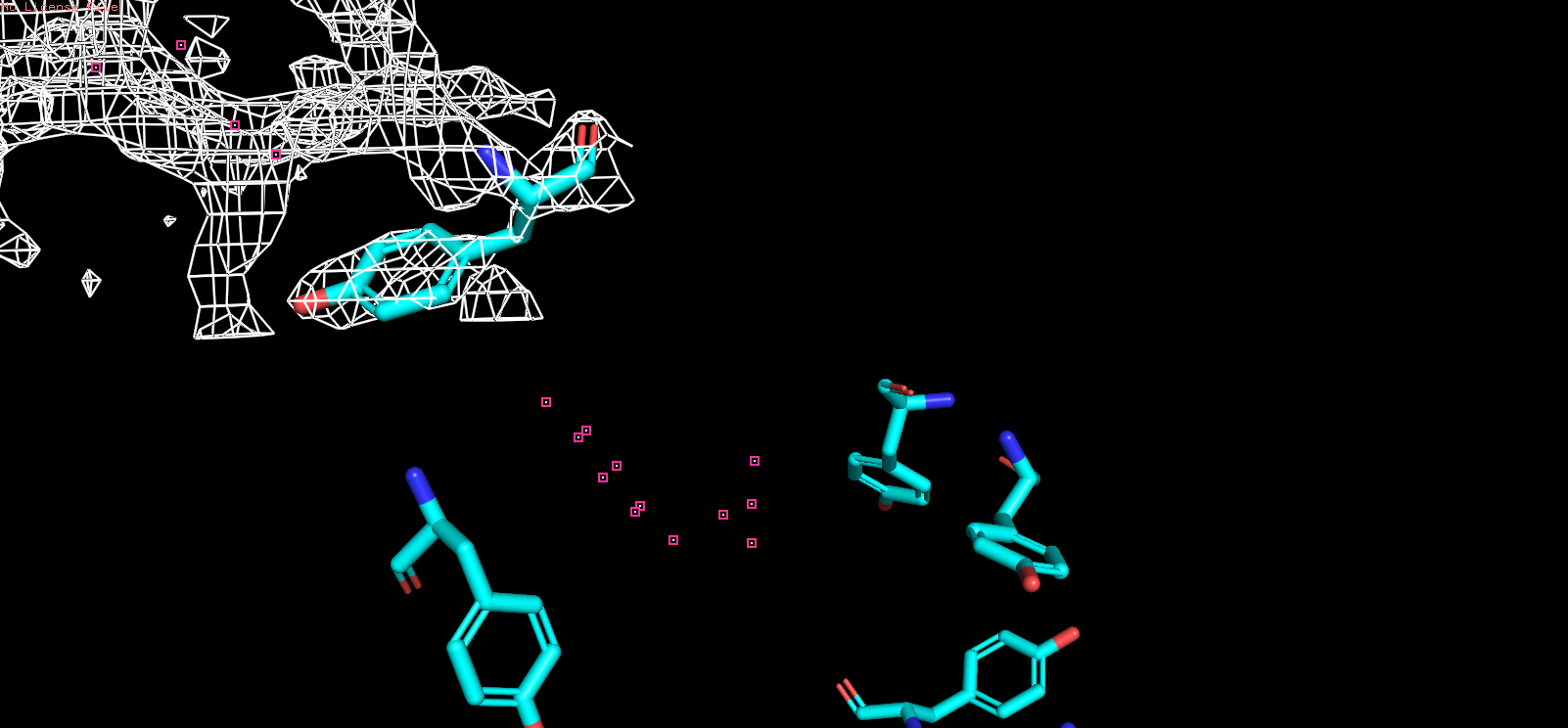 |
| Рис 12, x = 3 |
|
| Обсуждение и выводы: |
| Для уровнях подрезки электронной плотности 1,0 и 1,5, электронная плотность окружает |
| все атомы, входящие в состав аминокислот во всех рассмотренных случаях (ala, his, tyr), и еще некоторое пространство. |
| Однако при повышении уровня подрезки электронной плотности до 3,0 в уже не все атомы окружены электронной плотностью. |
| Таким образом, при использовании различных уровней подрезки можно выяснить, что координаты |
| атомов соответствуют сгущениям электронной плотности, но при этом в зависимости от уровня подрезки |
| не всегда положение атомов полностью соотвествует сетке электронной плотности. |
| Разрешение структуры в 2,1 ангстрем, является абсолютно не достаточным для того чтобы использовать карту электронной плотности |
| для описания в пространстве аминокислотных остаков (у некоторых а.к.о. не было даже видно электронной плотности при 3,0 А, в то время как |
| у других а.к.о. порог нужно было опускать до 1,0 чтобы разлглядеть хоть что-нибудь) |
| Меняя уровни подрезки под каждый а.к.о можно примерно опредлить ход цепи и как следствие, примерное расположение атомов, но этого не достаточно для точного определения |























