Задание 1 |
| Для данного задания был выбран белок супероксиддисмутаза (SUPEROXIDE DISMUTASE), для которого есть и ЯМР, и РСА структура. Пример был взят из таблицы 2010 года. |
| Структура, полученная при помощи РСА, имеет идентификатор 1MFM (разрешение ангстрем), при помощи ЯМР - 1BA9 (36 моделей). |
| Далее обе эти структуры были были открыты в PyMol и совмещены с помощью комманды align: |
| Все 36 моделей были отображены с помощью следующей команды: |
| set all_states, on |
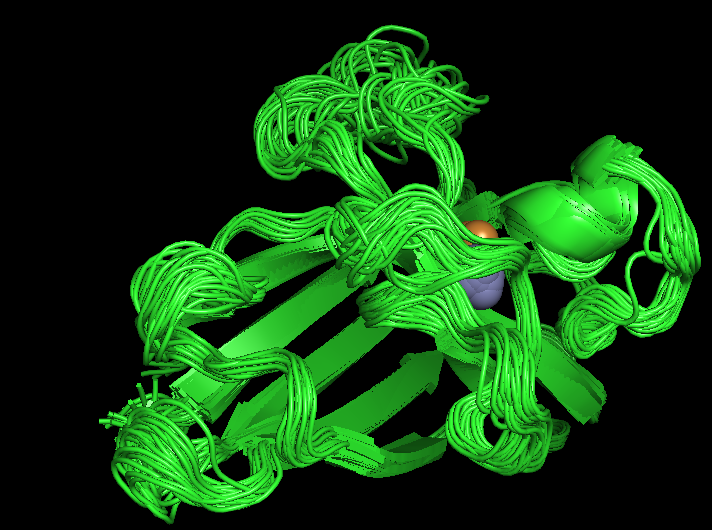 |
| Рис 1, визуализация всех 36 моделей |
| После модели были выравнены при помощи команды align 1BA9, 1MFM |
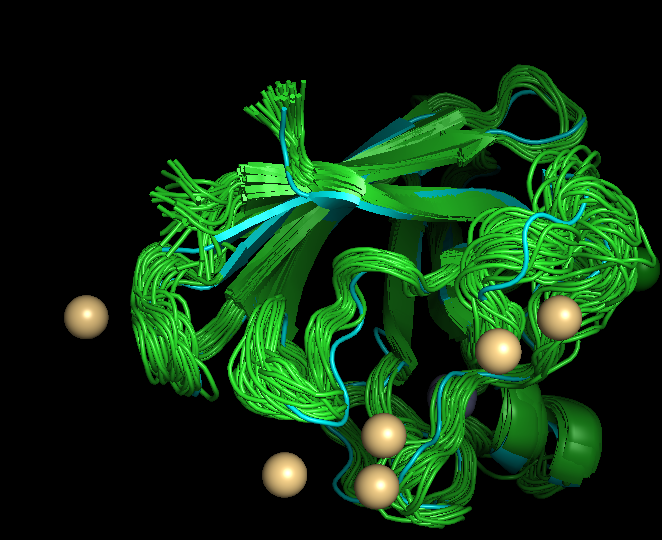 |
| Рис 2, укладки структур ЯМР и РСА похожи |
Задание 2 |
| Водородные связи были найдены с помощью PyMOL. |
| В структуре, расшифрованной с помощью РСА был выбрано 3 примера водородных связей: |
| GLU 132 (О) - LYS 136 (N) - остовная в альфа-спирали |
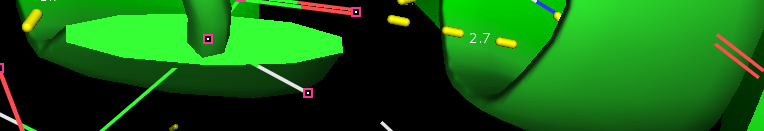 |
| Рис 3, Остовная водородная связь в альфа-спирали, длина 2.7 А |
| Вкачестве водородной связи боковых цепей в ядре белка была рассмотрена связь: ILE 99 (O) VAL 31 (N). Она скорее расположена в бета листе, чем в ядре, |
| но это самое близкое к условию задчи, что я смогла найти в данной структуре |
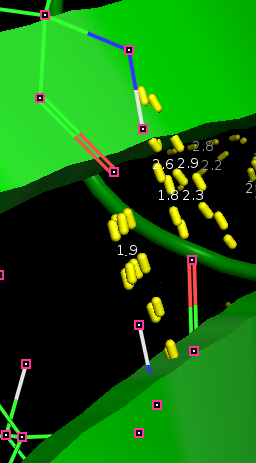 |
| Рис 4, водородная связь боковых цепей в ядре белка |
| Вкачестве водородной связи в петлях белка была рассмотрена связь: ASP 109 - SER 111. Однако данная связь была обнаружена лишь в нескольких моделях ЯМР. |
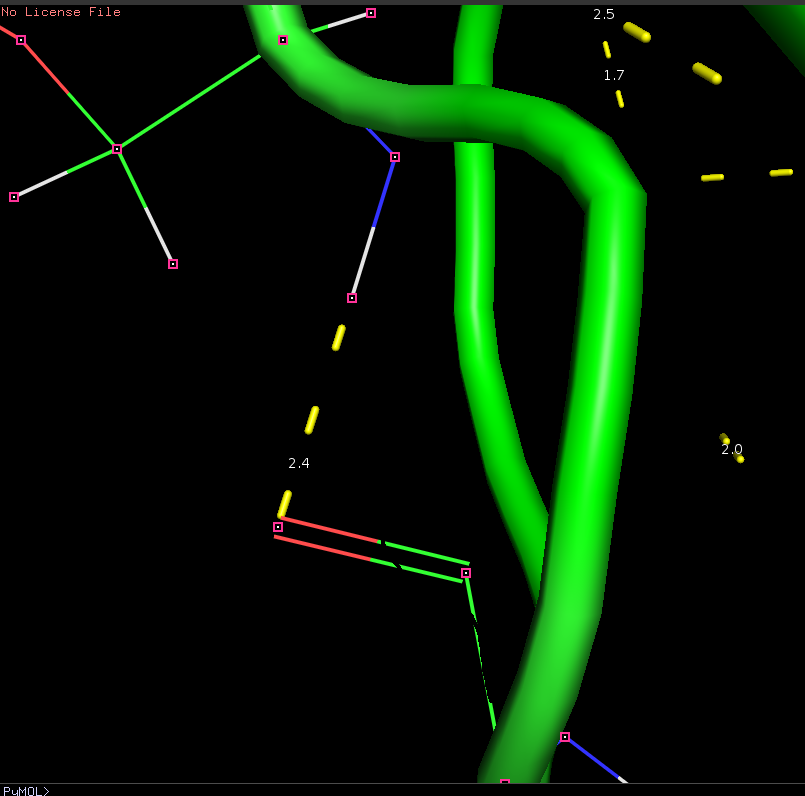 |
| Рис 5, Водородная связь в петлях, выходящих на поверхность глобулы |
| Сравнение водородных связей по данным РСА и ЯМР представлено в таблице 1: |
| донор-акцептор | длина связи рса | процент ямр с этой связью | минимальное значение | максмальное значение | медиана длины |
| Остовная водородная связь в альфа-спирали | GLU 132 (О) - LYS 136 (N) | 2.7 | 100% | 2.7 | 3.0 | 2.9 |
| водородная связь боковых цепей (бета-лист) | ILE 99 (O) - VAL 31 (N) | 1.9 | 100% | 2.5 | 2.8 | 2.6 |
| Водородная связь в петлях | ASP 109 - SER 111 | 2.4 | 8.3% | | | | |
|
|
|
| На основании полученных данных можно сделать следующие выводы: |
| 1. Остовная водородная связь в альфа-спирали и бета-листе присутствует во всех моделях ЯМР и её длина практически постоянна. |
| Скорее всего это связано с тем, что данные связи стабилизирует альфа-спираль/бета-лист. |
| 2. Оставшиеся водородная связь не содержатся свсего лишь в нескольких моделях ЯМР (и поэтому не была расмтрена более подробно). Вероятно, данная ориентация остатков относительно друг друга в структуре РСА |
| весьма неустойчива, и может проявлять в основном в результате кристаллизации и является артефактом. |




