Внутренности белков и макромолекулярных комплексов
Визуализация гидрофобного ядра α-L-Fucosynthase и ДНК-полимеразы, ассоциированной с молекулой ДНК
На апплете, представленном ниже, можно изучить положение одного из гидрофобных ядер в белке α-L-Fucosynthase, а также посмотреть визуализированное взаимодействие между белком и молекулой ДНК.
Для запуска скриптов необходмо нажать на эти кнопки.
Кнопка для переключения между сценариями.
Ссылки на скрипт-1, скрипт-2, скрипт-3, скрипт-4a, скрипт-4b, скрипт-4c последовательно показывающие данные изображения.
Гидрофобное ядро
Гидрофобные взаимодействия - стремление неполярных групп белка уйти из водного окружения, поскольку при этом происходит освобождение молекул воды, образующих вокруг неполярных групп белка льдоподобные упорядоченные структуры. Эти взаимодействия являются одним из основных факторов, которые определяют стабильность структуры белка. Когда в макромолекуле белка образовываются гидрофобные ядра, происходит уменьшение свободной энергии системы белок-растворитель за счет возрастания энтропии растворителя [1]. Чтобы визуализировать гидрофобное ядро α-L-Fucosynthase, использовалась информация, полученная с помощью сервиса CluD. Для её получения по PDB ID α-L-Fucosynthase (2WSP) было найдено описание всех гидрофобных ядер данного белка, в общей сложности их число составляет 22, а число атомов, из которых состоят эти ядра, равно 2219 (что составляет 30.9% от общего числа атомов белка). Было выбрано наибольшее (по числу входящих в него атомов) ядро, им является первое гидрофобное ядро, на которое приходится 2058 атомов, что составляет 28.7% от общего числа атомов (7168). Из этого следует, что значительная часть молекулы белка является гидрофобной и если изучить положение остальных атомов в белке относительно гидрофобного ядра, то можно заметить, что существуют гидрофобные участки, которые выходят на поверхность белковой глобулы. Можно предположить, что в этих местах происходит связывание белка с субстратом или с лигандом. А также, возможно, эти выступающие участки необходимы для осуществления белок-белковых взаимодействий.
Исследование плотности упаковки атомов в гидрофобном ядре
Для проведения этого исследования был выбран крупный аминокислотный остаток, боковая цепь которого входит в состав гидрофобного ядра (PHE[168]:a). Исследовалась плотность упаковки атомов в гидрофобном ядре относительно одного, выбранного остатка, на расстоянии до 7.0 Å. Как можно убедиться, на расстоянии равном 5.0 Å атомы практически полностью покрывают остаток, за исключением небольших участков. Когда расстояние доходит до 7.0 Å остаток становится едва различим за окружающими атомами, что свидетельствует о плотной упаковке гидрофобных остатков в белковой молекуле. Было подсчитано, что расстояние между соседними ковалентно несвязанными атомами составляет примерно 3.986 Å. Для того чтобы это подсчитать было измерено расстояние между 10 ковалентно несвязанными атомами, а затем было найдено среднее арифметическое этих измерений (причем рассматривались атомы, расположенные близко друг от друга в пространстве). Теоретически в белковой молекуле могут существовать пространства, в которых могут локализоваться молекулы других веществ, например, воды. Однако, подсчитав примерный размер молекулы воды, приняв её размер, равный диаметру кислорода, и пренебрегая диаметром водородов: 1.4*2 = 2.8 Å. Если подсчитать свободное расстояние при минимальных ван-дер-ваальсовых радиусах, то оно составит 3.986 - 2.8 = 1.186 Å. Эта величина намного меньше диаметра молекулы воды, что доказывает отсутствие данных молекул в гидрофобном ядре.
Взаимодействие белков и ДНК
Выше визуализировано взаимодействие участка молекулы человеческой ДНК-полимеразы eta с ДНК (PDB ID: 5KFT). ДНК-полимераза представляет собой фермент, который использует существующую ДНК в качестве матрицы для создания новой ДНК путем добавления новых нуклеотидов к концу вновь формирующейся дочерней цепи. Этот фермент катализирует образование фосфодиэфирной связи, для образования которой необходимо, чтобы произошло связывание с катионами металлов [2]. Данная ДНК-полимераза специфически участвует в восстановлении ДНК с помощью трансляционного синтеза и осуществляет следующую реакцию [3]: Дезоксинуклеозидтрифосфат + ДНК(н) = Дифосфат + ДНК(н+1) ДНК-полимераза добавляет нуклеотиды к 3'-гидроксильной группе предыдущего нуклеотида в цепи ДНК, поэтому все полимеразы работают в направлении 5'-> 3'. В активном центре этих ферментов субстрат — нуклеозидтрифосфат — спаривается с комплементарным основанием в составе одноцепочечной полинуклеотидной цепочки — матрицы. На апплете можно наблюдать, что молекула полимеразу находится в непосредственной близости от молекулы ДНК, что необходимо для нормальной работы фермента. Помимо этого молекула ДНК способна взаимодействовать и с другими белками, например: структурные белки - гистоны - поддерживающие определенную конформации молекулы нуклеиновой кислоты, различные хеликазы - белки, которые являются одним из молекулярных моторов. В различных процессах, происходящих в клетке, например, рекомбинации и репарации, участвуют ферменты, способные разрезать и восстанавливать целостность нитей ДНК, к примеру, ДНК-лигазы «сшивают» концы фрагментов ДНК между собой, катализируя формирование фосфодиэфирной связи с использованием энергии АТФ [4].
Взаимодействие белка и молекулы ДНК
 |
Изучив визуализированное выше взаимодействие белка и ДНК, можно убедиться в том, что если брать критерием взаимодействия атомов расстояние равное 5.0 Å, то становятся видны возможные взаимодействия между молекулой белка и сахаро-фосфатным остовом ДНК. Также можно заметить, что одно из азотистых оснований повернуто в противоположную сторону относительно других. Такое его расположение обеспечивает возможность взаимодействия молекулы белка и ДНК, в частности, способен вступать во взаимодействие следующий остаток аминокислоты: [PRO]326. Помимо этого, при детальном изучении молекулы ДНК в окружении белка было отмечено, что с сахаро-фосфатным остовом напрямую взаимодействуют [K]507 и [CA]502, которые в свою очередь ковалентно связаны с аминокислотными остатками белковой молекулы. Однако в апплете они не отражены, так как для визуализации выбрана была другая часть белковой молекулы.
Доноры и акцепторы протонов в молекуле ДНК
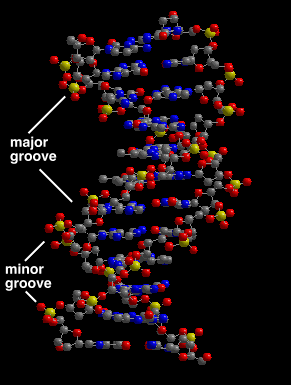
Между остовами двух отдельных цепей имеются две широкие бороздки. Большая бороздка видна на модели снизу и сверху, малая бороздка — в центре [5]. По расположению доноров и акцеторов протонов можно определить последовательность ДНК, так как для разных азотистых оснований характерно собственное уникальное их размещение. Результат визуализации расположения доноров и акцепторов протонов в большой и малой бороздках молекулы ДНК Вы можете посмотреть по ссылкам 4b и 4c. В данном апплете доноры покрашены в синие тона, в частности, в цвет индиго, а акцепторы - в красные, в частности, в розовый.
Источники:
| [1] И. М. Кузнецова, В. Форже, К.К. Труверов, "Структурная динамика, стабильность и фолдинг белков", Цитология, том 47, №11, 2005. [2] Yang Gao, Wei Yang, Capture of a third Mg2+ is essential for catalyzing DNA synthesis, Science, 10 Jun 2016. [3] https://www.uniprot.org [4] https://ru.wikipedia.org [5] Ян Кольман, Клаус-Генрих Рем, Юрген Вирт, Наглядная биохимия, 469 с, 2000. |