Учебный сайт Полины Байкузиной | |||
| Главная | Семестры | О себе | Ссылки |
Мембранные белкиЗадание 1. Анализ множественного выравнивания трансмембранных белков Данный белок: богатый триптофаном белок-транслокатор TspO (Tryptophan-rich protein TspO), идентификатор в PDB: 4rym. Для белка была получена репрезентативная выборка гомологов с помощью BLAST на сайте EMBL EBI по кластерам UniRef50. Репрезентативная выборка содержит 200 гомологов, E-value худшей находки 1.8E-11. Затем было получено множественное выравнивание программой Muscle. Не все последовательности хорошо выровнялись, также были и короткие белки. Удаленные короткие белки: Q8KEI1, R7F1X7, U2CG21, R5PZV6, R5DWA6, R7MD76, R5HLF7, A0A0F9K3D0, U2E8Q1, C2WPG8, A0A0E0W3K1, C2X0G0. Плохо выровненные последовательности: A0A127SG77, B0MWK7, UPI0003B73405, I0YSH2. Cсылка на файл с итоговым выравниванием. С выравниванием также можно ознакомиться в проекте Jalview (окно alignment). Выравнивание было открыто в программе Jalview. Первая последовательность в выравнивании - исходный белок. С этой последовательностью ассоциирована 3D-структура данного белка (рис.1), в соответствии с которой были размечены трансмембранные спирали ("M"в строке "TM_REAL"). 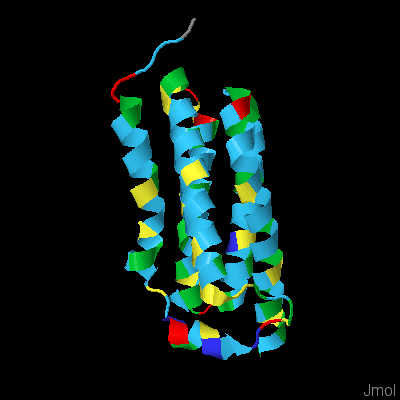
Позиции, соответствующие трансмембранным спиралям, в основном представлены гидробофными аминокислотными остатками (L, V, I, F и другие). Из выравнивания видно, что в трансмембранных спиралях и в участках между спиралями встречаются достаточно консервативные позиции. В трансмембранных спиралях также встречаются полярные и отрицательно заряженные аминокислотные остатки. Возможно, их присутствие связано с функцией белка (данный белок связывает стероиды и порфирины). На рис.2 представлено изображение белка с окраской по гидрофобности (JalView Hydrophobicity). Был установлен порог идентичности 10%. Как видно из рисунка, уже при таком низком пороге очень мало консервативных колонок, поэтому говорить о консервативности многих участков сложно. 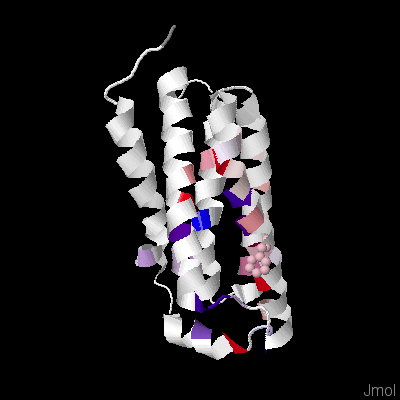
Затем для гомолога C2W6V5 было получено предсказание трансмембранных спиралей, выдаваемых программой TMHMM. Описание предсказанных трансмембранных участков в строке аннотаций "TM_PREDICTION" (буква "Р"). В целом, предсказание участков совпало с реальностью. Разница составляет всего лишь несколько позиций. 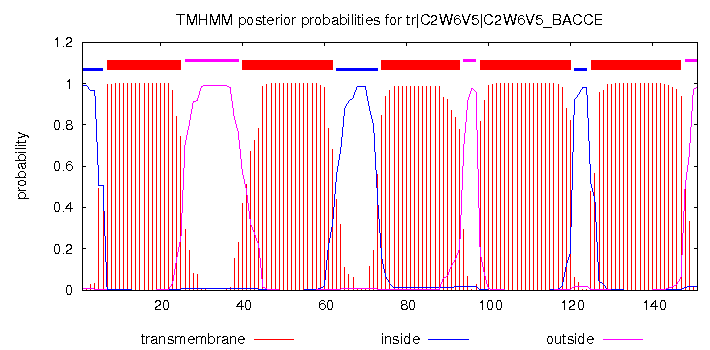
|