Учебный сайт Полины Байкузиной | |||
| Главная | Семестры | О себе | Ссылки |
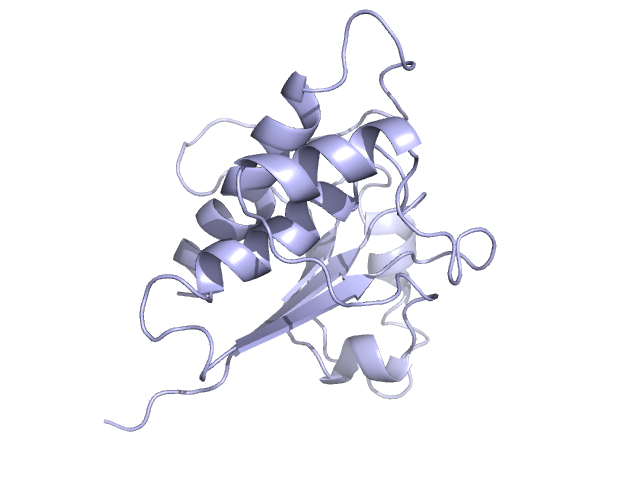
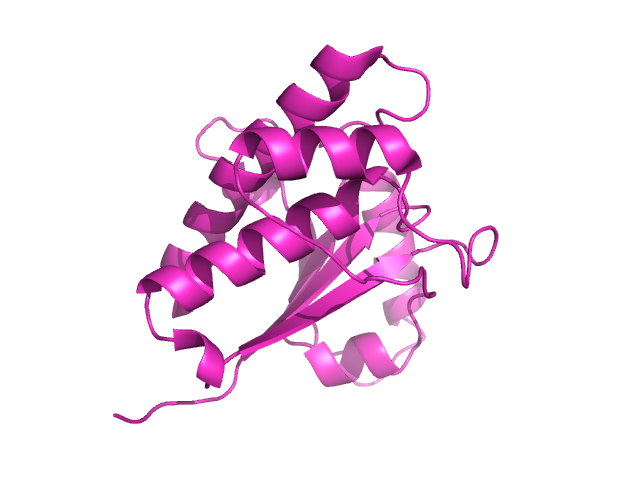
Анализ ЯМР-файлаДля работы были выбраны структуры низкомолекулярной протеиновой тирозинфосфатазы (LMW-PTP), полученные с помощью ЯМР (PDB: 1BVH) и РСА (PDB: 1DG9). Разрешение РСА: 1.9Å. Число моделей ЯМР: 15.
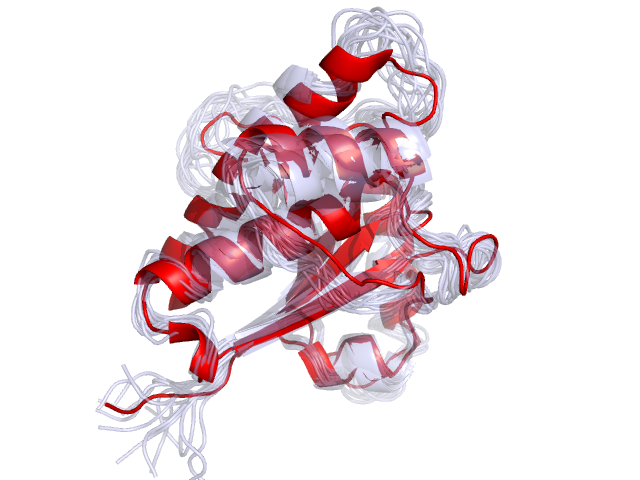
На рисунке 2 сопоставлены модели ЯМР и РСА. Укладка структур в целом сходна, различия наблюдаются на N-конце и свободных петлях, так как эти структуры наиболее подвижны в растворе. Сопоставление было выполнено с помощью команды align.
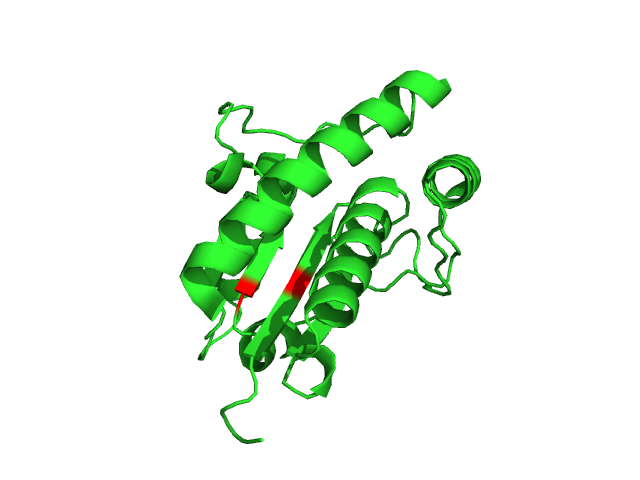
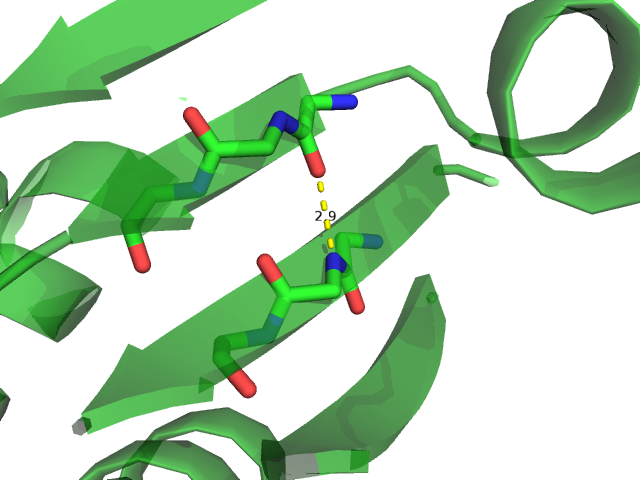
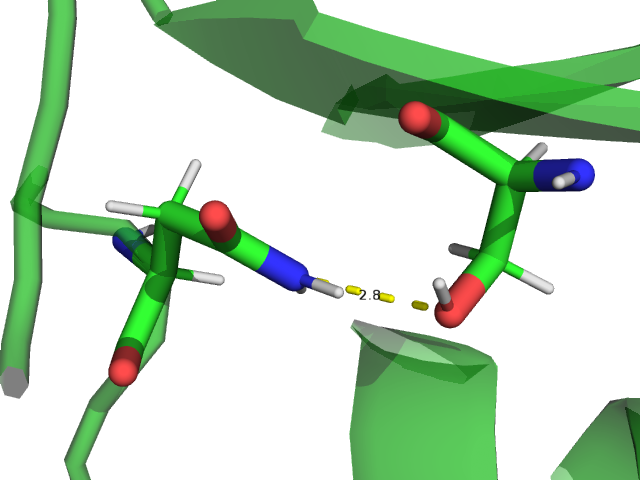
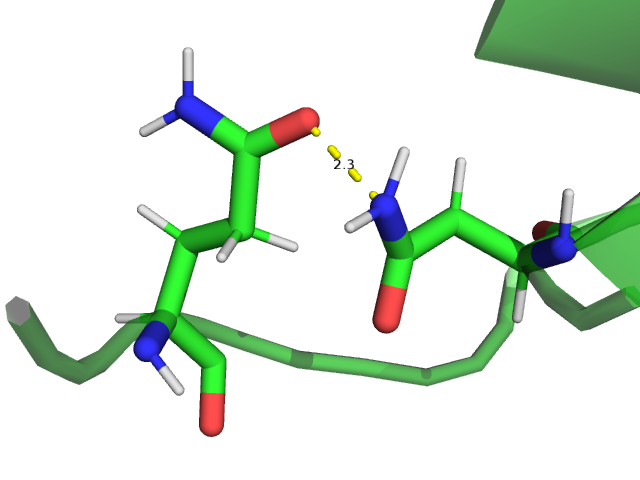
Для анализа были выбраны 3 водородные связи:
Считаем, что между донором протона и акцептором есть водородная связь, если расстояние между ними меньше 3,5 ангстрем, угол между направлениями акцептор-донор-водород и донор-акцептор-водород не более 70°. Номера остатков заданы по структуре 1DG9 (РСА).
Выбранные водородные связи были проанализированы в моделях ЯМР. Полученные результаты приведены в таблице 1. Для каждой водородной связи оценивалось расстояние в РСА, в каком проценте моделей ЯМР есть водородная связь, минимальное, максимальное и медианное значение расстояния в ЯМР.
Остовная водородная связь в бета-листе присутствует во всех моделях ЯМР. Данная связь достаточно стабильна и важна для поддержания структуры белка. Водородные связи между атомами боковых цепей как в глобуле, так и на ее поверхности оказываются не такими стабильными. Водородная связь между атомами боковых цепей остатков, расположенных в свободной петле на поверхности глобулы, встречается только в 1 модели из 15, что говорит о том, что петли белка обладают большей подвижностью. |