Общая характеристика белка структуры 3CBW
Маннан эндо-1,4-β-маннозидаза - относительно небольшой белок, состоящий из двух цепей - A и B. С белком в сайтах связывания нековалентно связаны три молекулы цитрата. (Табл. 1 и Рис. 1):
| PDB ID | 3CBW |
| Название | Маннан эндо-1,4-β-маннозидаза (Mannan Endo-1,4-β-Mannosidase) |
| Количество цепей | 2 |
| Другие молекулы | 3 молекулы цитрата [CYT] |
Табл. 1 Общие признаки белка структуры 3CBW.

Рис. 1. Общий вид белка 3CBW. N-конец белка окрашен в желтый цвет. По мере приближения к C-концу белка оттенки вторичных структур изменяются от желтого к красному. Атомы кислорода в молекулах воды окрашены в красный цвет. 3 молекулы цитрата выделены зеленым цветом.
Анализ структуры альфа-спиралей и бета-листов в цепи A белка структуры 3CBW
В качестве исследуемых объектов служили одна альфа-спираль и один бета-лист, образованный тремя бета-тяжами (Рис. 2):
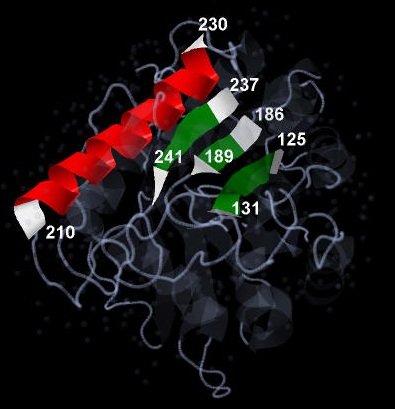
Рис. 2. Общий вид А цепи исследуемого белка. Альфа-спираль окрашена в красный цвет, бета-тяжи - в зеленый. Первая и последняя аминокислота каждой вторичной структуры окрашена в белый цвет и обозначена соответствующим ей порядковым номером в цепи.
Исследование альфа-спирали
Исследуемая спираль находится в позиции начиная с 210 и заканчивая 230 аминокислотой А цепи белка:

Рис. 3. Исследуемая альфа-спираль.
Спираль образована пятью полными витками. Эти витки заключены между 221 и 229 аминокислотами, поэтому далее речь будет идти только об этом участке спирали. Расстоние между этими аминокислотами 26.99Å:

Рис. 4. Длина пяти полных витков альфа-спирали.
Величину шага спирали можно получить из выражения: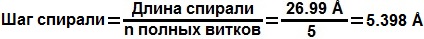 Число аминокислотных остатков на виток:
Число аминокислотных остатков на виток:
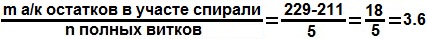
Каждая аминогруппа при Cα атоме образует водородную связь с карбонильной группой аминокислоты, находящийся на 4 аминокислоты раньше. Т.е. аминокислота n будет образовывать водродные связи с аминокислотами n-4 и n+4.
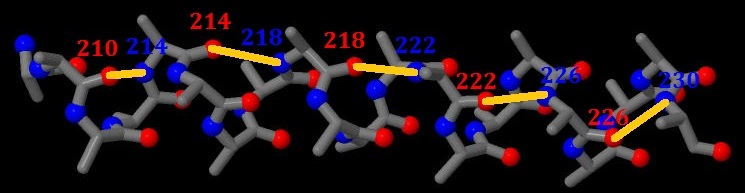
Рис. 5. Водородные связи в исследуемой альфа-спирали. Синим цветом окрашены атомы азота при Сα, а красным - атомы кислорода карбонильной группы при Сα атоме. Водородая связь обозначена желтым цветом.
Полученные значения параметров исследуемой альфа-спирали близки к идеальным (Табл. 2):
| Параметр | Идеальная α-спираль | Исследуемая α-спираль |
| Шаг спирали | 5.4 Å | 5.398 Å |
| Количство а/к остатков на виток |
3.6 - 3.7 | 3.6 |
| Паттерн образования водородных связей |
(n-4)→n→(n+4) | (n-4)→n→(n+4) |
Табл. 2 Сравнение исследуемой альфа-спирали с идеальной.
Исследование бета-листа
На рис. 2 показана позиция бета-листа на цельной структуре А-цепи белка.
Исследуемый бета-лист состоит из трех параллельных бета-тяжей (Рис. 6). Это означает, что тяжи сонапрвлены.
Антипараллельные же будут противоположно направленными.
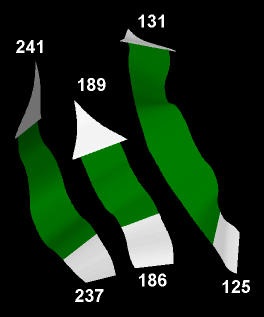
Рис. 6. Исследуемый бета-лист.
Бета-лист образует очень неровную выпуклую поверхность (Рис. 7):
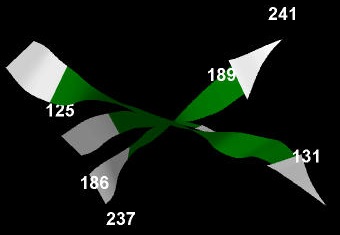
Рис. 7. Выпуклая поверхность исследуемого бета-листа.
Внутримолекулярные взаимодействия боковых групп белка в цепи A структуры 3CBW
В исследуемой цепи имеется 2 цистеиновых остатка с порядковыми номерами 92 и 112, образующих между собой дисульфидный мостик (Рис. 8):
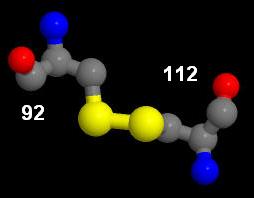
Рис. 8. Дисульфидный мостик в исследуемой цепи.
Также в цепи имеются солевые мостики. Обычно они образуются между положительно заряженнымой аминогруппы Лизина или гуанидиновой группой Аргинина и отрицательно заряженными карбоксильными группами Глутамата или Аспартата. Между этими же амнокислотными остатками солевые мостики образованы и в исследуемой цепи белка. Их в цепи как минимум пять (Рис. 9):
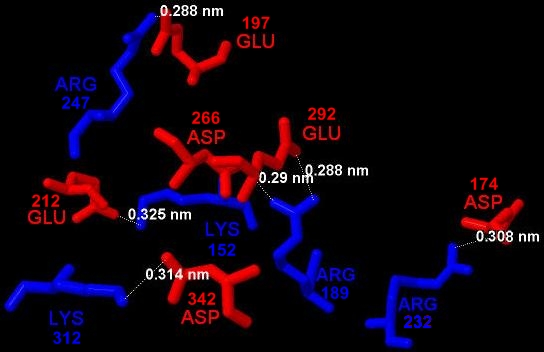
Рис. 9. Солевые мостики в исследуемой цепи. В красный цвет окрашены отрицательно заряженные аминокислотные остатки, а в синий - положительно заряженные. У каждого аминокислотного остатка указано соответствующее положение в цепи А белка.
Один из них более детально изображен на Рис. 10:
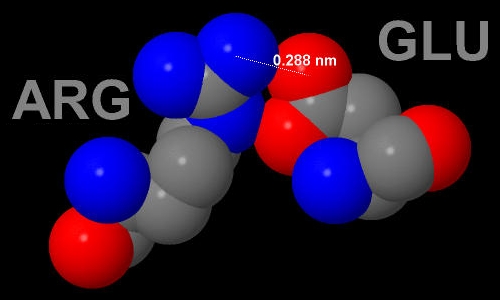
Рис. 10. Солевой мостик между 247 Аргинином и 197 Глутаматом. Длина мостика 2.88Å.
В итоге в цепи А есть следующие взаимодействия боковых групп (Табл. 3):
| Количество цистеиновых остатков | 2 |
| Количество дисульфидных мостиков | 1 |
| Количество солевых мостиков | 5 |
Табл. 3 Внутримолекулярные взаимодействия боковых групп цепи А в исследуемом белке.