Структура химотрипсина – 4H4F
Для работы была выбрана модель 4H4F, которая представляет собой структуру человеческого химотрипсина. Фермент является мономером. Асимметрическая единица состоит из одной цепи (цепь A).
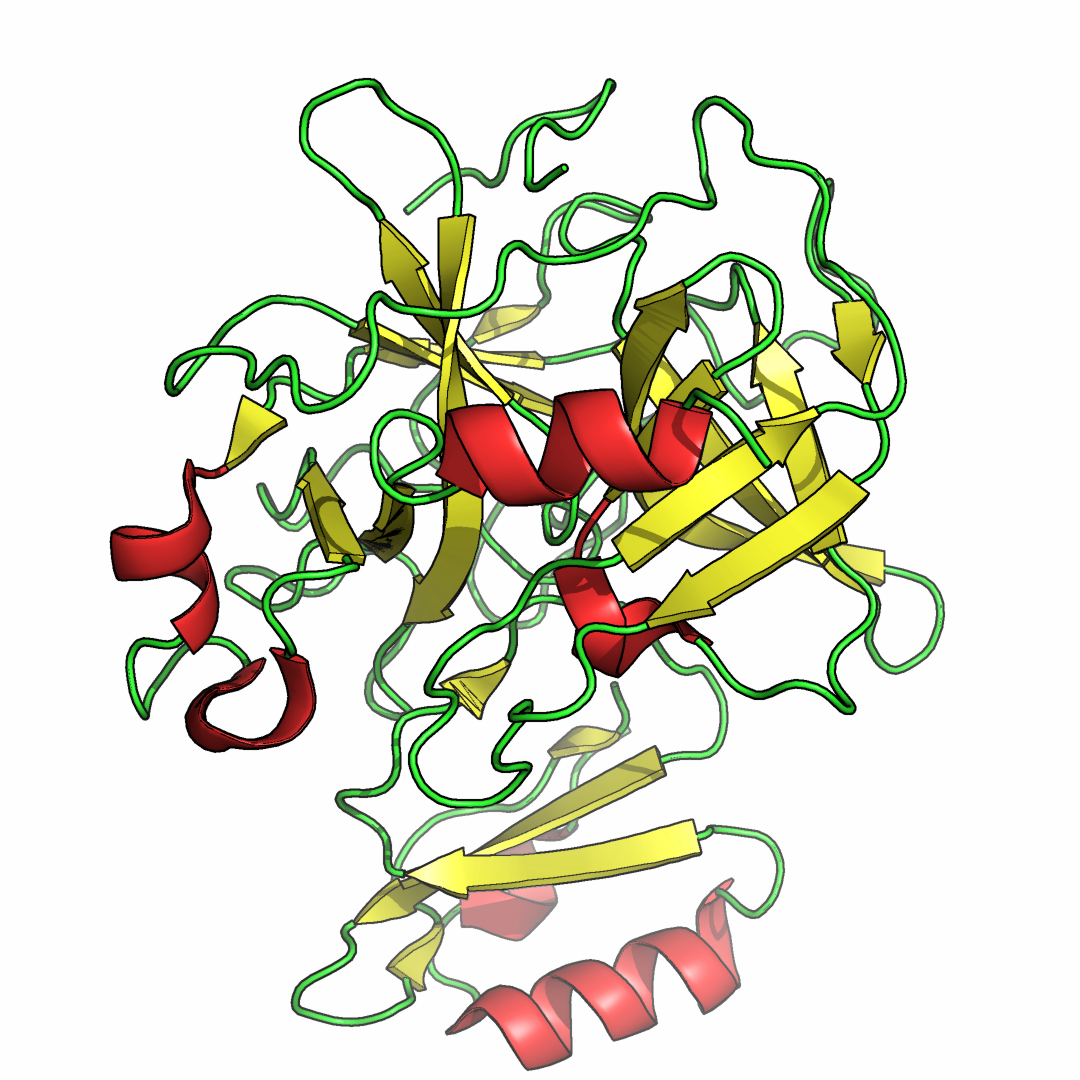 Рисунок 1. Структура химотрипсина в виде ленточной диаграммы. Окраска по вторичным
структурам (tv_red – альфа-спирали, tv_yellow – бета-тяжи, green – остальное).
Рисунок 1. Структура химотрипсина в виде ленточной диаграммы. Окраска по вторичным
структурам (tv_red – альфа-спирали, tv_yellow – бета-тяжи, green – остальное).
Кристаллографические характеристики
В поле CRYST1 pdb-записи 4H4F указано следующее:
CRYST1 56.272 76.253 81.823 90.00 90.00 90.00 P 21 21 21 4
Из этой сроки получааем информацию о кристаллографических характеристиках модели 4H4F:
Длины направляющих векторов кристалла
- a = 56.272
- b = 76.253
- c = 81.823
Углы между направляющими векторами кристалла
- α = 90.00
- β = 90.00
- γ = 90.00
Кристаллографическая группа: P 21 21 21
Число молекул в ячейке: 4
Построение соседних ячеек кристалла
Для восстановления соседних образов, находящиеся не далее чем на 30 A от исходной молекулы, была использована команда symexp в PyMOL:
symexp sym, 4h4f, 4h4f, 30
В результате было получено изображение молекул соседних ячеек (рис. 2).
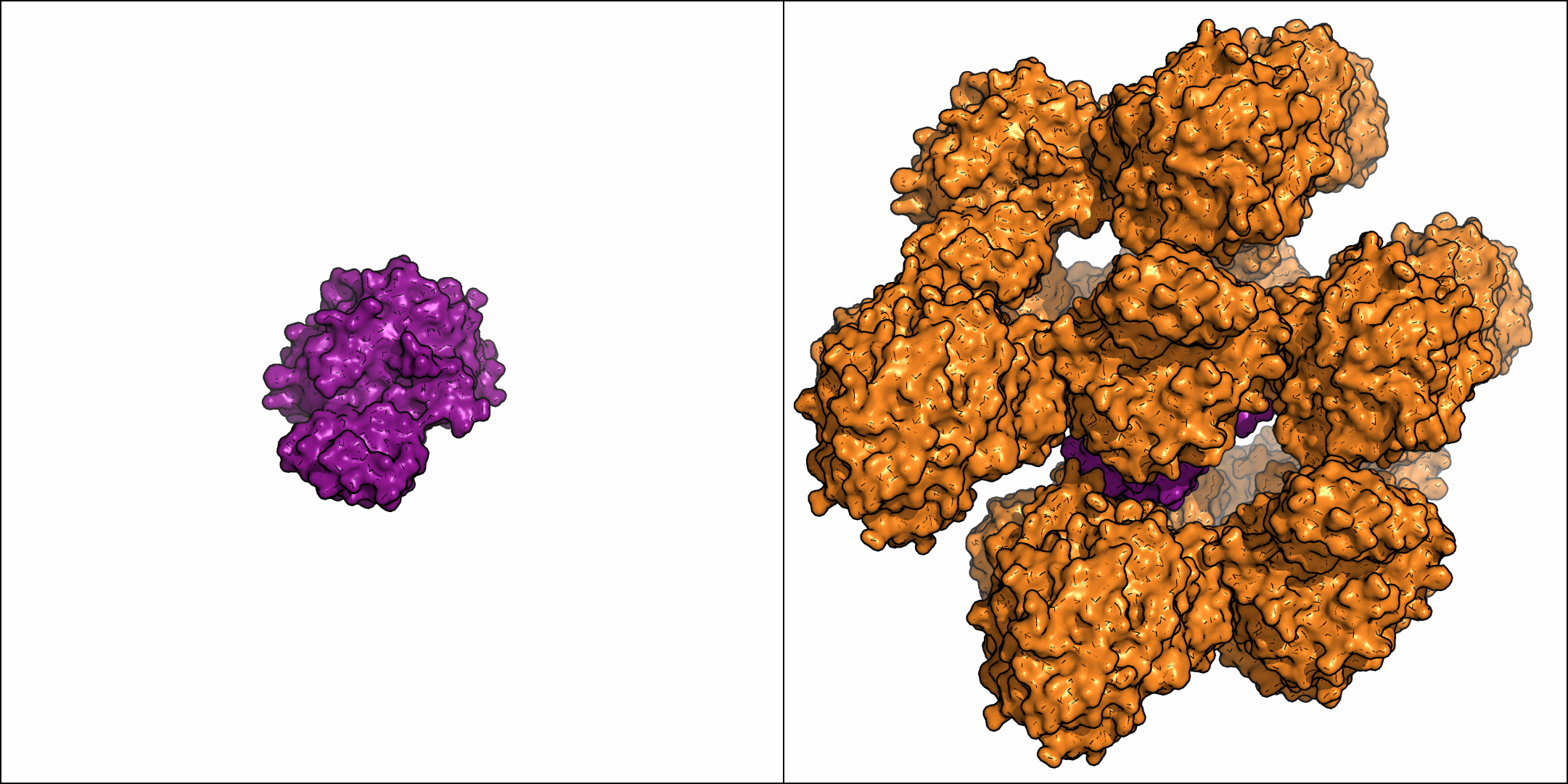 Рисунок 2. Молекулы белков соседних ячеек. Для наглядности, слева
показано место расположения исходной асимметрической единицы.
Рисунок 2. Молекулы белков соседних ячеек. Для наглядности, слева
показано место расположения исходной асимметрической единицы.
Анализ внутрикристаллических контактов
Были выялены взаимодействия между белками соседних ячеек, с помощью команд symexp, byres и distance:
symexp sym, 4h4f, all, 5
select protein, byres (4h4f within 3.5 of sym*)
select neigbors, byres (sym* within 3.5 of 4h4f)
distance hydrogen_bonds, protein, neighbors, 3.5
На рисунке 3 видна обшая картина взаимодействия исходного белка с соседствующими молекулами:
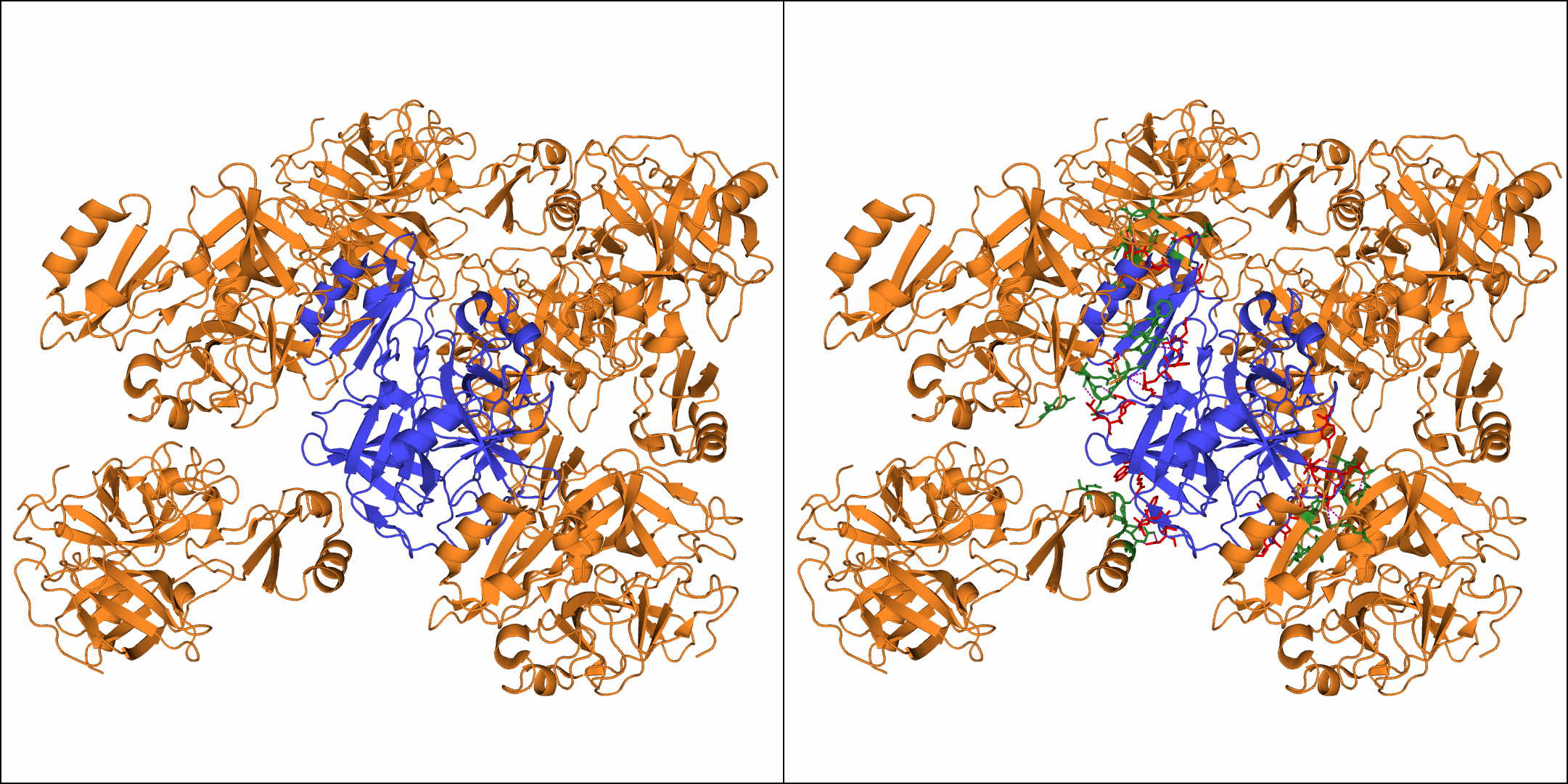 Рисунок 3. Слева – соседствующие молекулы белков. Справа – взаимодействия между соседними
молекулами белков. Боковые цепи взаимодействующих аминокислотных остатков исходного белка отмечены красным оттенком, соседних молекул – зеленым.
Рисунок 3. Слева – соседствующие молекулы белков. Справа – взаимодействия между соседними
молекулами белков. Боковые цепи взаимодействующих аминокислотных остатков исходного белка отмечены красным оттенком, соседних молекул – зеленым.
На рисунке 4 проиллюстрированы шесть зон контакта исходного белка с его соседями:
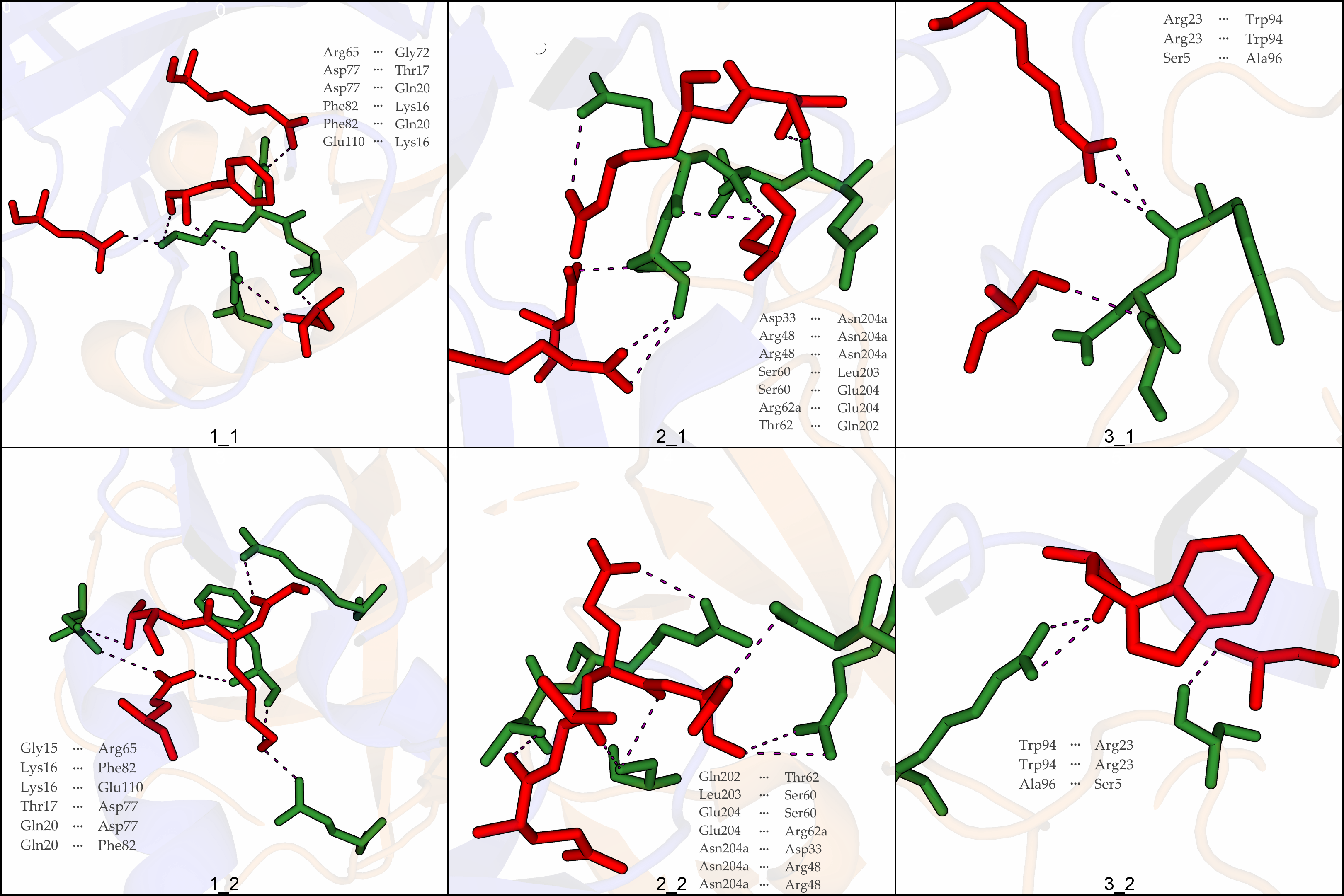 Рисунок 4. Зоны контакта между соседними ячейками. Приведены трюхбуквенные
обозначения и номера аминокислотных остатков, образующие водородные связи соответственно между исходным белком и его соседями.
Боковые цепи взаимодействующих аминокислотных остатков исходного белка отмечены красным оттенком, соседних молекул – зеленым.
Водородные связи обозначены фиолетовым фиолтовой пунктироной линией.
Рисунок 4. Зоны контакта между соседними ячейками. Приведены трюхбуквенные
обозначения и номера аминокислотных остатков, образующие водородные связи соответственно между исходным белком и его соседями.
Боковые цепи взаимодействующих аминокислотных остатков исходного белка отмечены красным оттенком, соседних молекул – зеленым.
Водородные связи обозначены фиолетовым фиолтовой пунктироной линией.
При рассмотрении водородных взаимодействий и их сопоставлением между верхни и нижним рядом изображений на рисунке 4 можно заметить, что ярко проявляется симметрия структуры. Все водородные связи, кроме Arg65-Gly72 (1_1) и Gly15-Arg65 (1_2), имеют свою симметрию.
Вывод
Анализ взаимодействий белка с соседствующими в кристалле молекулами позволяет получить более полное представление о структуре. Рассмотрение и визуализация этих контактов для структуры 4H4F позволили продемонстрировать свойство симметрии в кристалле, а также получить представление о взаимодействии молекул соседних ячеек.
Структура ДНК-белкового комплекса 3HDD
С помощью PyMOL было построено изображение структуры ДНК-белкового комплекса (PDB ID: 3HDD). Белок, связанный с ДНК, представляет собой гомедоменный транскрипционный фактор Engrailed, который принимает участие в сегментации во время эмбриогенеза дрозофилы. Гомеодомен – это тип белковой укладки (фолд), который представлет собой структуру "спираль-поворот-спираль" из 60 аминокислотных остатков. Эта уладка состит из трех соединенных между собой короткими петлями альфа-спиралей, одна из которых связывает консервативный сайт TAAT (рис.5):
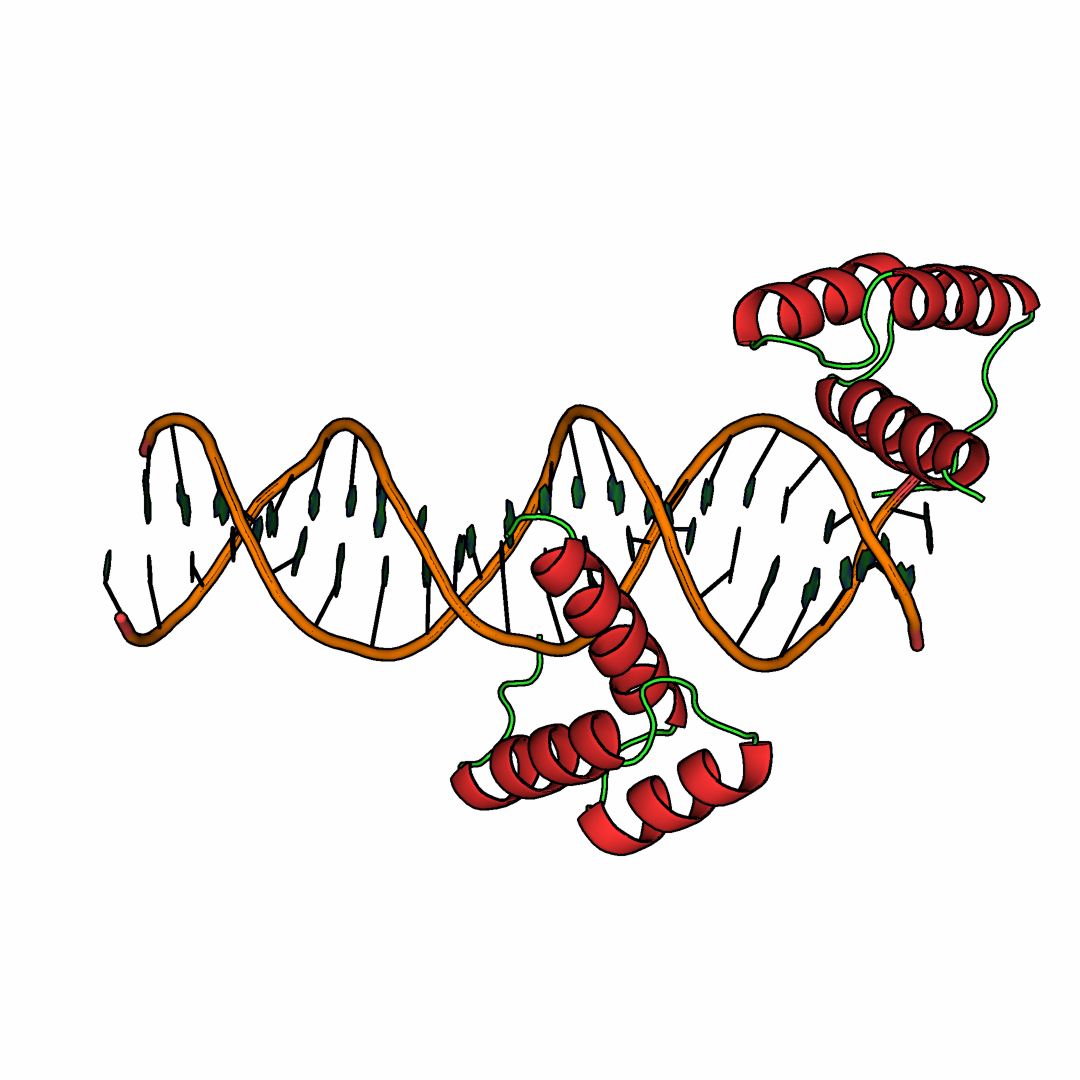 Рисунок 5. Асимметрическая единица. Раскраска белков по вторичным структурам.
Рисунок 5. Асимметрическая единица. Раскраска белков по вторичным структурам.
Но самое интересное заключается в том, что белок (цепь B структуры 3HDD) в асимметрической единице локализуется на конце спирали ДНК, что само по себе представляется странным. Если рассматривать вопрос более глубоко, то данный белок Engrailed был синтезирован в клетках E.coli и отличается от дикого типа заменой лизина в положении 50 на глутамин, что делает его высокоспецифичным к последовательности TAATTA. Однако в работе для кристаллизации использовалася дуплекс ДНК, который содержит только один сайт связывания TAAT (рис.6):
 Рисунок 6. Дуплекс ДНК, использванный для кокристаллизации с гомеодоменом в работах К. Пабо [1],
[2].
Рисунок 6. Дуплекс ДНК, использванный для кокристаллизации с гомеодоменом в работах К. Пабо [1],
[2].
Однако если восстановить соседнюю с этой белковой цепью ячейку (рис. 7), то такое странное расположение белка легко объяснить. Дело в том, что дупелкс ДНК на обоих концах имеет липкие концы, а при визуализации водородных связей видно, что, например, "выступающий" аденин ДНК-спирали исходной ячейки образует Уотсон-Криковскую пару с "выступающим" тимином ДНК-спирали соседней ячейки (рис.9). Для построения соседних асимметрических единиц и отображения взаимодействий между молекулами соседних ячеек использованы в PyMOL применялись команда команды symexp, byres и distance (см. выше).
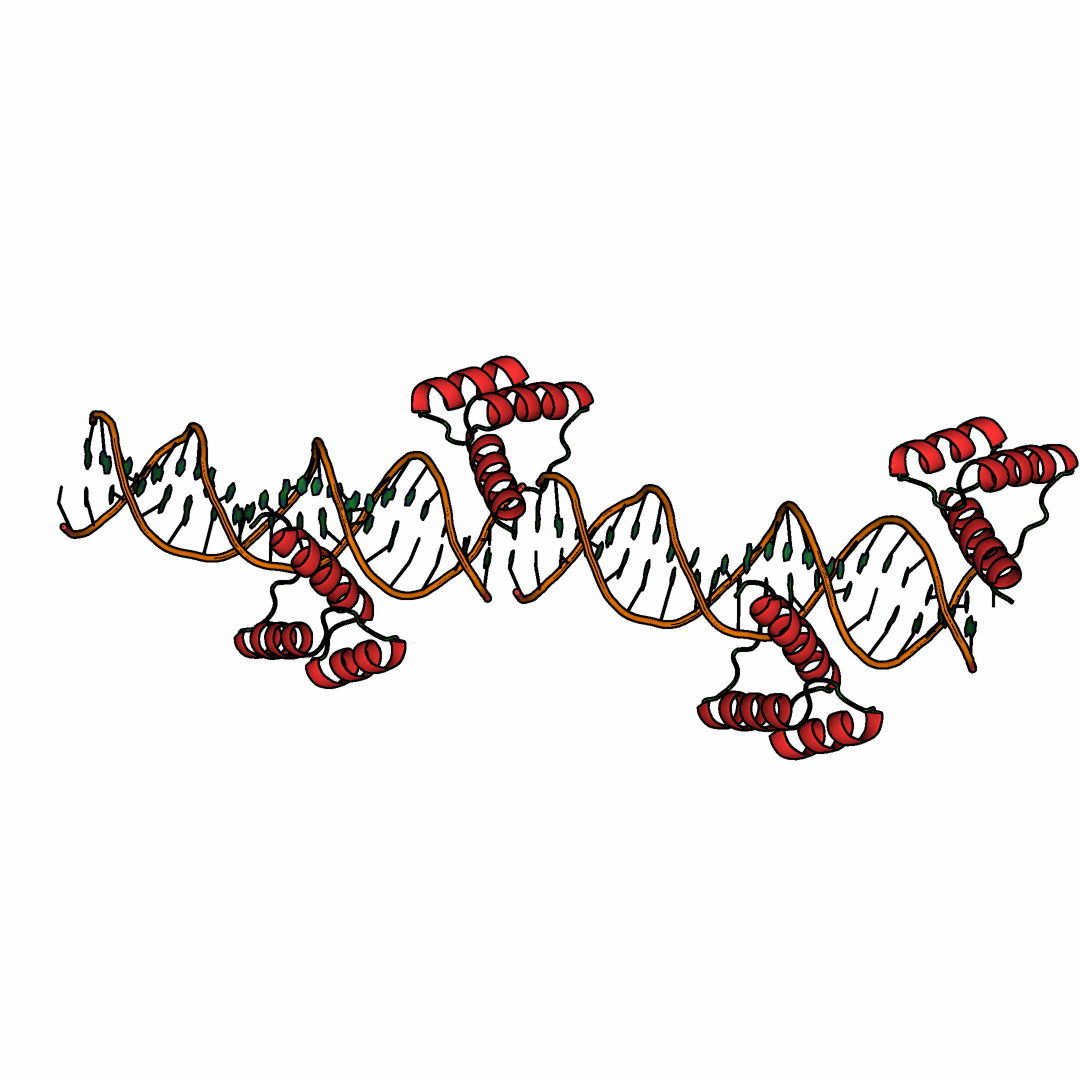 Рисунок 7. ДНК-белковый комплекс 3HDD с восстановленной справа кристаллической ячейкой.
Рисунок 7. ДНК-белковый комплекс 3HDD с восстановленной справа кристаллической ячейкой.
На нижеследующих изображениях проиллюстрировано то, как гомедомен взаимодействует с ДНК исходной асимметрической единицы (рис.8), с ДНК восстановленной асимметрической единицы (рис. 10) и то, как ДНК дуплексы взаимодействуют между собой (рис.9):
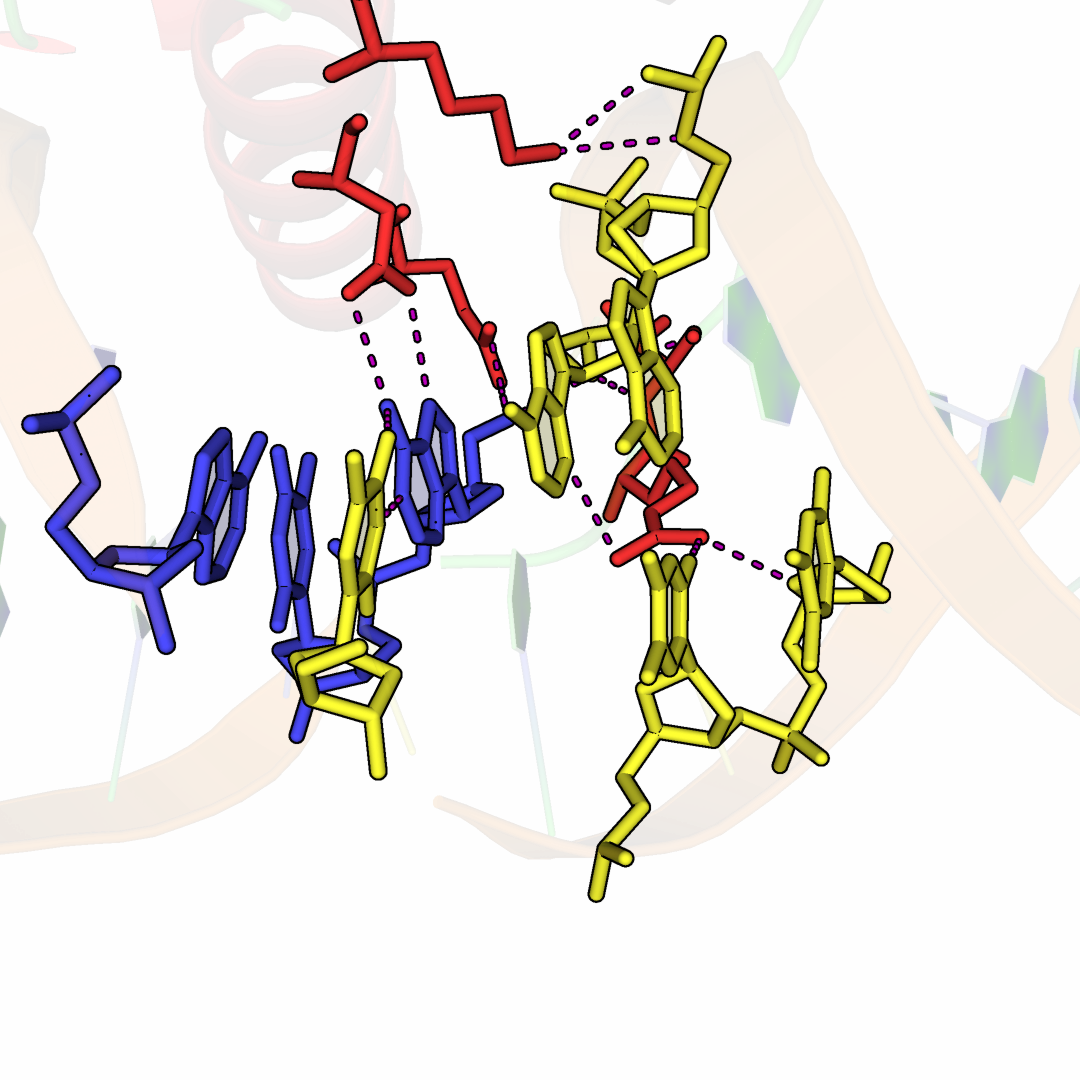 Рисунок 8.Область контакта цепи B белка с двумя молекулами ДНК комплекса 3HDD.
Боковые цепи белка отмечены красным, нуклеотиды ДНК-дуплекса исходной ячейки отмечены синим, а восстановленной – желтым. Водородные
связи отмечены фиолетовым цветом.
Рисунок 8.Область контакта цепи B белка с двумя молекулами ДНК комплекса 3HDD.
Боковые цепи белка отмечены красным, нуклеотиды ДНК-дуплекса исходной ячейки отмечены синим, а восстановленной – желтым. Водородные
связи отмечены фиолетовым цветом.
На рисунке 9 изображена область взаимодействия ДНК-дуплексов из соседних ячеек. Видно, что между "выступающими" основаниями A и T образованы две водродные связи (Уотсон-Криковская пара), а также легко можно заметить, что основания ДНК-спиралей образуют стекинг взаимодействия.
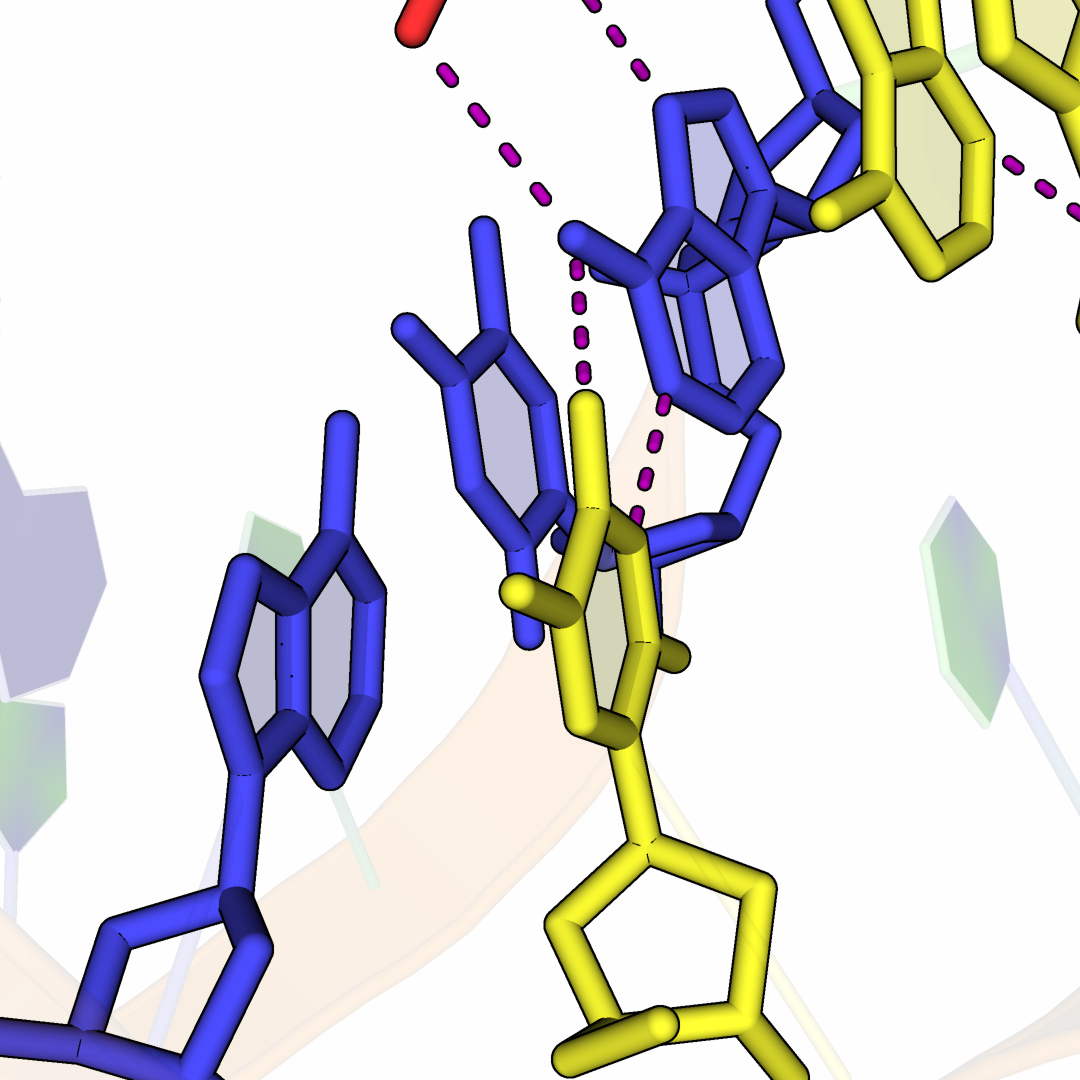 Рисунок 9.Область контакта молекул ДНК двух асимметрических единиц.
Нуклеотиды ДНК-дуплекса исходной ячейки отмечены синим, а восстановленной – желтым. Водородные
связи отмечены фиолетовым цветом.
Рисунок 9.Область контакта молекул ДНК двух асимметрических единиц.
Нуклеотиды ДНК-дуплекса исходной ячейки отмечены синим, а восстановленной – желтым. Водородные
связи отмечены фиолетовым цветом.
На рисунке 10 видно то, как боковые цепи гомеодомена образуют водородные взаимодействия с ДНК-дуплексом восстановленной асимметрической единицы.
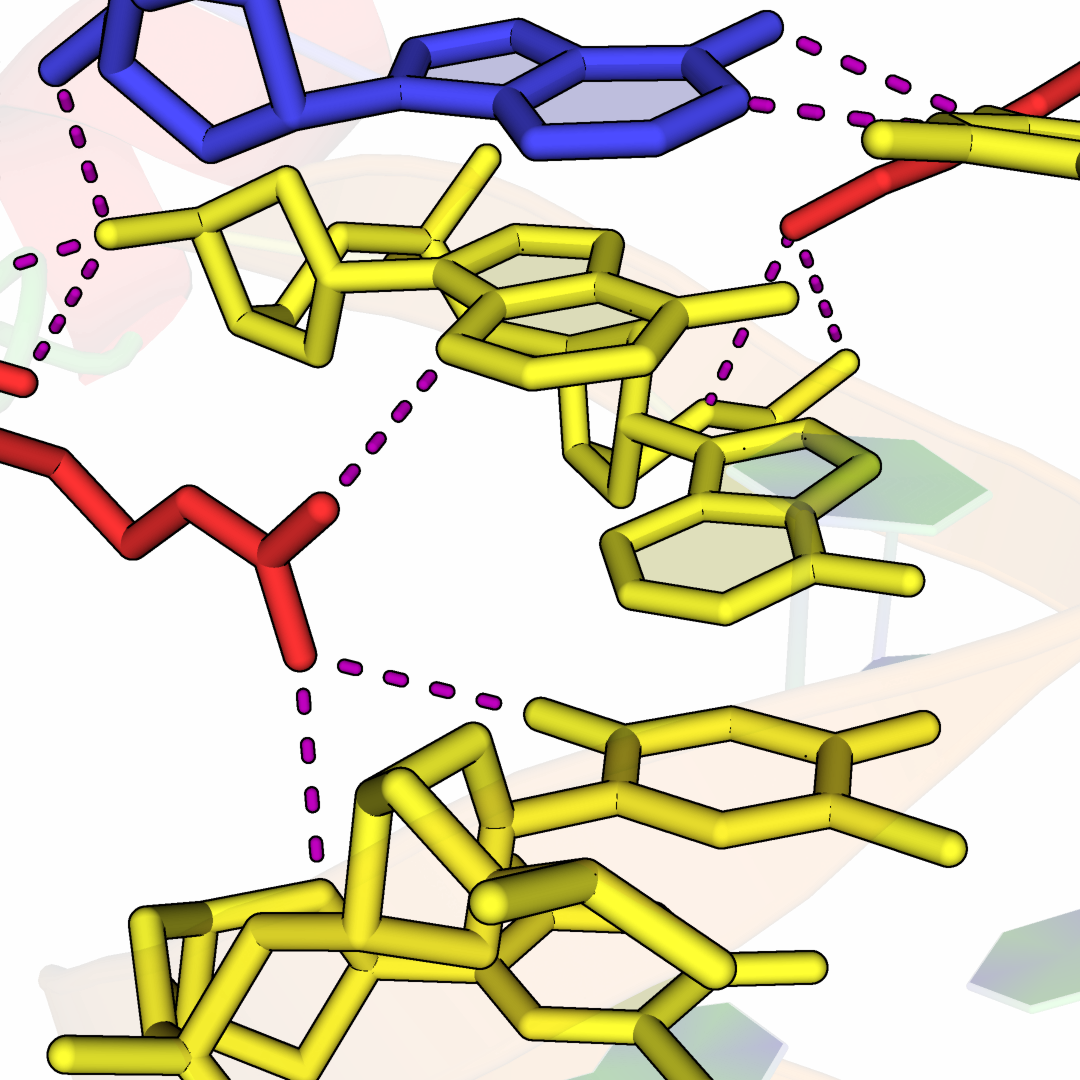 Рисунок 10.Область контакта цепи B белка с молекулой ДНК восстановленной
асимметрической единицы. Боковые цепи белка отмечены красным, нуклеотиды ДНК-дуплекса – желтым цветом. Водородные
связи отмечены фиолетовым цветом.
Рисунок 10.Область контакта цепи B белка с молекулой ДНК восстановленной
асимметрической единицы. Боковые цепи белка отмечены красным, нуклеотиды ДНК-дуплекса – желтым цветом. Водородные
связи отмечены фиолетовым цветом.
Вывод
Как видно на примере структуры 3HDD, одной асимметрической единицы не всегда достаточно для анализа структуры. Именно визуализация молекулы ДНК соседней ячейки кристалла и выявление контактов белка с ДНК позволили объяснить странное, на первый взгляд, положение цепи B белка, находящейся «на краю» двойной спирали ДНК асимметрической единицы.
Ссылки
1. ↑ Kissinger CR, Liu B, Martin-blanco E, Kornberg TB, Pabo C. Crystal Structure of an engrailed Homeodomain-DNA Complex at 2.8 A Resolution: A Framework for Understanding Homeodomain-DNA Interactions. Cell. 1990;63:579-590. doi:10.1016/0092-8674(90)90453-L.2. ↑Fraenkel E, Rould M a, Chambers K a, Pabo CO. Engrailed homeodomain-DNA complex at 2.2 A resolution: a detailed view of the interface and comparison with other engrailed structures. J Mol Biol. 1998;284:351-61. doi:10.1006/jmbi.1998.2147.