| ФББ МГУ | Корень | Обо мне | Семестры |
Рентгеноструктурный анализ
Построение и анализ поверхностей в PyMOL
Текст задания: поверхности белков в PyMOL.
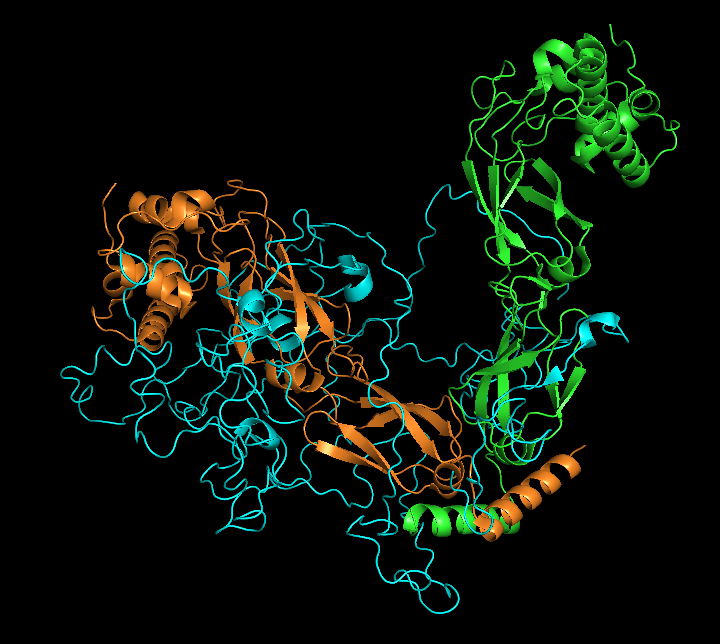
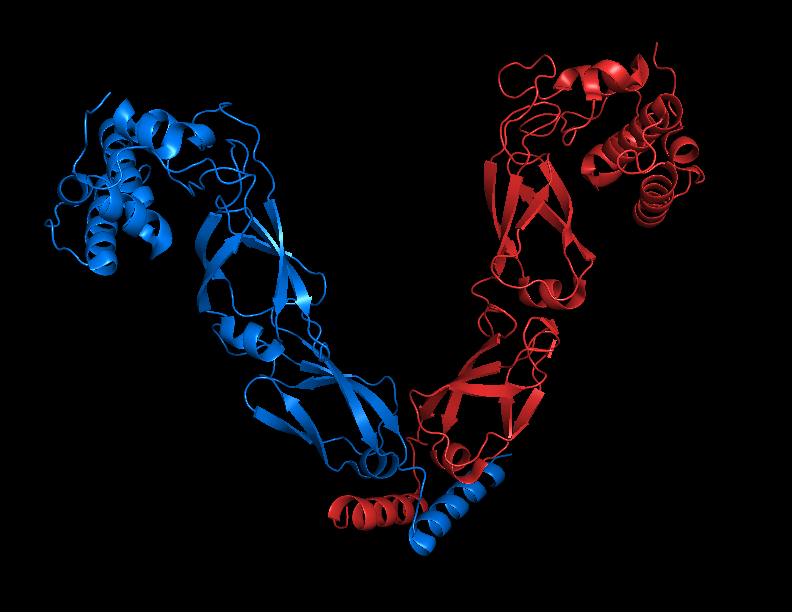
Для анализа была выбрана структура шаперона Hsp40 под названием "Structural Basis for Client Recognition and Activity of Hsp40 Chaperones" (PDB ID: 6PSI).
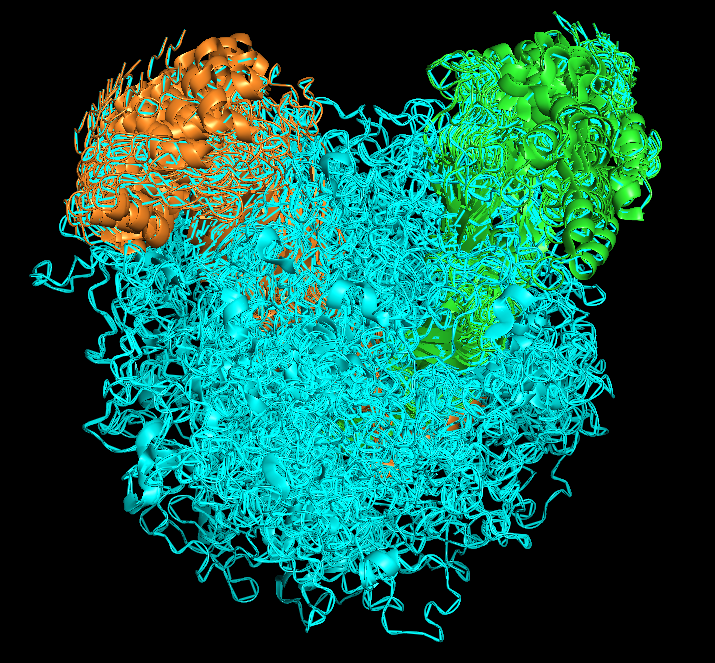
Эта структура получена методом Solution NMR, она содержит 20 ЯМР-моделей (всего рассчитанно 100 моделей) (см рисунок 1.2), сам белок является гетеротримером (см рисунок 1.1).
Визуализация всех моделей ЯМР на одном поле осуществляется с помощью команды "split_states all", объединение - "join_states all".
 |
 |
Визуализация поверхности
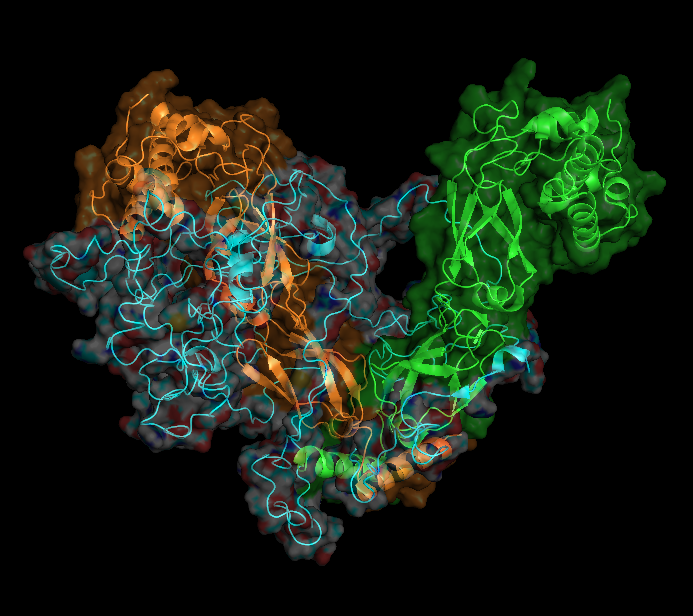
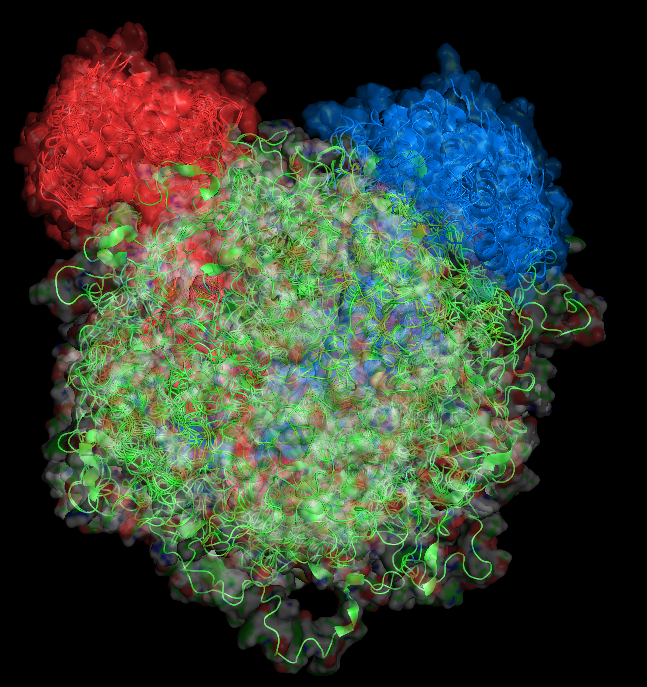
На рисунках ниже показаны поверхности обобщенной модели белка (рисунок 2.1) и всех моделей одновременно (рисунок 2.2). Цепи покрашены в разные цвета. Структура белка представлена в виде cartoon, прозрачность поверхности 0.55 (set transparency, 0.55).
 |
 |
Рассчет молекулярной поверхности (MS) и поверхности, доступной растворителю (SAS)
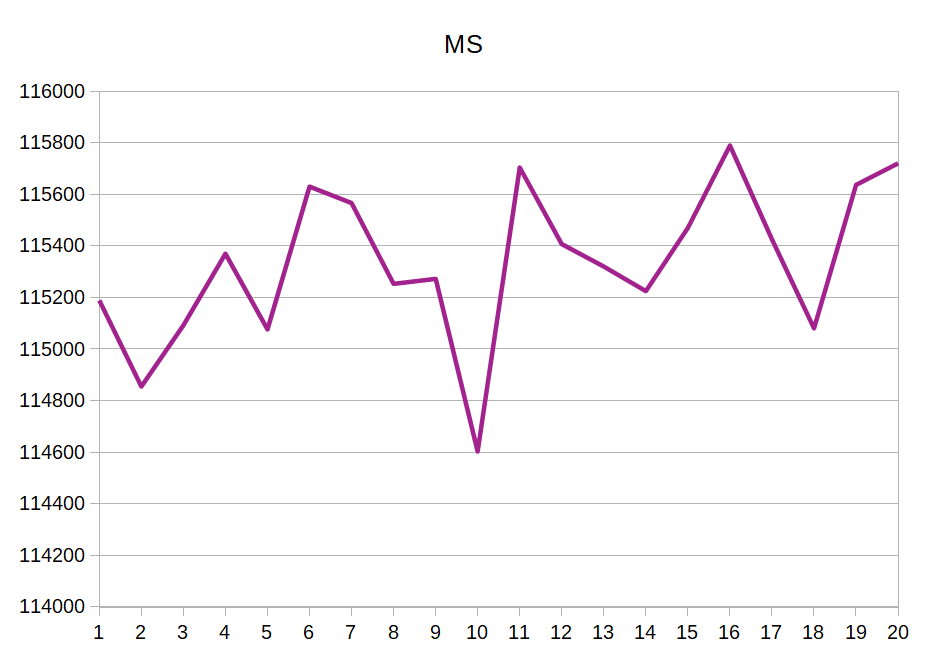
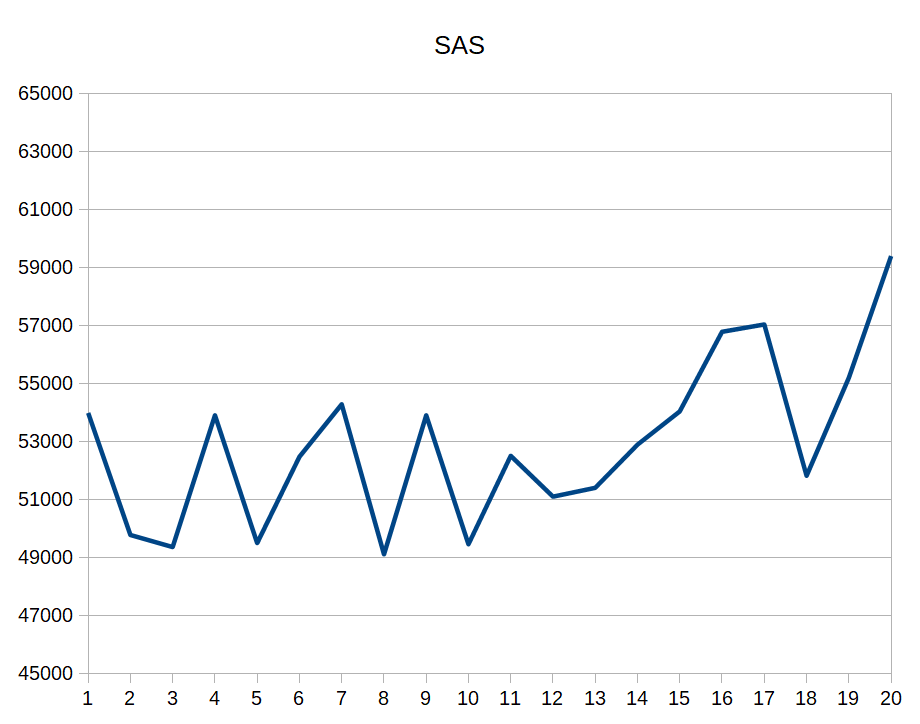
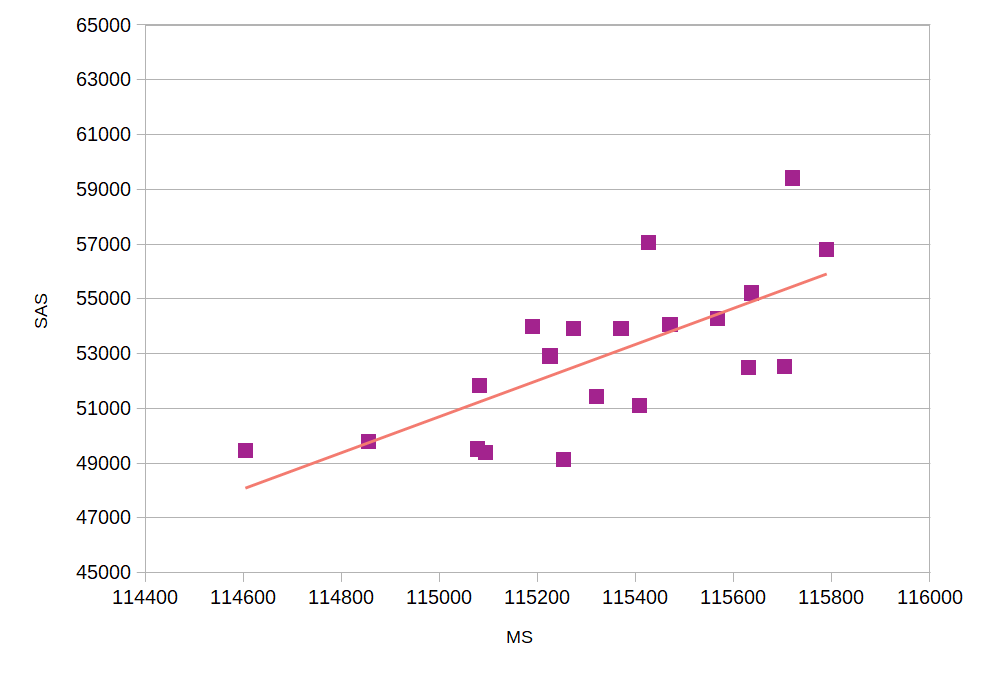
Для рассчета MS и SAS используются команды, представленные ниже. Также ниже я привела графики значений MS и SAS для каждой модели (рисунки 3.1-3.2), итоговый график зависимости SAS от MS (рисунок 4) и данные в excel-таблице: MS_SAS_data.xls.
set dot_solvent, 0 // MS get_area 6PSI_0001 // MS ... get_area 6PSI_0020 // MS set dot_solvent, 1 // SAS get_area 6PSI_0001 // SAS ... get_area 6PSI_0020 // SAS
По графикам видно, что разброс площадей поверхностей не очень существенный, но явно есть.
В идеальной ситуации, насколько я понимаю, мы должны увидеть прямую линию на графиках 3.1-3.2, а такой разброс свидетельствует о том, что модели довольно далеки друг от друга по своей структуре
(что заметно по "клубку" на рисунке 1.2). Это говорит о том, что обобщенная ЯМР-модель, возможно, весьма приблизительна, и в реальной структуре белок может быть устроен совсем иначе.
Что касается зависимости MS от SAS, площадь поверхности, доступная растворителю, в целом растет с увеличением молекулярной площади поверхности.
 |
 |
Остатки, отвечающие за межцепочечные контакты
Выбор остатков, отвечающих за межцепочечные контакты, производился через определение множества остатков, находящихся во взаимном 3Å-ном окружении цепей.
Я попробовала сделать это тремя разными способами. Первый - работать с обобщенной моделью (см код ниже).
create aa, byres chain A and (chain C around 3) create cc, byres chain C and (chain A around 3) show surface, aa show surface, cc set transparency, 0.55
Второй - работать с одной из ЯМР-моделей (см код ниже), например, первой по списку (6PSI_0001).
split_states all create aa, byres chain A and 6PSI_0001 and (chain C around 3) create cc, byres chain C and 6PSI_0001 and (chain A around 3) show surface, aa show surface, cc set transparency, 0.55
И наконец, я использовала команду extract (для обобщенной модели), чтобы сравнить поверхности контактов, которые получаются при рассмотрении олигомера целиком и цепей по-отдельности (см код ниже).
join_states all extract A, chain A extract C, chain C create AA, byres A and (C around 3) create CC, byres C and (A around 3) show surface, AA show surface, CC
Раз уж я выбрала для этого практикума тример, я решила сравнить попарно контакты между всеми тремя цепями (см рисунки 5.1-5.3).
 |
 |
 |
Опыт оказался довольно интересным, так как цепи А и С сильно более структурированы, чем цепь В. Видимо из-за этого контакты между цепями А и С выглядели примерно одинаково при визуализации и на обобщенной модели, и на одной ЯМР-модели, а вот контакты между А и В и В и С выглядят по-разному (рисунки 7.1-8.4).
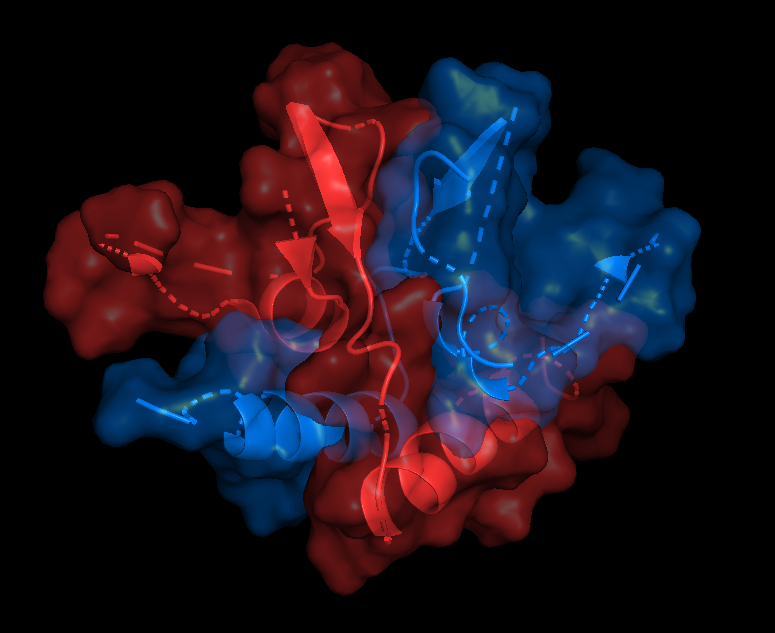
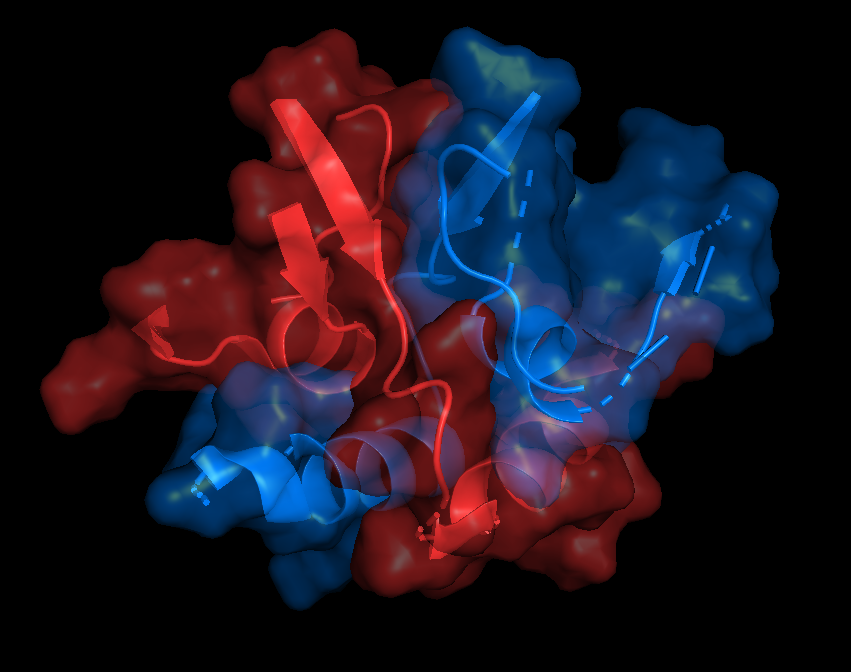
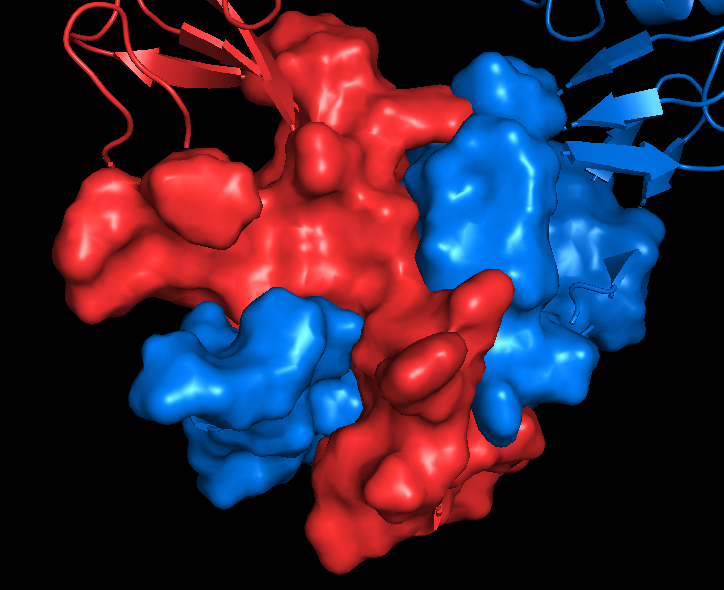
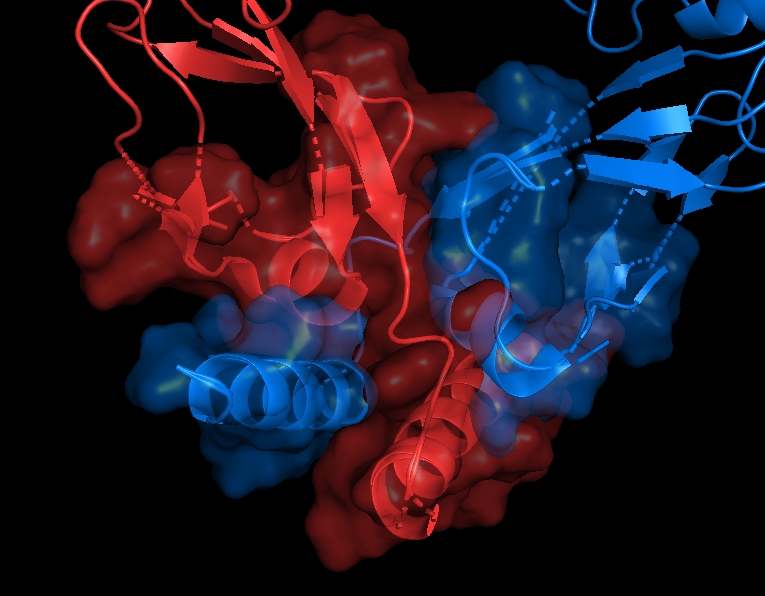
На русунках 6.1-6.6 показана поверхность контактов между цепями А и С. Как я писала выше, вид поверхности контактов практически не отличается при работе с обобщенной моделью (6.1-6.2) и отдельной ЯМР-структурой (6.3-6.4). Разделение цепей, на мой взгляд, тоже не вносит никакого вклада (6.5-6.6), разве что поверхность более явно повторяет форму вторичной структуры, то есть как бы "облегает" ее, но это не точно. Я бы сказала, что разницы все-таки нет.
| Chain A - red Chain C - tv_blue |
||
Показаны только остатки, входящие в зону контакта |
 |
 |
Показаны только остатки, входящие в зону контакта |
 |
 |
 |
 |
|
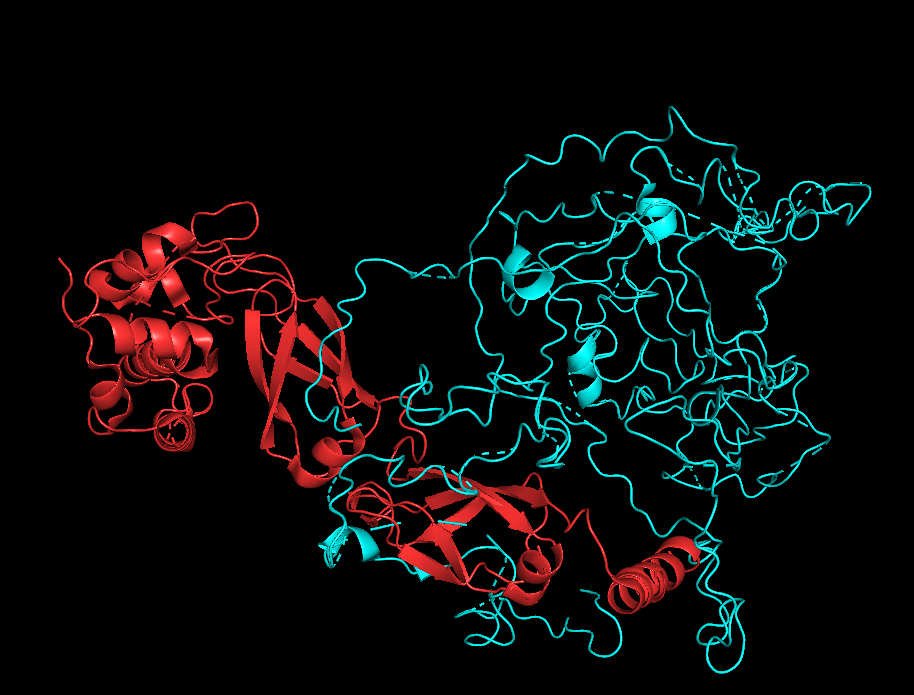
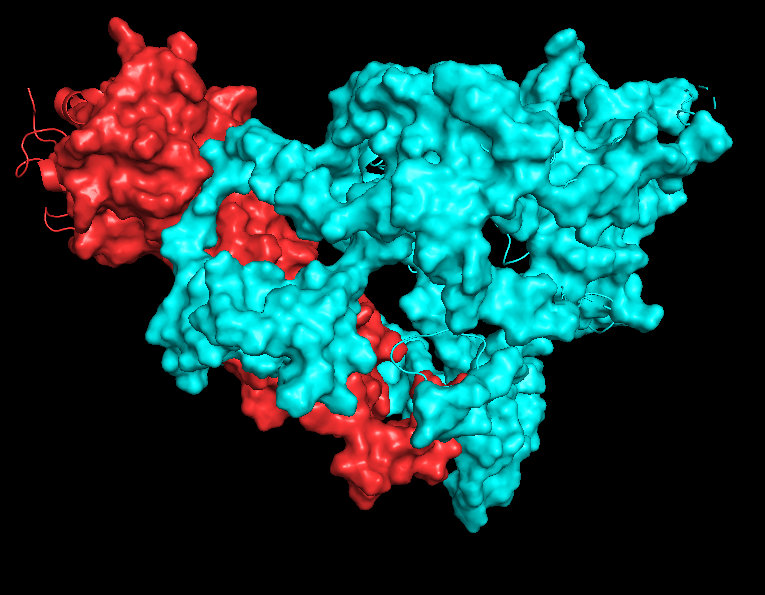
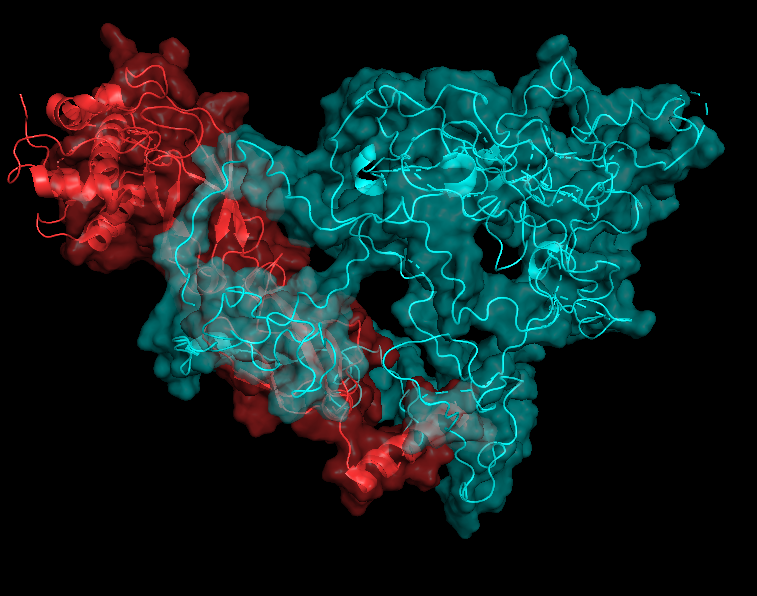
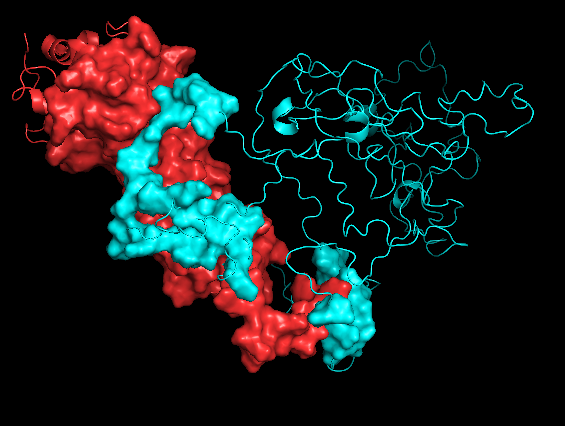
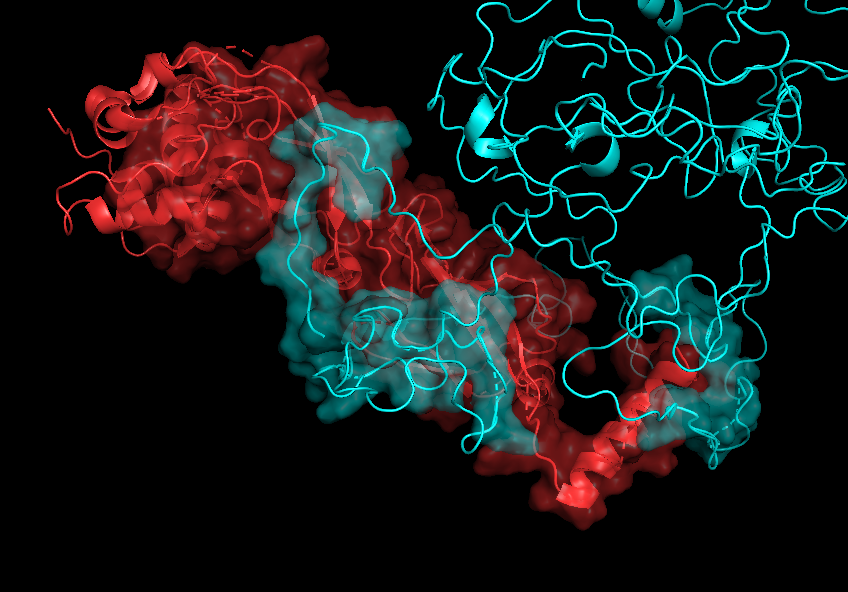
Что касается контактов между цепями А и В и В и С, то, как можно видеть на рисунках 7.1-7.2 и 8.1-8.2, при работе с обобщенной моделью, PyMOL, видимо, рассчитывает окружение цепи для всех 20 структур сразу и эта "площадь контакта" получается огромной. Если при этом взять одну структуру, то картинка получается сильно более адекватной, но эта картинка должна очень зависеть от того, какую именно структуру выбрать (см рисукни 7.3-7.4 и 8.3-8.4).
На рисунках 7.1-7.4 представлена поверхность контакта между цепями А и В.
| Chain A - red Chain B - cyan |
||
 |
 |
|
 |
 |
|
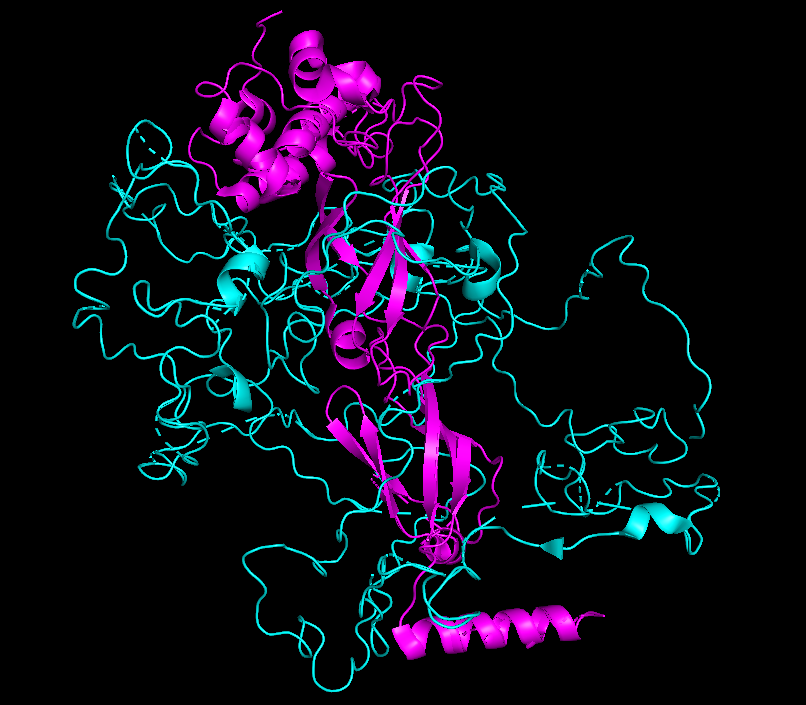
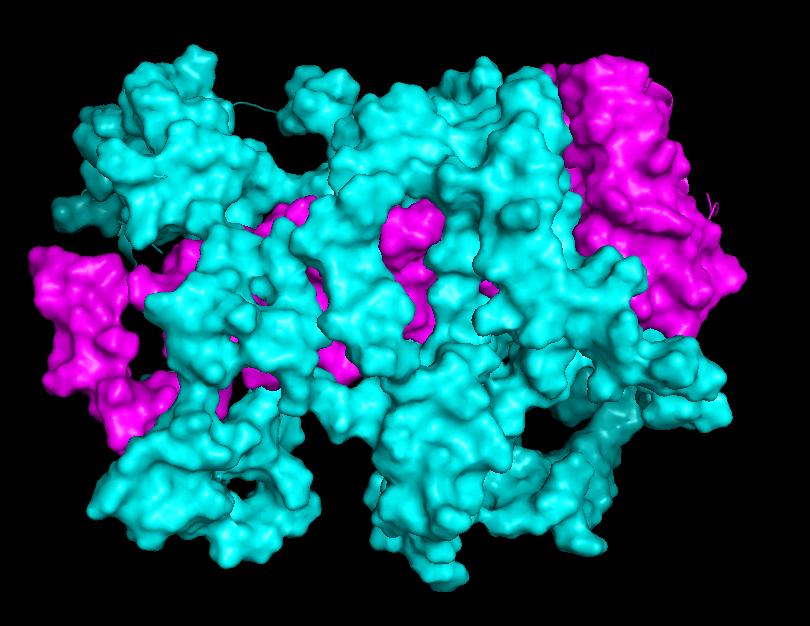
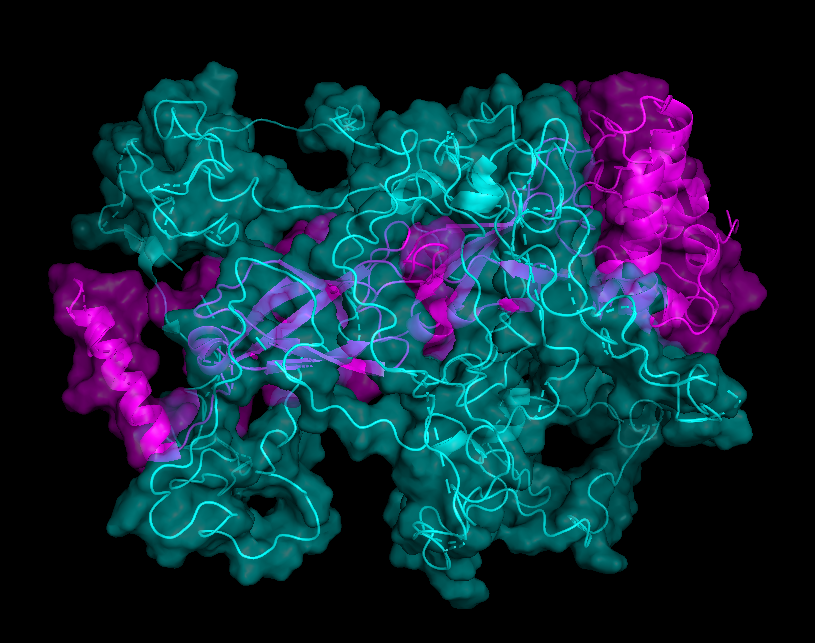
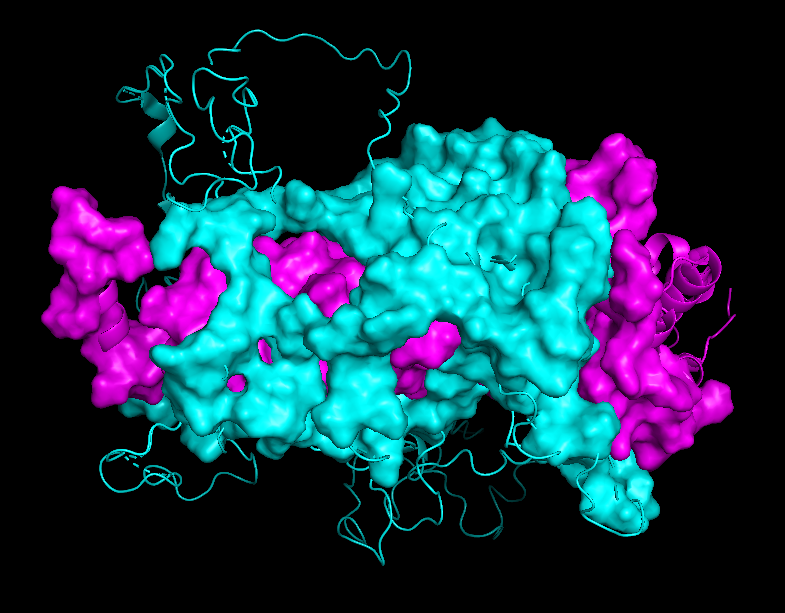
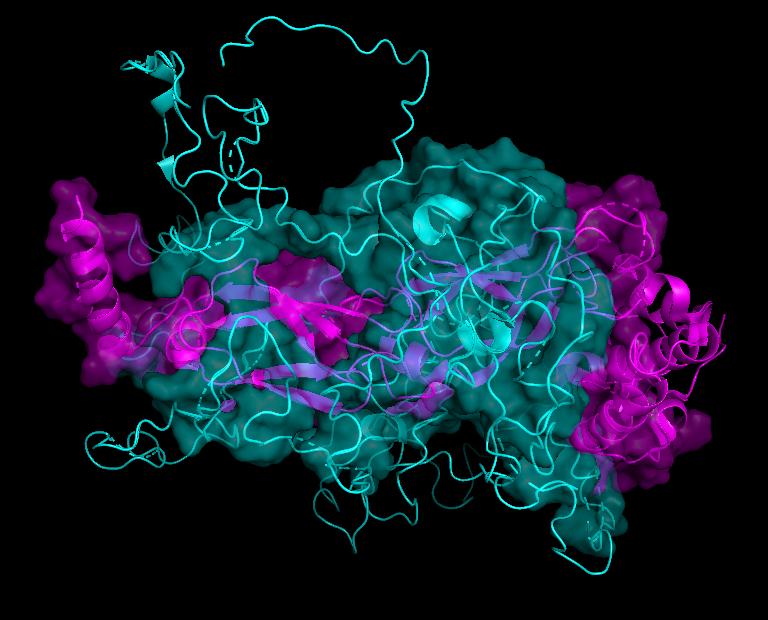
На рисунках 8.1-8.4 представлена поверхность контакта между цепями А и С. Еще раз хочу обратить внимание на то, что размеры контактирующих поверхностей сильно отличаются при рассчете по обобщенной модели (8.1-8.2) и отдельно взятой ЯМР-модели (8.3-8.4)
| Chain B - cyan Chain C - magenta |
||
 |
 |
|
 |
 |
|
| Семестр 7 |
© Дарья Потанина, 2020