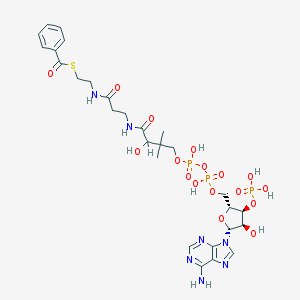
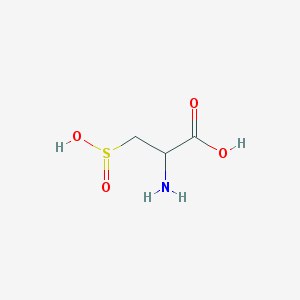
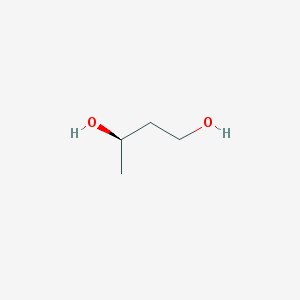
Наш объект - комплекс бифенил синтазы и бензоил Ко-А, кристаллическая структура которого была выделена из Яблони домашней и исследована методами рентгеноструктурного анализа.
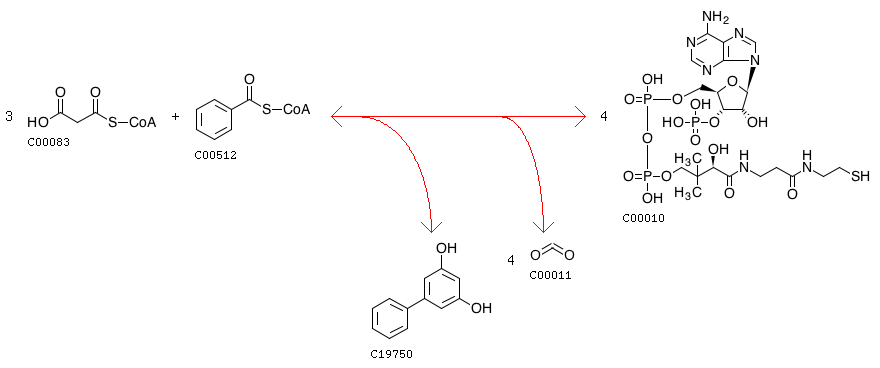
Точное название - 3,5-дигидроксибифенил синтаза, сокращенно - BIS1. Как можно догадаться, BIS1 синтезирует бифенил, который служит растению защитным метаболитом (например, он подавляет рост грибов, а схожие соединения используются людьми в качестве инсектицидов). Проводимая реакция выглядит так:
Рисунок 1. Реакция синтеза бифенила.
Бифенил синтаза - это гомодимер, имеющий циклическую симметрию (то есть мономеры совмещаяются друг с другом поворотом вокруг оси на полоборота). Каждый мономер имеет свой активный центр, в котором происходит взаимодействие с лигандами - бензоилом-КоА, спиртом (бутан-1,3-диолом) и 3-сульфиноаланином. Каждый мономер состоит из одной цепи и имеет во вторичной структуре альфа-спирали (снаружи) и бета-тяжи (ближе к гидрофобному ядру). Белок не очень большой: его масса чуть меньше 90 кДа, длины цепей - 390 остатков.
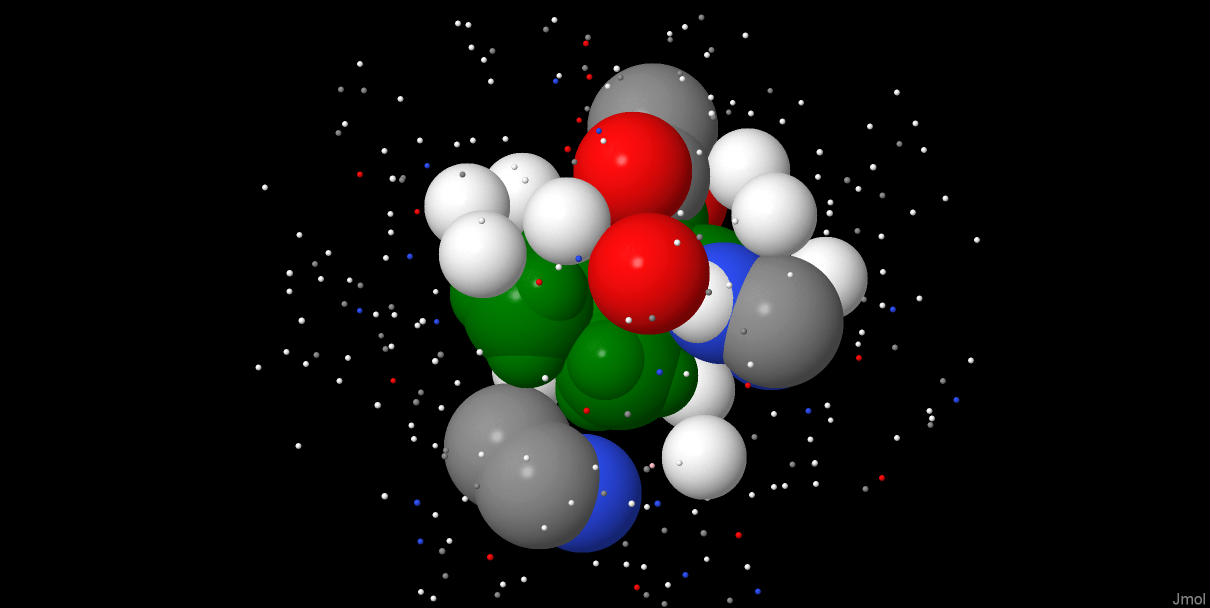
Идентификатор PDB - 5WC4, идентификатор UniProt - K9MST3. Внизу страницы есть ссылки на базы данных.Таблица 1. Описание лигандов бифенил синтазы.
| Название лиганда в pdb-файле | Название лиганда по IUPAC | Химическая формула | Молярная масса (г/моль) | Идентификатор PubChem |
| CSD = 3- SULFINOALANINE | 2-amino-3-sulfinopropanoic acid | C3H7NO4S | 153.152 | 109 |
| BU4 = (3R)-BUTANE-1,3-DIOL | (3R)-butane-1,3-diol | C4H10O2 | 90.122 | 637497 |
| BYC = BENZOYL COENZYME A | S-[2-[3-[[4-[[[(2R,3S,4R,5R)-5-(6-aminopurin-9-yl)-4-hydroxy-3-phosphonooxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl]oxy-2-hydroxy-3,3-dimethylbutanoyl]amino]propanoylamino]ethyl] benzenecarbothioate | C28H40N7O17P3S | 871.641 | 439248 |
Таблица 2. Формулы лигандов бифенил синтазы.
| Бензоил-КоА | Сульфоаланин | Бутандиол |
 |  |  |
Рисунок 2. Лиганды в шариково-стержневой модели (апплет с лигандами представлен ниже).
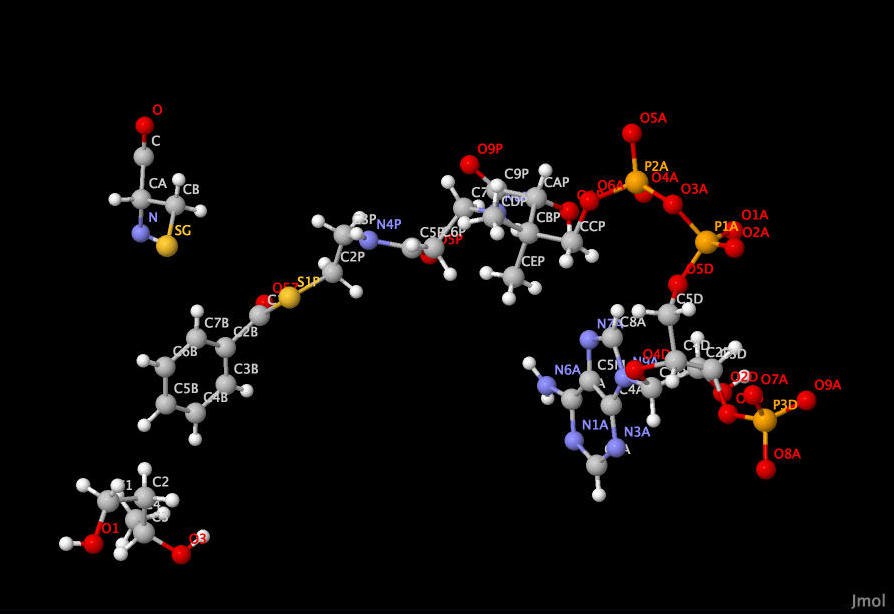
Рисунок 3. Симметричная структура, обеспечивающая эффективное взаимодействие цепей посредством водороднвх связей.

Водородные связи
Мною было использовано два различных способа поиска водородных связей.
Способ А
Водородные связи в частности могут образовываться между радикалами отрицательно заряженных аминокислот (аспартата и глутамата), которые могут выступать в качестве акцепторов водородной связи, и радикалами аспарагина и глутамина, которые могут выступить как доноры водородной связи, а так же возможна ситуация, когда положительно заряженные радикалы выступают в качестве донора, а аспарагин или глутамин в качестве акцептора водородной связи. Таким образом поиск был нацелен на находящиеся достаточно близко для формирования водородной связи радикалы вышеперечисленых аминокислот (одна из которых выступает в качестве донора в.с., а вторая в качестве акцептора), при этом одна аминокислота должна принадлежать цепи X, а вторая – цепи Y. (имеется ввиду, что цепи должны быть разными, а не конкретные названия цепей).
Способ В
Второй способ берет за основу некоторое допущение, предполагающее, что азот белковой молекулы почти всегда может выступать в качестве донора водородной связи а кислород почти всегда может выступать в качестве акцептора оной. Поэтому поиск был нацелен на находящиеся достаточно близко для формирования водородной связи азот цепи X и кислород цепи Y.
Оба способа предполагают некоторое количество «побочных продуктов» в виде неправильно сориентированных в пространстве радикалов, в то же время находящихся достаточно близко для формирования водородной связи или водородных связей между атомами одной цепи, но оба способа позволяют существенно сократить выборку аминокислот, взаимодействия между которыми нужно рассмотреть.
Водородные связи между цепями включают в себя все три возможных типа взаимодействий радикал – радикал, например [ASN]175:A – [GLU]174:B, радикал – остов, например [ARG]151:A и [ARG]167:B, и остов – остов, например [ALA]251:A – [MET]132:B. Судя по всему водородные связи вносят значительный вклад в понижение энергии взаимодействия между двумя белковыми цепями за счет того, что их довольно много, они довольно короткие, и они почти равномерно распределены по краю поверхности взаимодействия двух цепей. Важно упомянуть, что большая часть аминокислот участвующих в формировании водородных связей все-таки находится ближе к периферии поверхности контакта двух цепей, т.к. центральную часть занимает гидрофобное ядро. В процессе поиска взаимодействия цепей посредством водородных связей была обнаружена интересная структура, симметричная относительно цепей и содержащая много взаимодействий этого типа (представлена на рис 3).
Солевые мостики
Процедура поиска солевых мостиков заключалась в поиске радикалов аминокислот, имеющих противоположный заряд и находящихся при этом на разных цепях на расстоянии не более, чем 5 ангстрем. Многие радикалы аминокислот, участвующих в ионных взаимодействиях были выкристаллизованы в нескольких состояниях, что могло создать препятствия при изучении этого типа взаимодействий, поэтому в апплете продемонстрировано только одно из нескольких возможных положений радикала в пространстве. Пунктирные линии, демонстрирующие ионные взаимодействия проводились от атома несущего отрицательный заряд к ближайшему положительно заряженному атому.
Солевые мостики расположены по периферии поверхности взаимодействия двух белковых цепей, что довольно хорошо объясняется тем, что данный тип связи предполагает наличие гидрофильных заряженных радикалов, способных вступать во взаимодействие с растворителем. Стоит упомянуть что мной из рассмотрения были исключены два из найденных 6 солевых мостиков ([HIS]121:A – [ASP]171:B и[HIS]121:B – [ASP]171:A), так как гистидин, который должен участвовать в их формировании не протонирован ни в соответствии со структурой, ни в соответствии с pKa, которая у гистидина лежит в слабокислой области и составляет около 6,4. Остальные солевые мостики принадлежат всего двум типам [LYS]-[GLU] и [ASP]-[ARG]. При этом с аргинином взаимодействует два радикала аспартата, а с лизином только один глутаматный радикал. Все солевые мостики симметричны относительно цепей, как и другие типы взаимодействий, т.к. данный белок является гомодимером.
Гидрофобные взаимодействия
Поиск гидрофобных взаимодействий предполагал нахождение гидрофобных радикалов аминокислот, принадлежащих разным цепям, атомы которых находятся на расстоянии не более 5 ангстрем. Далее рассматривалось полярное окружение этой группы неполярных аминокислот, в частности рассматривалось окружение радикалами полярных аминокислот и окружение молекулами воды в радиусе 3 ангстрема, с целью понять, какие именно аминокислоты находятся в полностью неполярном окружении и могут служить центром гидрофобного взаимодействия. Также из первоначальной группы гидрофобных аминокислот удалялись те атомы, которые находились на расстоянии меньше 3,5 ангстрем от полярных атомов, таких как кислород или азот. Таким способом было выделено несколько аминокислот, радикалы которых находятся в наиболее гидрофобном окружении. Причем в качестве центра «ядра» гидрофобного взаимодействия мною не были выбраны ароматические аминокислоты (как это было предложено сделать), это можно объяснить тем, что гидрофобные взаимодействия на границе двух цепей в данном случае имеют довольно рыхлую структуру и гидрофобные радикалы не формируют крупных, четко выраженных конгломератов. Однако возможно выделить некрупные конгломераты, «центрами» которых можно выбрать гидрофобные аминокислоты с радикалами среднего размера, такие как метионин и изолейцин.
Гидрофобные взаимодействия в большей степени локализованы в центре области контакта двух цепей. У расположенных близко ароматических радикалов отсутствуют какие либо предпосылки для формирования стекинговых контактов. Т.к. в области контакта двух цепей отсутствуют крупные гидрофобные ядра можно предположить, что в данном белке гидрофобные взаимодействия довольно слабы и позволяют держать цепи вместе преимущественно за счет большого числа слабых взаимодействий.
Ковалентных связей между цепями в данном белке нет, так как нет дисульфидных мостиков.
Я ставила перед собой задачу сравнить плотность упаковки разных участков нашего белка - в глубине гидрофобного ядр а и на его поверхности (стыке с гидрофильными частями). По возможности хотелось также сравнить полученные цифр ы с результатами моих однокурсников, чтобы понять, насколько характерной является такая плотность упаковки, и сделать выводы о зависимости плотности упаковки от выполняемой функции.
Ожидалось, что плотность упаковки гидрофобного ядра в нашем белке будет превышать плотность упаковки его краев, но найденные различия не были значительными, поэтому встал вопрос о выборе метода, позволяющего эти различия оценить численно.
Первый метод (предложенный в задании) заключается в том, чтобы оценить минимальное расстояние, на котором находятся атомы, почти полностью экранирующие выбранный остаток. К сожалению, этот метод не очень точен и не позволяет получить цифры для сравнения упаковки разных остатков: “окружающие атомы почти закрывают выбранный остаток”. По-хорошему надо было бы получать картинки в разных проекциях, и обрабатывать их какими-то программами, позволяющими процентно измерить долю покрытия остатка. Но чего нет, того нет (;
Второй задействованный метод использует количество тяжелых атомов, расположенных на заданном расстоянии от выбранного остатка. Здесь есть две трудности. Первая заключается в том, что получаемые числа будут зависеть не только от плотности упаковки, но и от размера остатка. У меня не получилось придумать адекватный способо нормировки количества атомов в окружении на размер остатка (делить на площадь поверхности остатка?), поэтому сравнивались плотности упаковки одних и тех же остатков в разных позициях (к счастью, выбранный нами белок достаточно большой). Второй вопрос - сравнение количества атомов на каком расстоянии от выбранного остатка наиболее показательно?
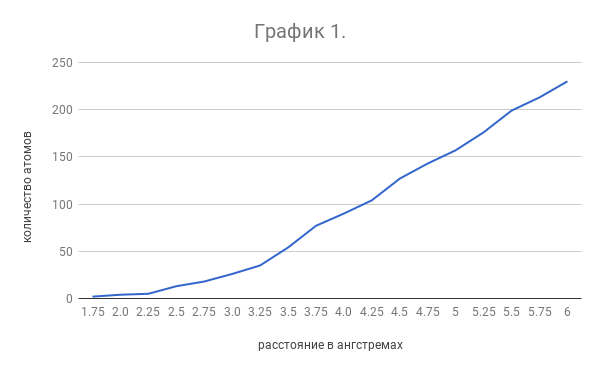 | Чтобы определить, для каких расстояний дальше сравнивать количество тяжелых атомов, окружающих остатки в разных позициях, был выбран остаток Ile218 (он гидрофобный и достаточно крупный, кроме того, он не контактирует с поверхностью и его радикал имеет почти полностью алифатическое окружение) и построен график 1: количество атомов на рахных расстояниях от выбранного остатка. Видно, что первые атомы появляются на расстояниях около двух ангстрем - это атомы, связанные с выбранным остатком ковалентно. При желании можно разглядеть критическую точку, соответствующую 3.75 ангстрем: после нее график очень близок к линейному, до нее - возрастает быстрее, чем линия. Линейность после точки означает, что количество атомов возрастает число за счет увеличения объема (нелинейного, кстати) выбранной области, до 3.75 ангстрем увеличение числа атомов можно связывать с отталкиванием от выбранного остатка. |
 | 
|  |
 | 
|  |
Теперь, когда расстояние 3.75 ангстрем выбрано, посмотрим, какое характерное число тяжелых атомов расположено на этом расстоянии от гидрофобных остатков, находящихся в ядре и вне его. Сначала предполагалось искать остатки, принадлежащие ядру, функцией buried (досоловно "закопанные"), но в действительности эта функция относит все изолейцины к закопанным, хотя некоторые из них почти на поверхности. Поэтому анализ проводится для нескольких изолейцинов (выбранных случайно), выделенных на следующей картинке цветом, и их принадлежность к ядру можно определить "на глаз":
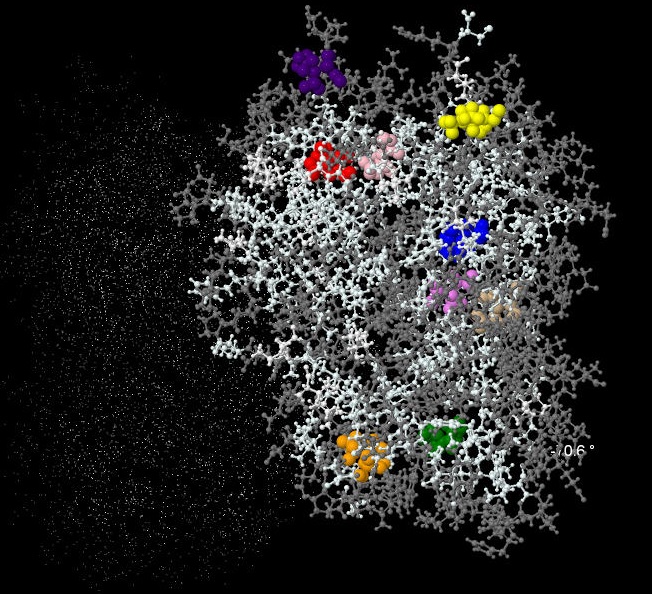 |
Различные изолейцины отмечены цветом; в скобках указано количество тяжелых атомов, находящихся на расстоянии
не более 3.75 ангстрем от выбранного остатка. Атомы цепи В (точная копия цепи А) показаны точками в левой части рисунка.
|
Получается, что плотность упаковки в белке довольно сильно различается даже "в глубине" белка, но визуализировать эти различия сложно. Тем не менее, понятно, что ни между какими тяжелыми атомами в глубине белка вода влезть не может, так как радиус молекулы воды приблизительно 2.8 ангстрем, а тяжелые атомы встречаются уже на расстоянии 2.75. Даже при неколько большем (до 3.5) расстоянии между атомами вода вряд ли поместится: помешают силы молекулярного отталкивания.
Несмотря на использование восстановителей во всех буферах и растворах для кристаллизации, цистеин активного центра ([CYS]159) окислился до –SO2H. Такое явление наблюдается и в других поликетидных синтазах и блокирует транспорт субстрата в активный центр.
Взаимодействия лигандов с белком.
Я исследовала только B субъединицу гомодимера бифенил-синтазы.
Ковалентных связей лиганды с бифенил синтазой не образуют. После самостоятельного поиска водородных связей, солевых мостиков или гидрофобных взаимодействий я сверяла найденные гипотетические контакты с указанными на pdb-странице исследуемого белка.
Водородные связи есть у всех трех лигандов. Их средняя длина составляет 2, 43 ангстрема. Я искала их с помощью команд hbonds calculate, within, select group. Важную роль играют водородные связи, образованные [LYS]50, [ARG]53, [ALA]305, [GLY]302 с бензоилом-КоА. Эти связи консервативны и в других поликетидных синтазах, содержащих лиганды с КоА. Их роль заключается в следующем. «Остатки-привратники» [PHE]215 and [PHE]265 влияют на субстрат-специфичность активного центра бифенил-синтазы. Они действуют как «стерические ворота», если переключать их ротамерные состояния. А на ротамерные состояния [PHE]215 and [PHE]265 влияет трехаминокислотная гидрофильная «петля», которая формирует водородную связь между [LEU]262 и аденином бензоила-КоА. Таким образом водородные связи с бензоилом-КоА играют важную роль в функционировании активного центра, а в частности – в его субстрат-специфичности.
Солевые мостики я искала, отображая в радиусе 7 ангстрем от лиганда только заряженные аминокислоты (ARG, HIS, LYS, ASP, GLU) (именно они отображены в апплете). Таким образом солевые мостики с белком обнаружились только у бензоил – КоА, однако на pdb-странице солевых мостиков не было указано ни для одного из лигандов.
Для поиска гидрофобных взаимодействий я отображала в радиусе 7 ангстрем от лиганда аминокислоты, способные к гидрофобным взаимодействиям (ALA, ILE, LEU, MET, PHE, TRP, TYR, VAL, PRO). Так были найдены гидрофобные контакты бутандиола-4 и для бензоил-КоА, наличие их подтвердилось проверкой.
Также для бензоил-КоА было найдено одно стэкинг - взаимодействие с [PHE]210:b. Интересно, что ароматические группы расположены не параллельно, а несколько под углом.
Вернуться на страницу второго семестра
© potapenko 2017