Целью этого задания была отработка навыков работы с Pymol. Я работала со структурой, имеющей pdb-код 5reu. Это структура главной протеазы коронавируса Sars-COV-2 с низкомолекулярным лигандом, обозначаемым T4D. Эта структура была получена консорциумом PanDDA, структуры связывания низкомолекулярных ингибиторов с белком-мишенью позволяют "собирать" более сложные (и, следовательно, более специфичные) ингибиторы. Структуру лиганда T4D и его полное название можно найти на соответствующей страничке RCSB PDB.
Участок структуры, на котором видно взаимодействие лиганда с протеазой, приведён на рисунке 1. Углероды протеазы серые, углероды лиганда светло-зелёные, остальные атомы окрашены стандартно. Видно, что лиганд связан с протеазой ковалентно: не знаю, как точно называется такая связь, углерод из метильной группы лиганда присоединён к сере цистеина 145. Кроме этой ковалентной связи, положение лиганда в кармане стабилизируется, например, водородными связями между кислородом кето-группы лиганда и остовными азотами серина 144 и глицина 143 (показаны жёлтым пунктиром).
UPD. Рисунок содержит ошибку и неточность, тут исправлять не стала, уточнения в практикуме 6.
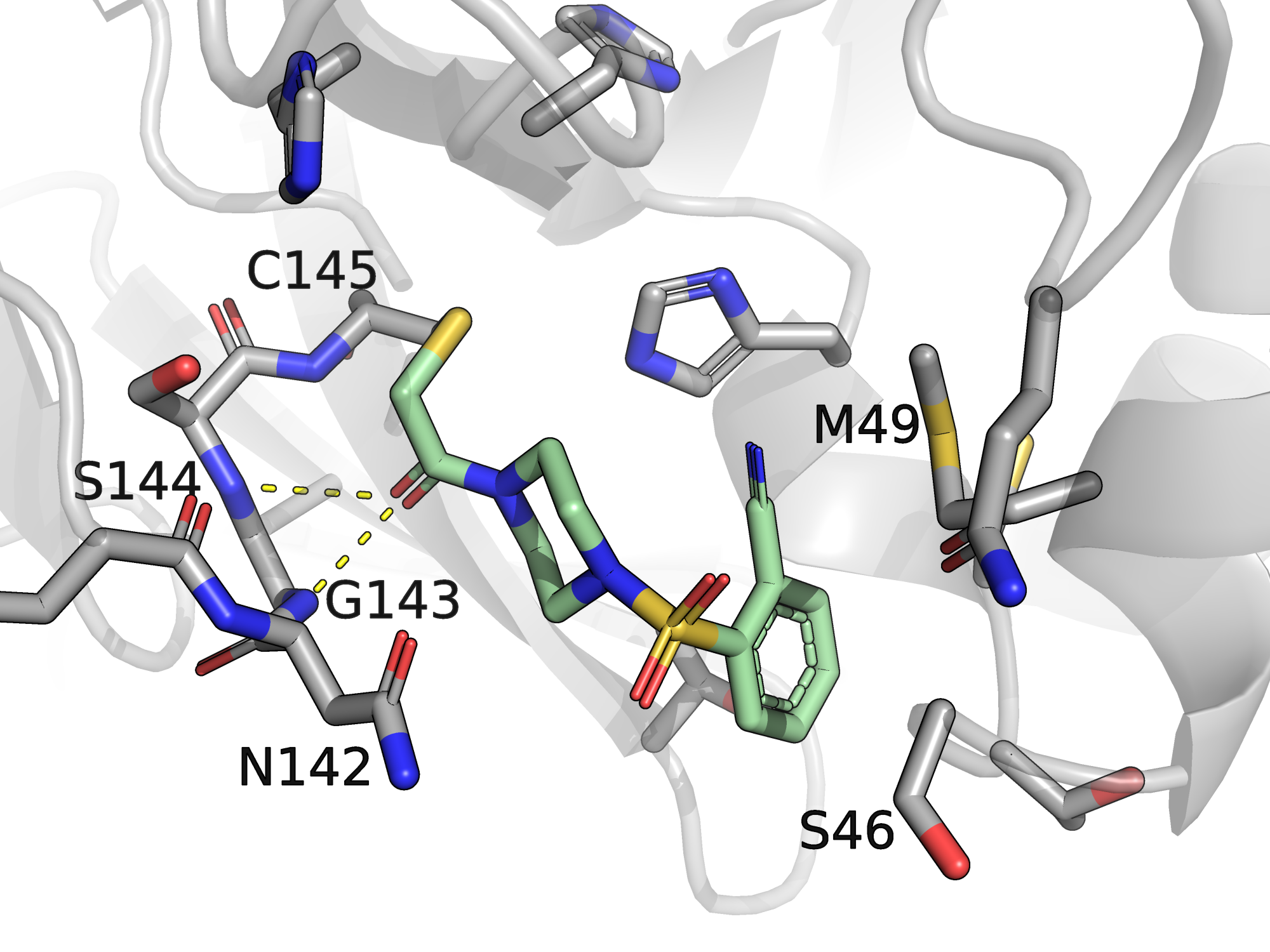
Рис.1. Сайт связывания лиганда T4D c белком главной протеазы коронавируса Sars-COV-2, PDB ID: 5REU. По ссылке можно скачать сессию, соответствующую рисунку 1.
В этом задании мне нужно было сравнить две кристаллографические расшифровки одного и того же белка (Extended catalytic domain of Hypocrea jecorina). Hypocrea jecorina - гриб-аскомицет, используется в промышленности как продуцент целлюлаз. В названии соответствующей pdb-записи этот организм указан как Trichoderma reesei, видимо, это сохранившиеся старые названия для телеоморфной и анаморфной стадий гриба. Этот фермент относится к семейству литических полисахаридных монооксигеназ (LPMO) AA9, усиливающих гидролитическую активность целлюлаз. Обычно такие ферменты содержат каталитический домен и углевод-связывающий домен, в данной структуре представлен только каталитический домен.
Первое отличие, видное при взгляде на структуры (PDB_ID = 5O2X, 5O2W) - большое количество молекул воды в структуре 5O2X. В остальном расшифрованные структуры довольно похожи. Чтобы сравнить качество расшифровки структур, я использовала функцию mesh (сетку). На уровне подрезки в два сигма большая часть сетки для структуры 5O2W выглядит как отдельные осколки, сложно понять, какие атомы с какими соединены, в то время как у структуры 5O2X местами угадывается, например, как идёт атомный остов.
На рисунках 2 и 3 приведены небольшие кусочки визуализации электронной плотности с помощью сетки (уровень подрезки = 2). Выделение сделано по остову подпоследовательности NIYTSPLN (координаты [209..216] в обеих структурах). Видно, что у структуры 5O2X сетка вокруг атомов более гладкая и более округлая, лучше согласуется с положениями отдельных атомов. Все кислороды и почти все азоты имеют вокруг себя более-менее правильную сетку, и вокруг всех атомов хоть какая-то сетка есть, по сетке видно, как атомы соединяются между собой. В структуре 5O2W же сеткой покрыты все атомы кислорода (наверное, это связано с тем, что в атомах кислорода больше электронов, и их "лучше видно" на РСА), а некоторые атомы азота и углерода не покрыты сеткой. В целом, видно, что разрешение у модели 5O2X лучше. Это подтверждается данными из PDB: разрешения структур приведены 0.95 ангстрем для 5O2X и 2.0 ангстрема для 5O2W.
 |  |
| Рис. 2. PDB_ID = 5O2X. Электронная плотность вокруг остова а.о. 209..216. Уровень подрезки 2 сигма, carve = 0.9 | Рис. 3. PDB_ID = 5O2W, Электронная плотность вокруг остова а.о. 209..216. Уровень подрезки 2 сигма, carve = 1.5. |
Технический комментарий к картинке: для получения сетки я использовала команду isomesh с уровенем подрезки 2 сигма, carve = 1.5, при этом сетка строилась для выделенного остова подпоследовательности. Параметр carve подбирался отедельно для двух структур, так, чтобы не захватывались куски сетки, относящиеся к радикалам. У структуры 5O2X такие куски не захватывались только при carve = 0.9, я на всякий случай проверила, что при таком маленьком значении участки сетки, соответствующие остову, не обрезаются (т.е. имеют такую же форму, как при carve = 1.5). Получается, что сравниваемые изображения были получены для разных значений параметра, но их можно сравнивать, ведь в ручную было проверено, что изменение этого параметра влияет на обрезку посторонних участков и не влияет на форму сетки вокруг атомов остова.
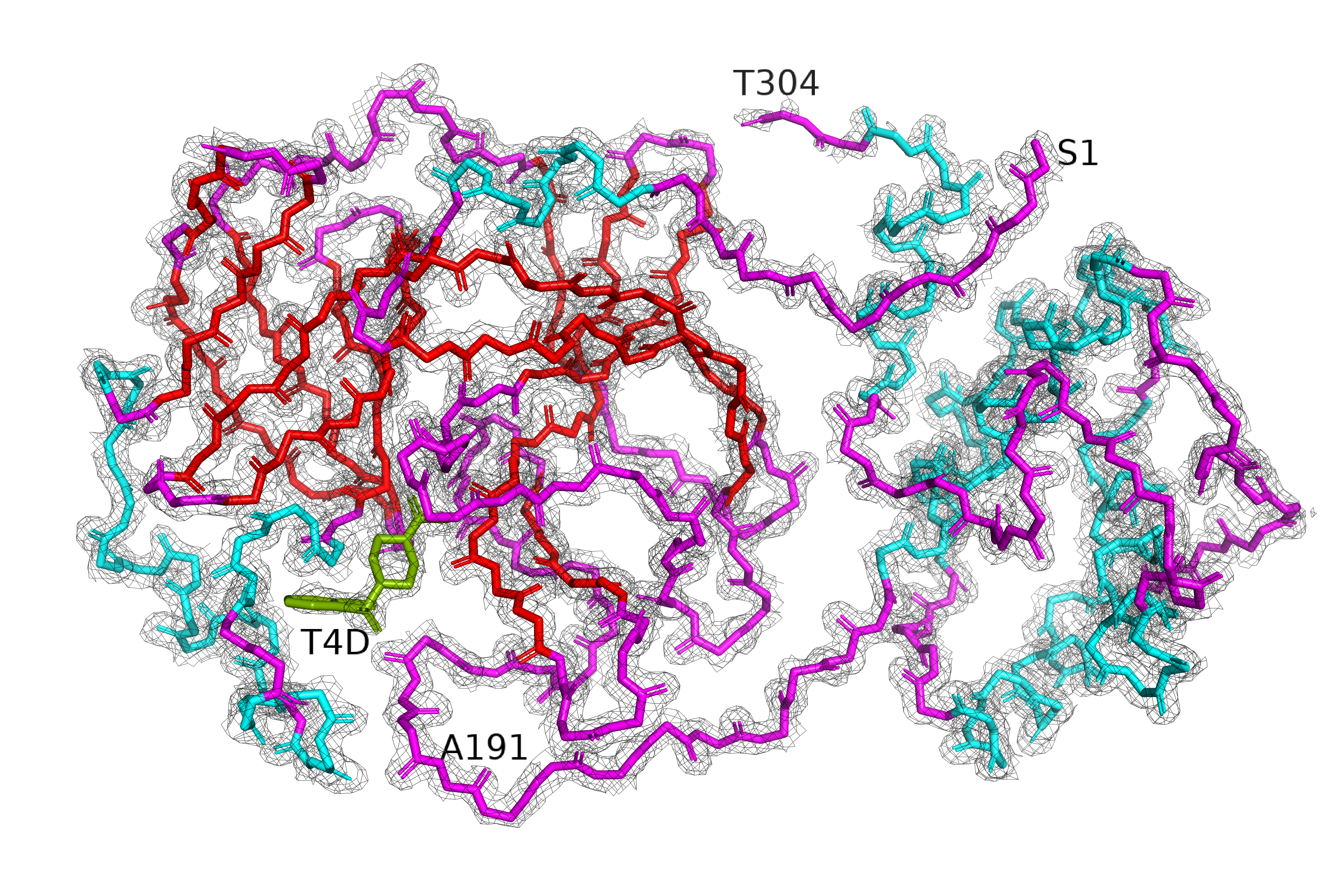
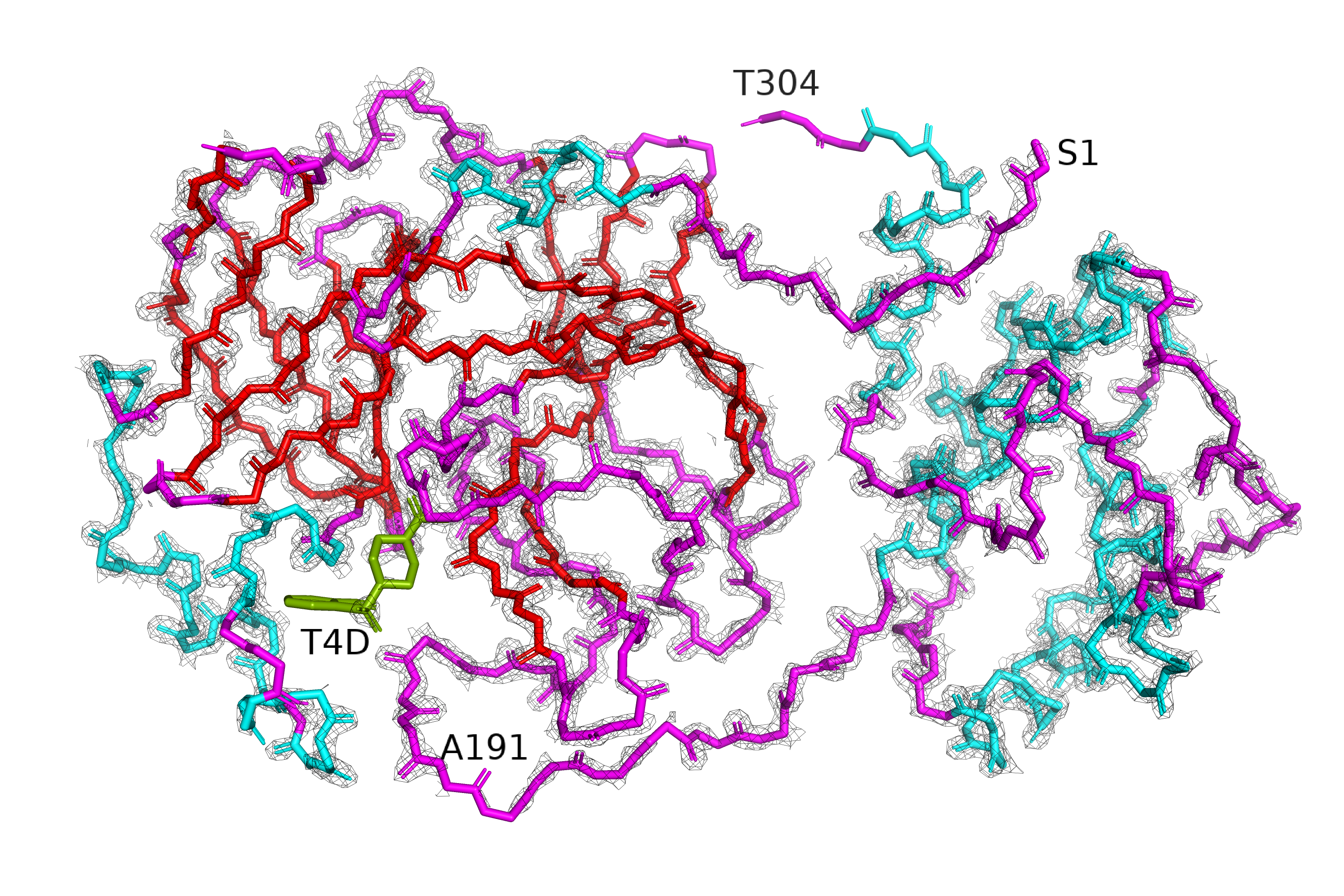
В этом задании нужно было на примере структуры 5REU (главная протеаза коронавируса с ингибитором T4D) оценить, как изменяется покрытие структуры сеткой (mesh) при изменении уровни подрезки. На рисунках 4-6 приведена серия mesh'ей вокруг остова всего белка, уровень подрезки различается между рисунками, а значение carve везде равно 1.3 (компромисс между тем, чтобы не слишком сильно видна была электронная плотность радикала (бета-углерода), но и сетка, относящаяся к остову, не обрезалась). Белок покрашен по структуре: голубым обозначены а.о., относящиеся к альфа-спирали, красным - к бета-листу, розовым - петли (неструктурированные участки). Лиганд покрашен зелёным.
 |
 |
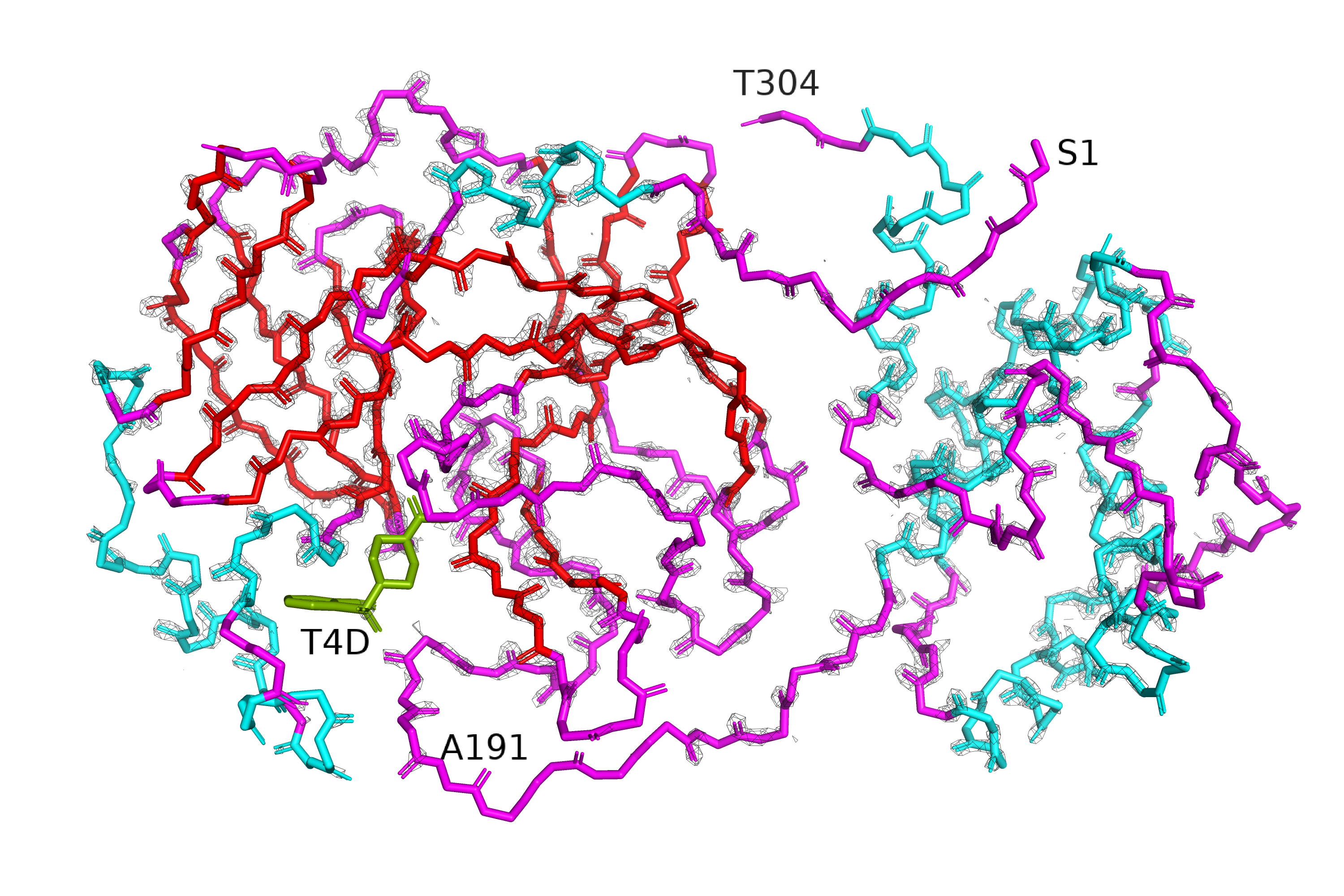 |
| Рис.4. 5REU, isomesh, уровень подрезки=1 | Рис.5. 5REU, isomesh, уровень подрезки=2 | Рис.6. 5REU, isomesh, уровень подрезки=3 |
На рисунке 4 видно, что при первом уровне подрезки почти все атомы модели покрыты электронной плотностью. Исключение составляет пара аминокислот на С-конце белка (Tre304 на картинке). С-конец сильно выступает наружу из белковой глобулы, последние аминокислоты не участвуют в образовании вторичной структуры, поэтому логично, что в кристалле такой участок относительно лабилен.
На рисунке 5 уровень подрезки выше (2), доля атомов модели, покрытых ЭП, меньше. Большинство атомов, принадлежащих ко вторичной структуре (спирали и листы, т.е. голубые и красные атомы на рисунке), покрыты ЭП. Но среди петель появляются аминокислотные остатки, не покрытые ЭП при таком уровне подрезки: например, аланин 191. С-конец также менее покрыт, в том числе не покрыта пара аминокислот, участвующих в образовании спирали. Интересно, что при этом N-конец белка ещё покрыт ЭП, то есть он менее лабилен, чем С-конец.
На рисунке 5 видно так же, что при уровен подрезки 2 почти не покрыт ЭП лиганд. Нам было рассказано, что болле низкое разрешение лиганда по сравнению с белком - это артефакт метода, а не свойство структуры: в ходе работы консорциума PanDDA рассматривались кристаллы протеазы коронавируса с разными лигандами, и данные по белку были агрегированы из результатов многих РСА-экспериментов, а данные лиганда в каждом случае имелись только из одного эксперимента. Таким образом, модель белка строилась по большему количеству данных, и поэтому белок в структуре разрешён лучше, чем лиганд.
На рисунке 6 уровень подрезки высокий (3), многие атомы модели уже не покрыты электронной плотностью. Видно, что более покрытые ЭП атомы более глубоко упакованы в глобулу, а близкие к поверхности участки, особенно неструктурированные, не покрыты ЭП. Как уже отмечалось выше, ЭП чаще покрывает атомы кислорода, чем азота или углерода.
Итак, можно сделать вывод, что при увеличении уровня подрезки первой "срезается" ЭП, соответствующая неструктурированным участкам, лежащим близко к поверхности белка, и особенно - свободному N-концу.
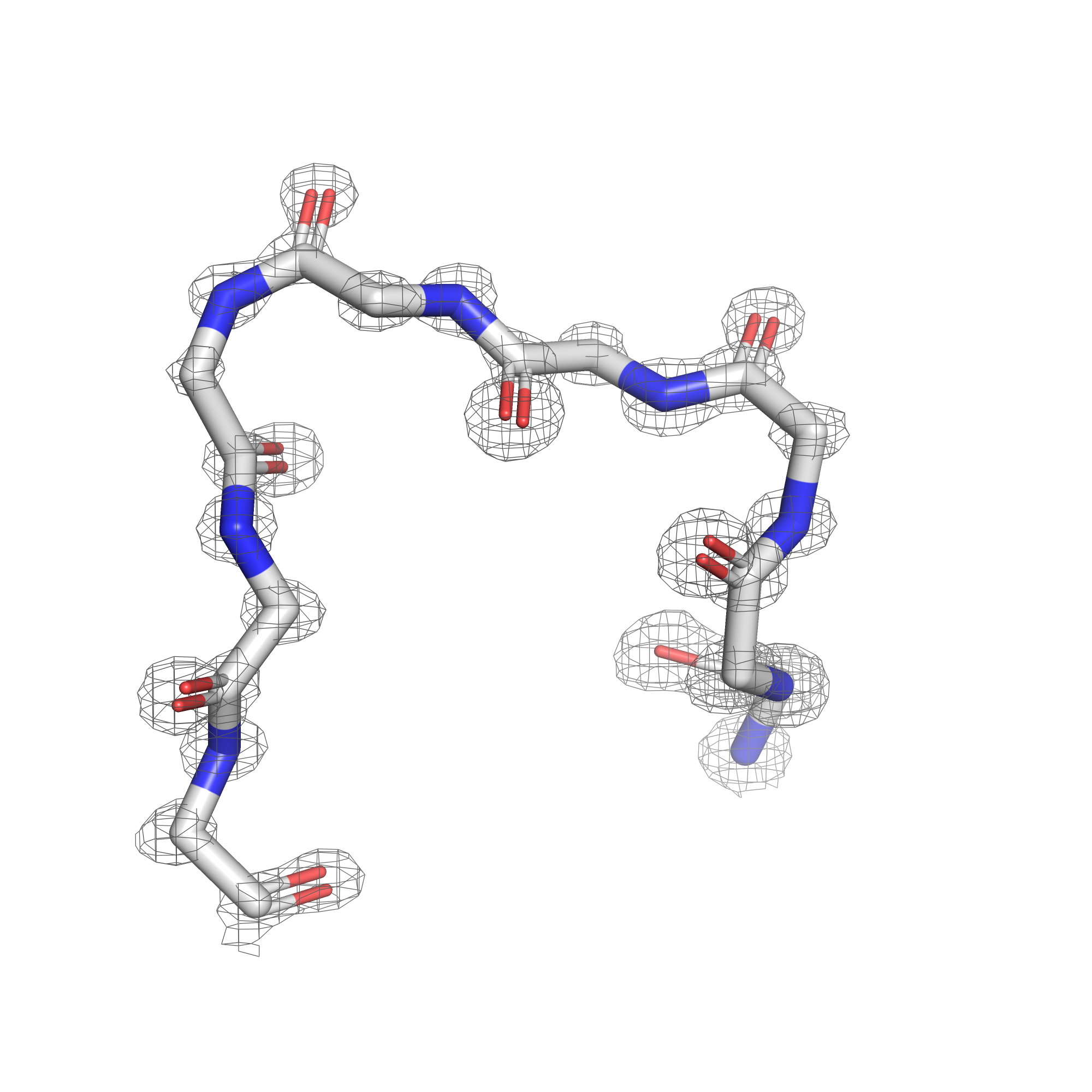
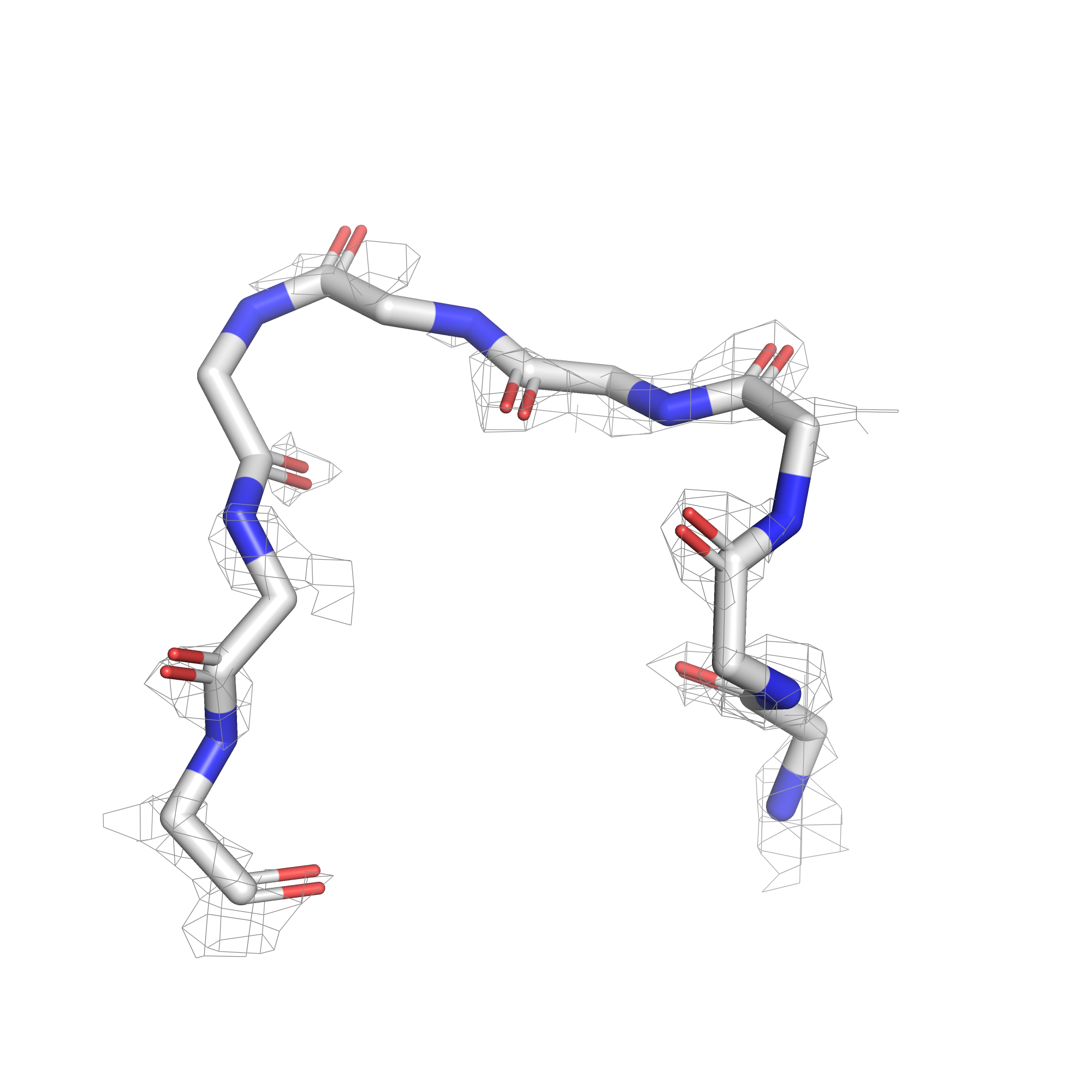
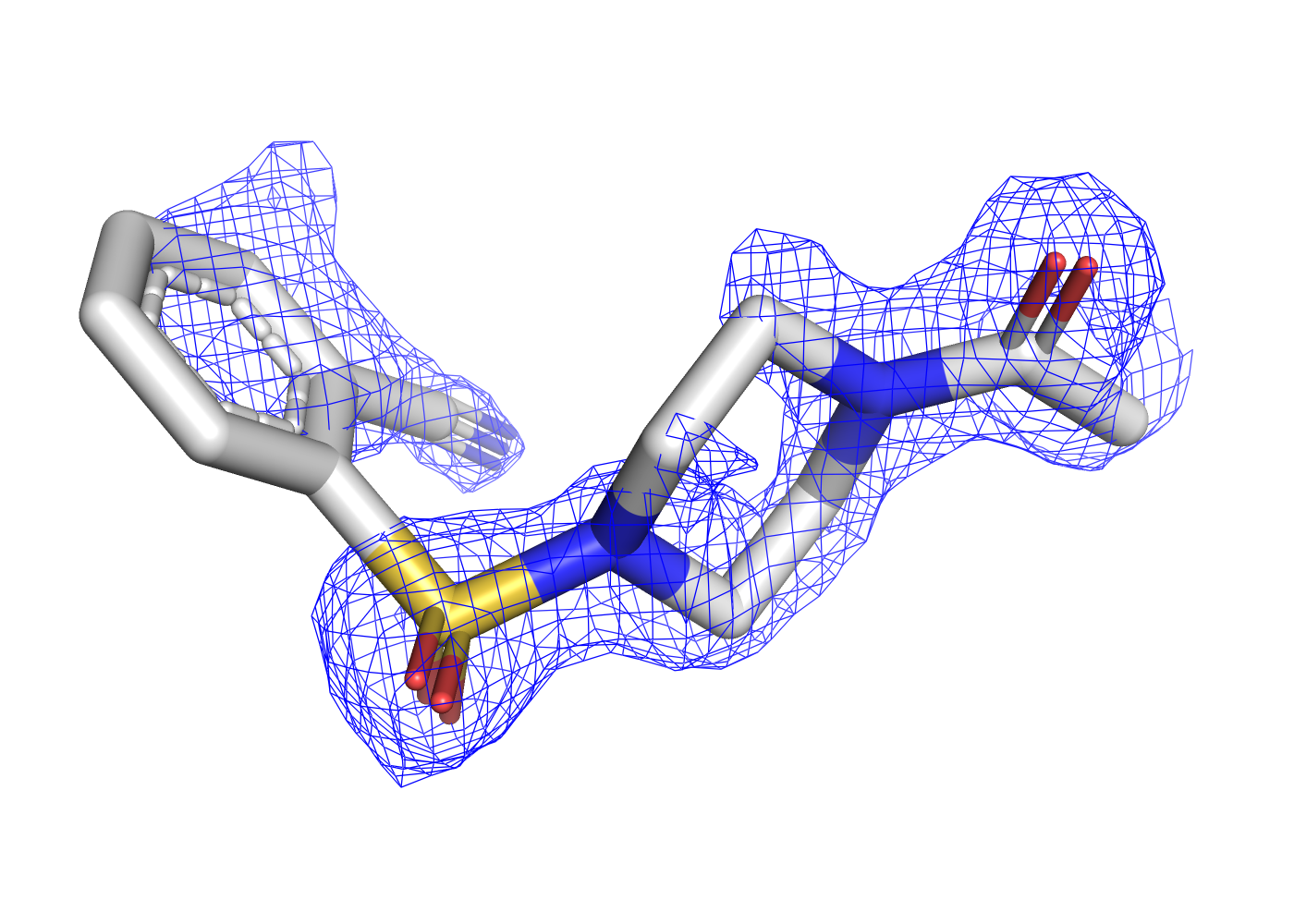
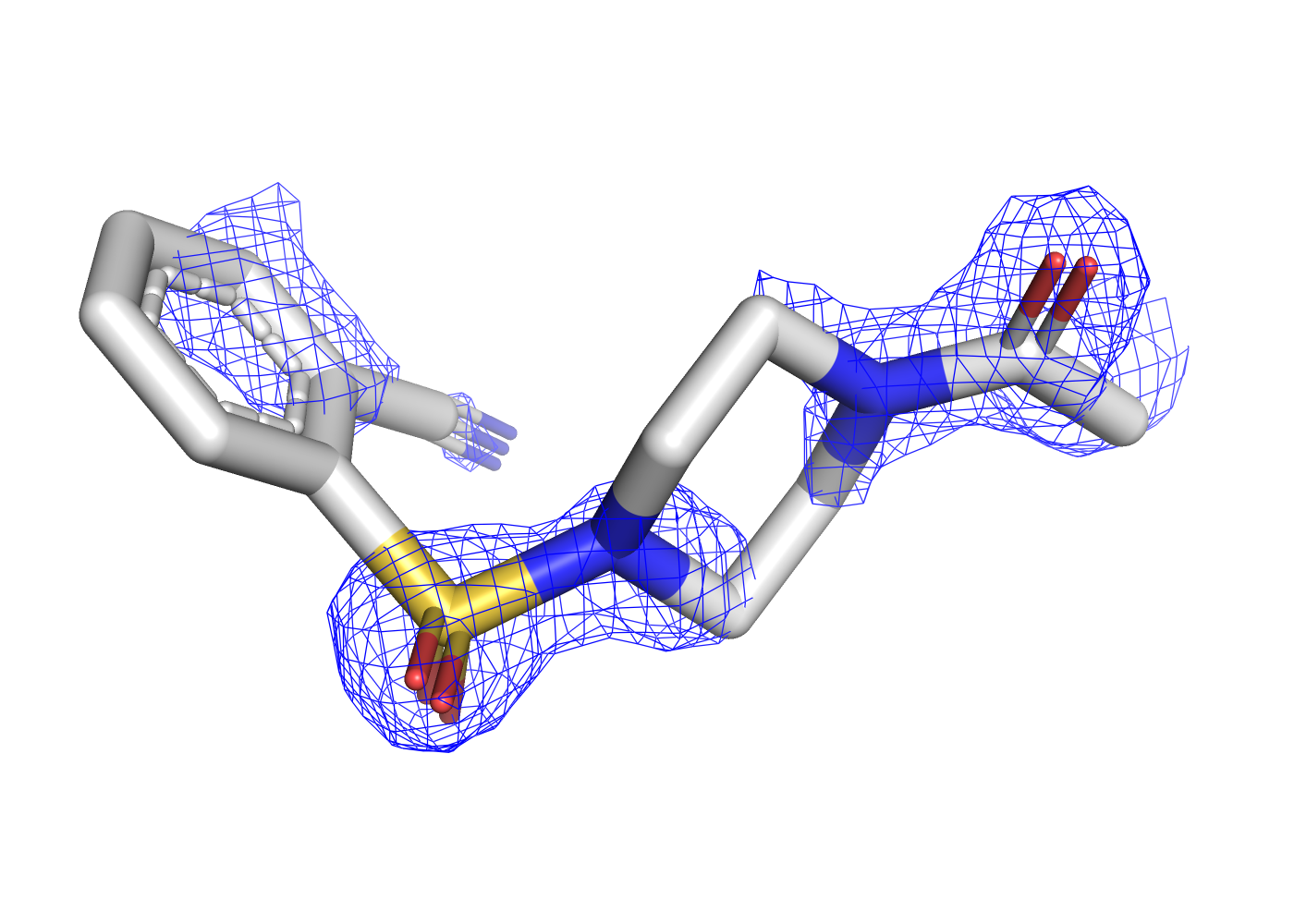
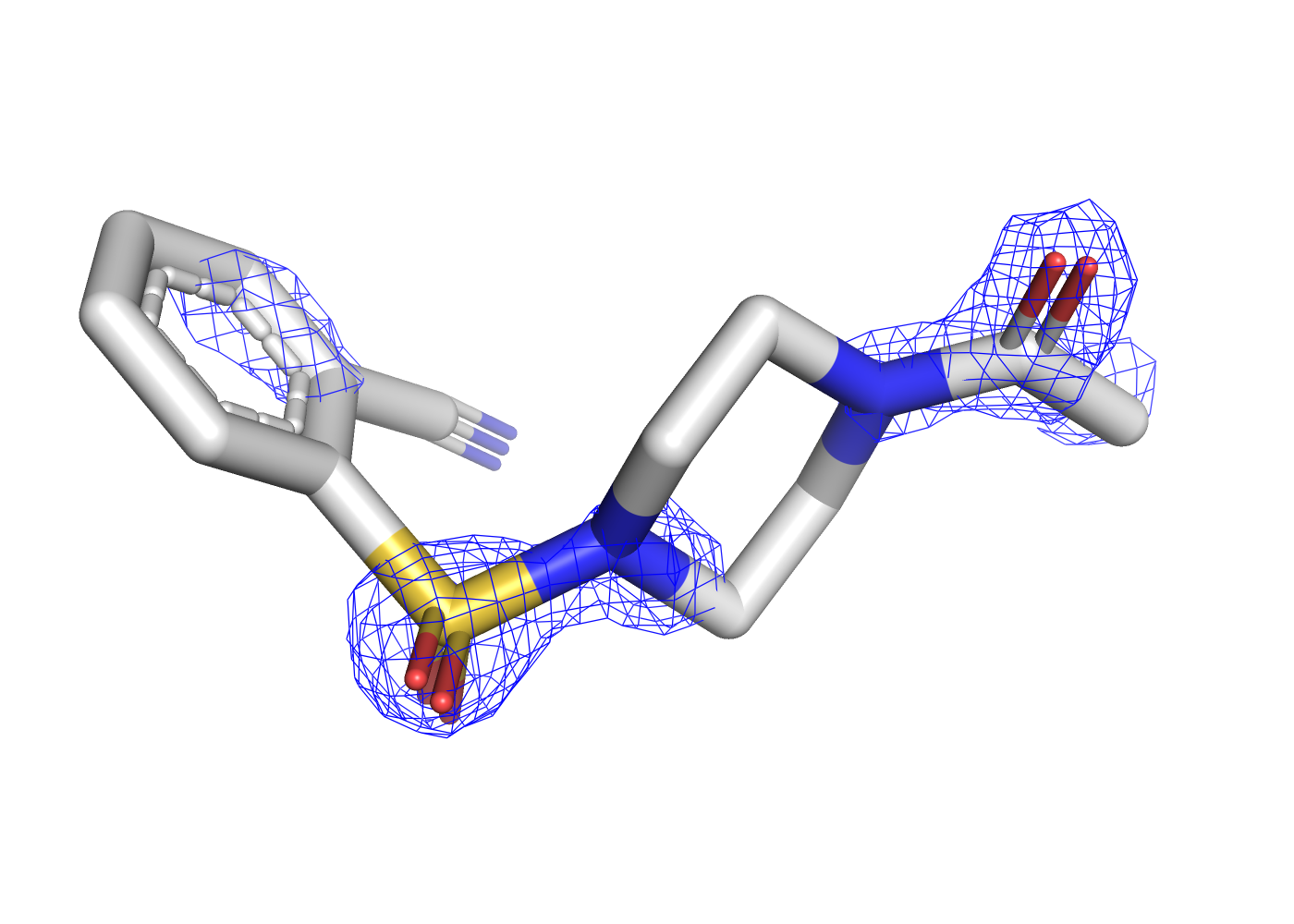
Как уже было отмечено в предыдущем задании, при уровне подрезки в 3 сигма почти все атомы лиганда уже не покрыты ЭП. Чтобы посмотреть, в какой последовательности пропадает ЭП, покрывающая разные типы атомов, была сделана серия mesh'ей с промежуточными уровнями подрезки, равными 1, 1.3, 1.6, и значением 2.5 в качестве крайнего, когда ЭП остаётся только на двух атомах. Соответствующие визуализации приведены на рисунках 7, 8, 9, 10.
 |
 |
 |
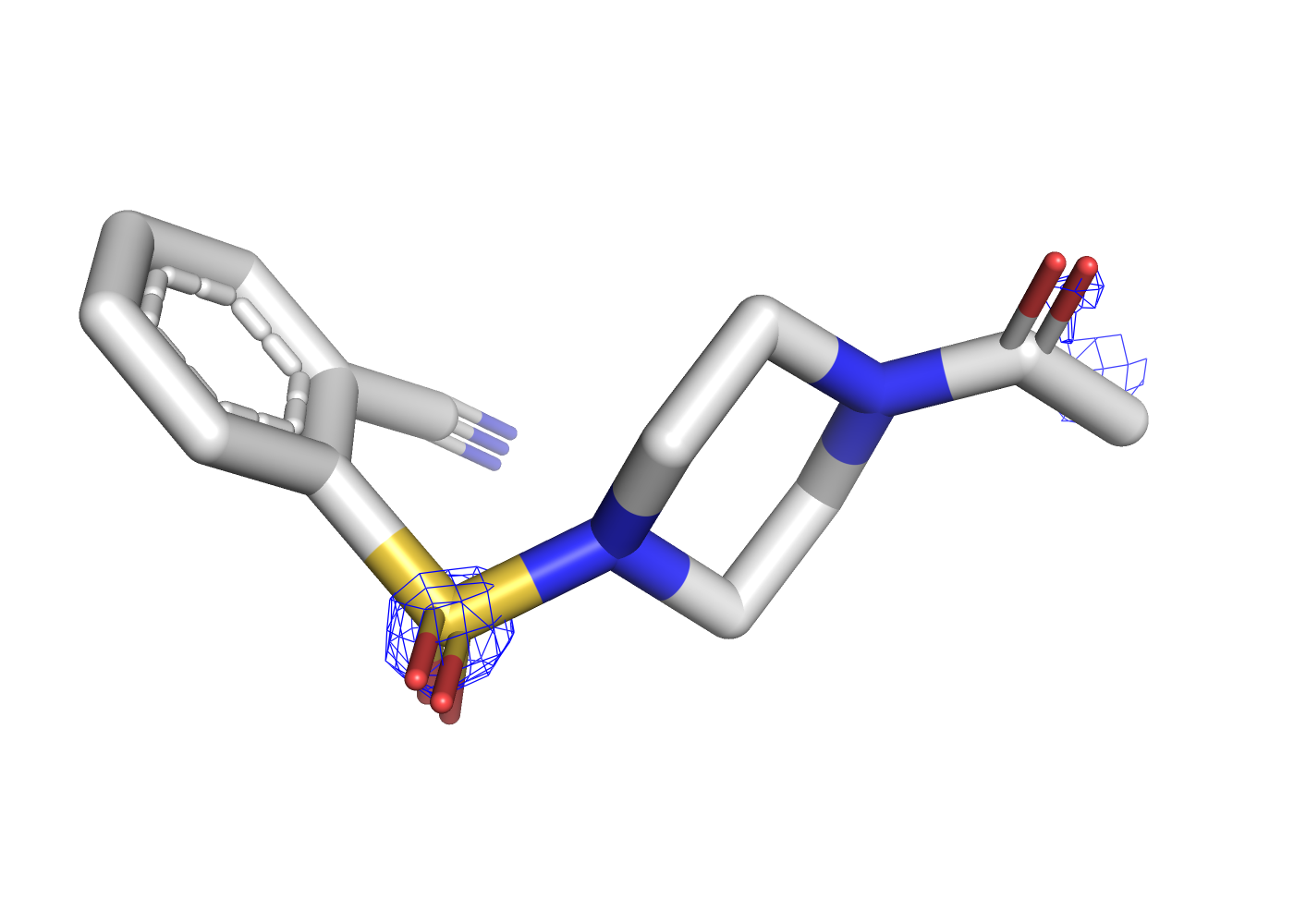 |
| Рис.7. 5REU, T4D, уровень подрезки 1.0 | Рис.8. 5REU, T4D, уровень подрезки 1.3 | Рис.9. 5REU, T4D, уровень подрезки 1.6 | Рис.10. 5REU, T4D, уровень подрезки 2.5 |
При постпенном увеличении уровня подрезки первой пропадает ЭП с углеродов ароматического кольца, расположенных со обратной (относительно заместителей) стороны. Далее обрезается ЭП остальных углеродов, потом с азота нитрильной группы, и остаётся только на кислородах.
Итак, можно сделать вывод, что чем больше у атома электронов, тем более заметной (на РСА) электронной плотностью он обладает. Как объяснить, что ЭП с углеродов ароматического кольца пропадает раньше, чем с углеродов другого кольца? Возможно, это связано с тем, что ароматическое кольцо не имеет водородных связей с белком и может быть более лабильным. Лучше разрешаются электронные плотности тех атомов, координированных водородными связями относительно белка.
Вернуться на страницу 7 семестра
© potapenko 2017-2021