В данном задании разбирается структура с pdb_id = 6AIS. Лизин-69 этой структуры имеет альтернативные положения, т.е. в кристалле присутствуют разные конформации белка, у которых этот остаток расположен по-разному относительно остальных. Каждое из этих альтенативных положений координировано какими-то взаимодействиями со своим окружнием. Моя задача - эти взаимодействия найти и попытаться сопоставить стабильность альтернативных положений, поддерживаемых этими взаимодействиями, с представленностью соответствующей конформации в кристалле.
В pdb-файле все атомы лизина-69 имеют альтернативные положения (две тройки координат на каждый атом), но положения остовных атомов различаются очень слабо, и вряд ли эти различия могут влиять на взаимодействия, стабилизирующие ту или иную конформацию. Радикал лизина может быть донором в трёх водородных связях, а также образовывать ионный мостик.
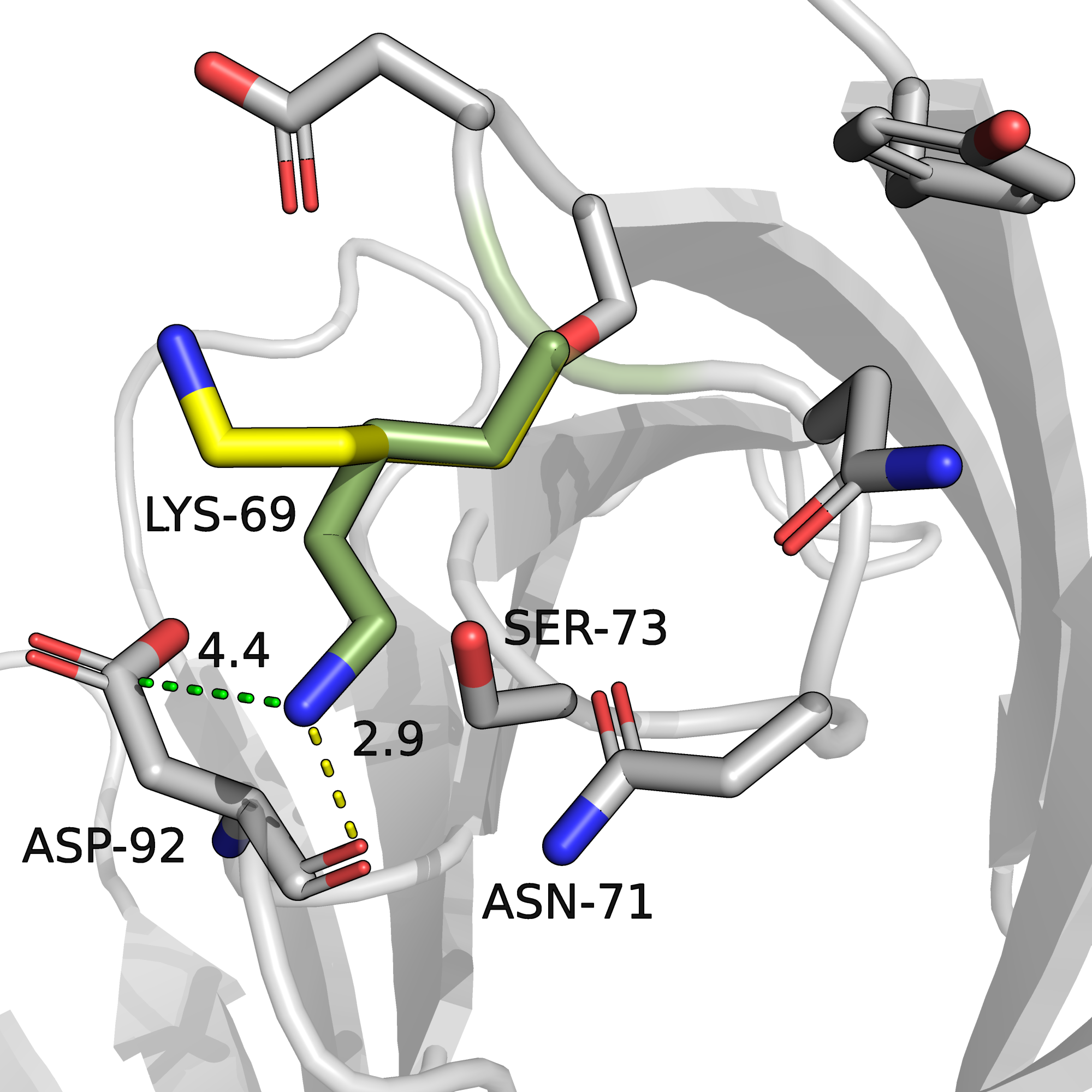
На рисунке 1 представлен альт-лок А и его окружение. Палочками показаны радикалы аминокислотных остатков, хотя бы один атом которых расположен не дальше, чем в 5 ангстремах от лизина-69. Атомы углерода альт-лока А изображены зелёным, углероды альт-лока В жёлтые, остальные углероды серые. Водородные связи показаны жёлтым пунктиром, ионные мостики - зелёным.
 |  |
| Рис. 1. Взаимодействия, координирующие альт-лок А. | Рис. 1. Взаимодействия, координирующие альт-лок В. |
Мне кажется, что имеют место два взаимодействия, стабилизирующее альт-лок A - это, во-первых, водородная связь с остовным кислородом Asp-92, длина этой связи 2.9 ангстрем (показана жёлтым пунктиром). Вторая связь - это ионный мостик с карбоксильной группой Asp-92 длиной 4.4 ангстрема (т.к. разряд размазан по двум кислородам, расстояние измеряется до углерода карбоксильной группы). Остальные электроотрицательные атомы, с которыми могло бы быть какое-то взаимодействие, расположены слишком далеко: до кислорода аспарагина-71 4.3 ангстрема, до кислорода серина-73 тоже 4.3 ангстрема, это слишком далеко для образования водородной связи.
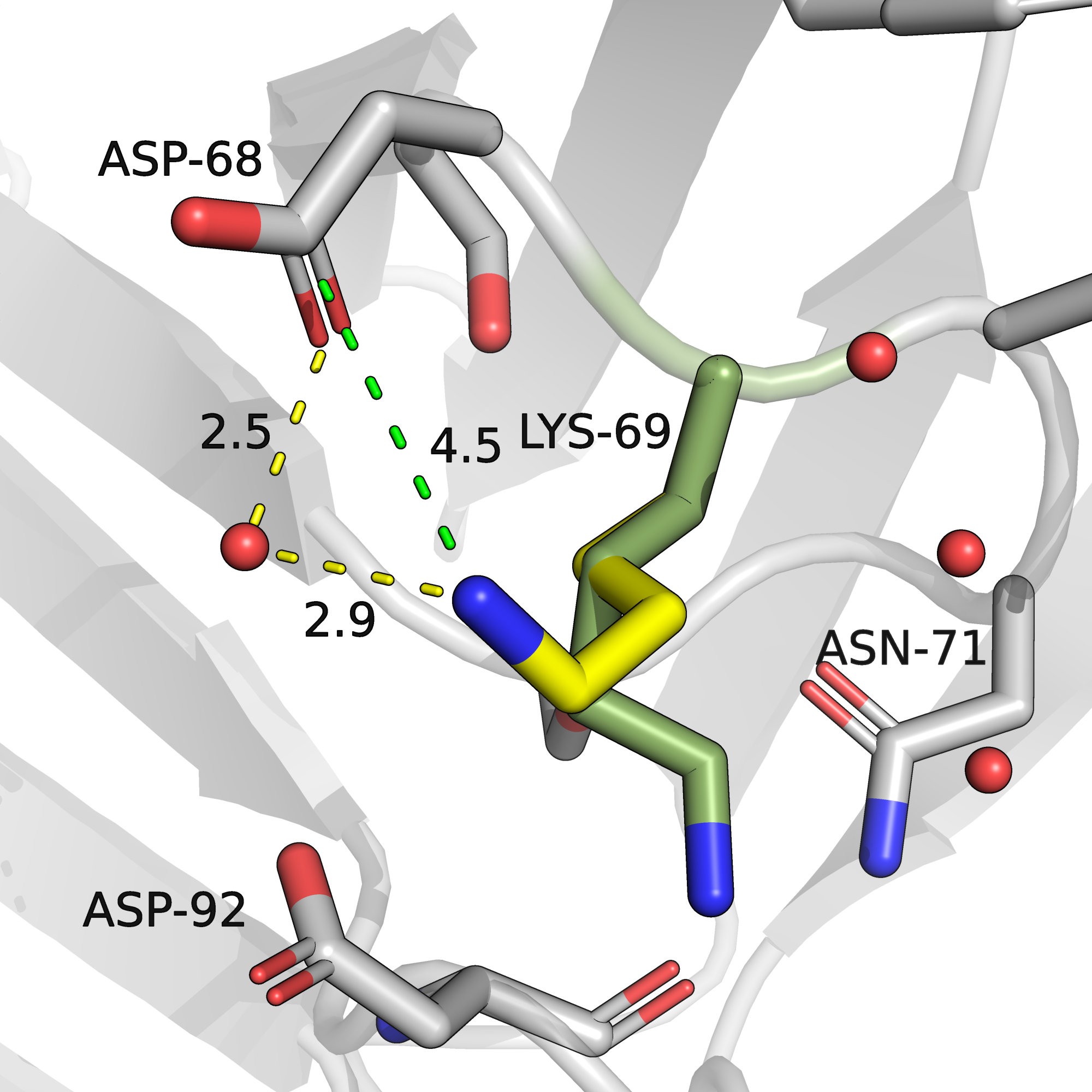
На рисунке 2 представлен альт-лок В и его окружение. Во-первых, имеет место солевой мостик с карбоксильной группой аспарагина-68 длиной 4.5 ангстрем. Атомы белка, теоретически способные способные образовывать водородные связи, расположены на расстоянии более 4 ангстрем, но есть молекула воды, кристализованная на расстоянии 2.9 ангстрем от аминогруппы лизина-69 и на расстоянии 2.5 ангстрема от кислорода радикала аспарагина-68, так что можно предположить, что они связаны через водяной мостик.
Мне кажется, что альт-лок А стабилизирован чуть лучше (чуть более короткий ионный мостик + водородная связь напрямую, а не через молекулу воды). Однако, по данным из pdb-файла, представленность альт-лока А, наоборот, меньше: 40% против 60%.
В этом задании нужно было посмотреть, как распределены значения B-факторов по участкам белка и как значение В-фактора связано с уровнем подрезки электронной плотности.
На рисунке 3 представлен атомный остов структуры 6AIS, покрашенный по В-фактору. В-фактор атома отражает "размазанность" электронной плотности в области пространства, куда модель поместила атом. Эта "размазанность" обусловлена температурно-зависимой подвижностью этого локального участка кристалла. В данной визуализации атомы с высоким В-фактором (т.е. с более размазанной областью ЭП, более подвижные) окрашены красным, а с низким В-фактором (т.е. менее подвижные, положение таких атомов определяется более точно) - синим. Промежуточные значения соответствуют белому цвету.
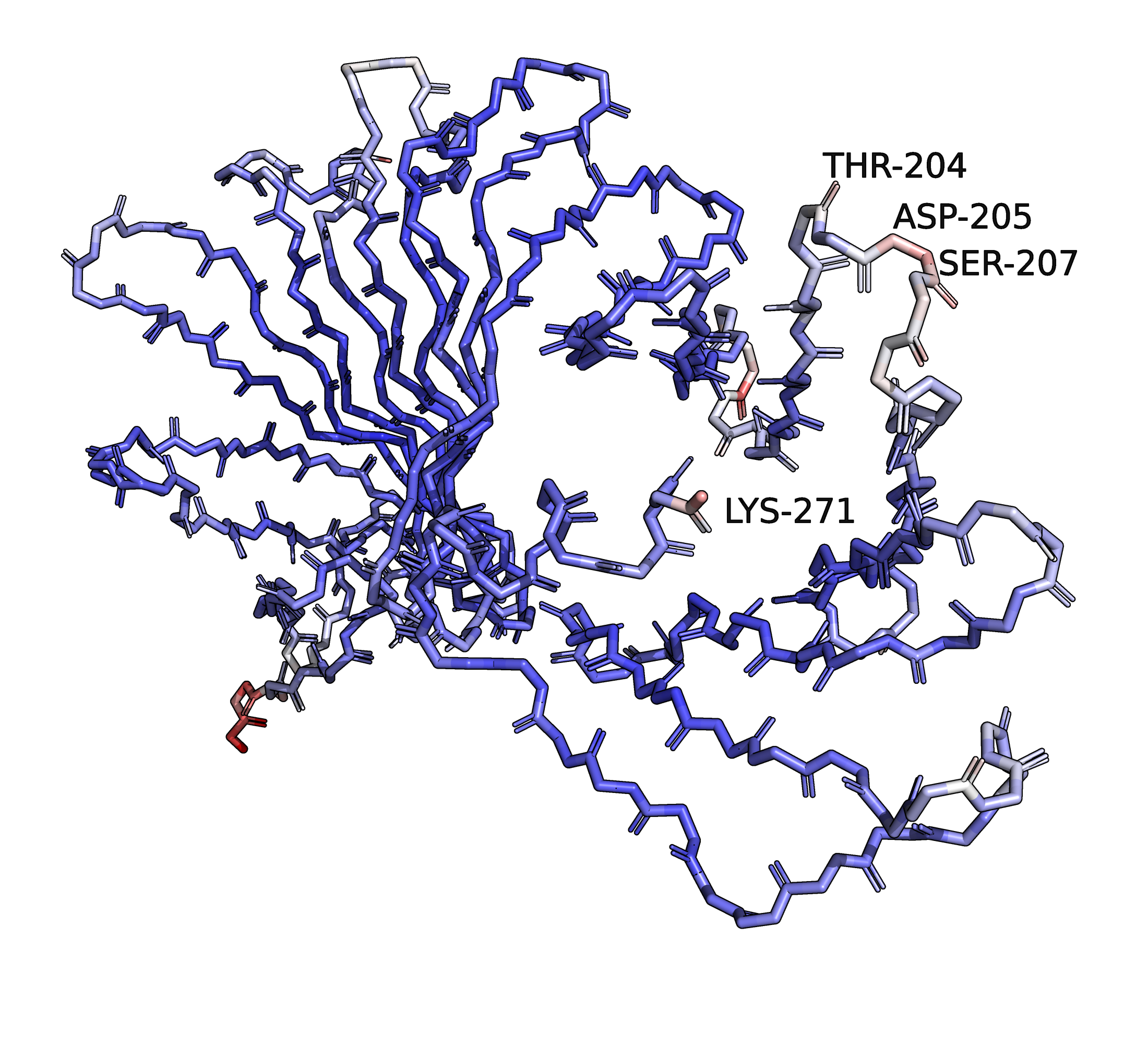
Рис. 3. Атомный остов структуры 6AIS, окраска по В-фактору.
Видно, что области с низким В-фактором - это большинство атомов бета-листа. Петли на "разворотах" бета-листа бело-красноватые. Это согласуется с тем, что элементы вторичной структуры имеют больше контактов с другими атомами белка, поэтому они менее подвижны (при той же температуре) и их ЭП менее размазана, чем у атомов, относящихся к петлям по краям белка, которые часть контактов образуют с растворителем, а не с белком, и поэтому более подвижны.
Большую часть структуры образует бета-лист, альфа-спиральных участка только два, и они небольшие. Один из них - небольшая спираль на С-конце белка. Она, как и "полагается" элементу вторичной структуры, имеет низкие значения В-факторов (примерно те же оттенки синего, что и у атомов бета-листа). Кончик этой спирали (он же - С-конец белка, подписан Lys-271) более подвижен и имеет большее значение В-фактора. Другая спираль в этой структуре очень маленькая, больше похожа на петлю с краю бета-листа (а.о. 204, 205, 207), расположена на поверхности белка, поэтому и В-фактор её атомов достаточно большие.
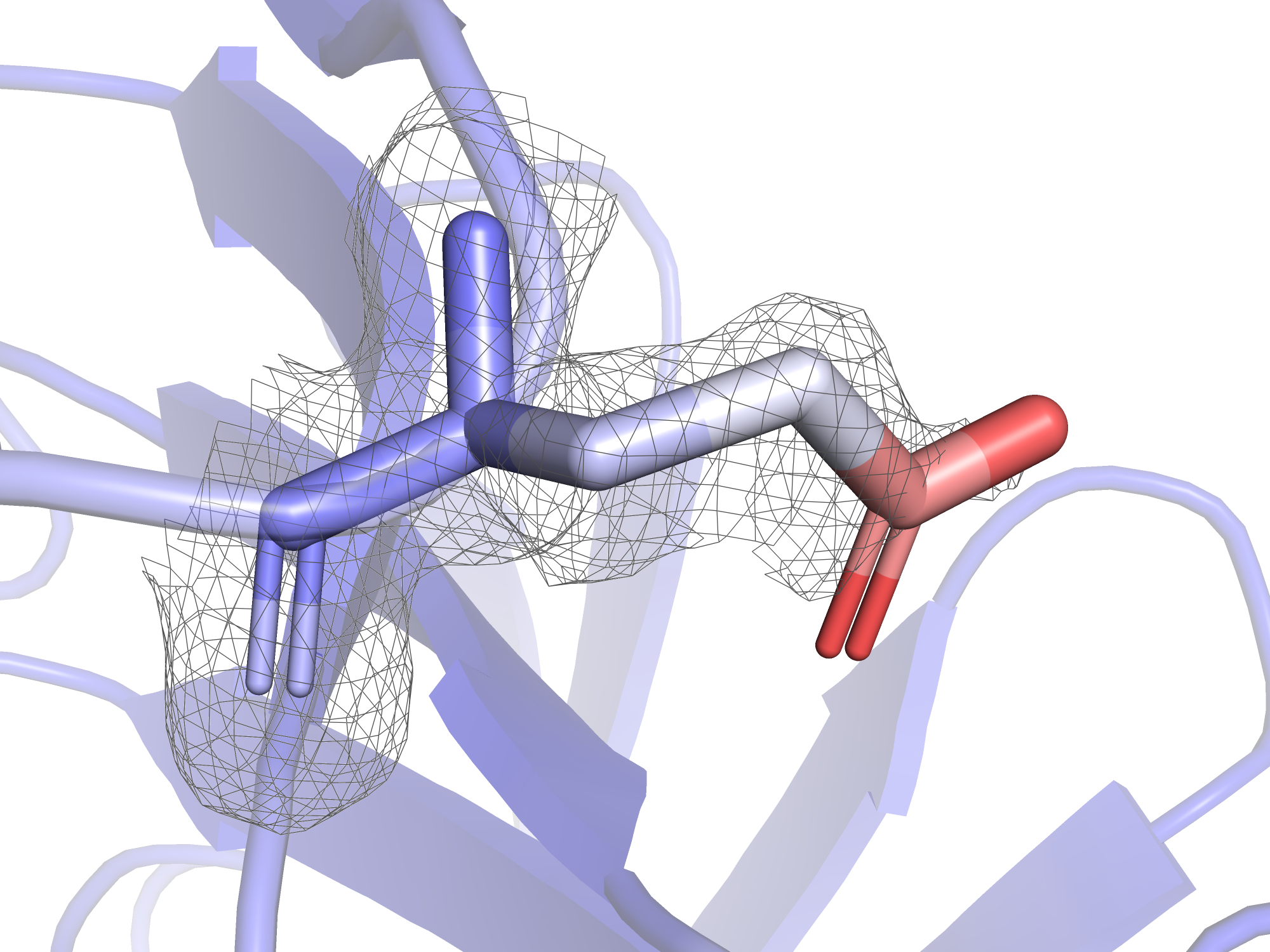
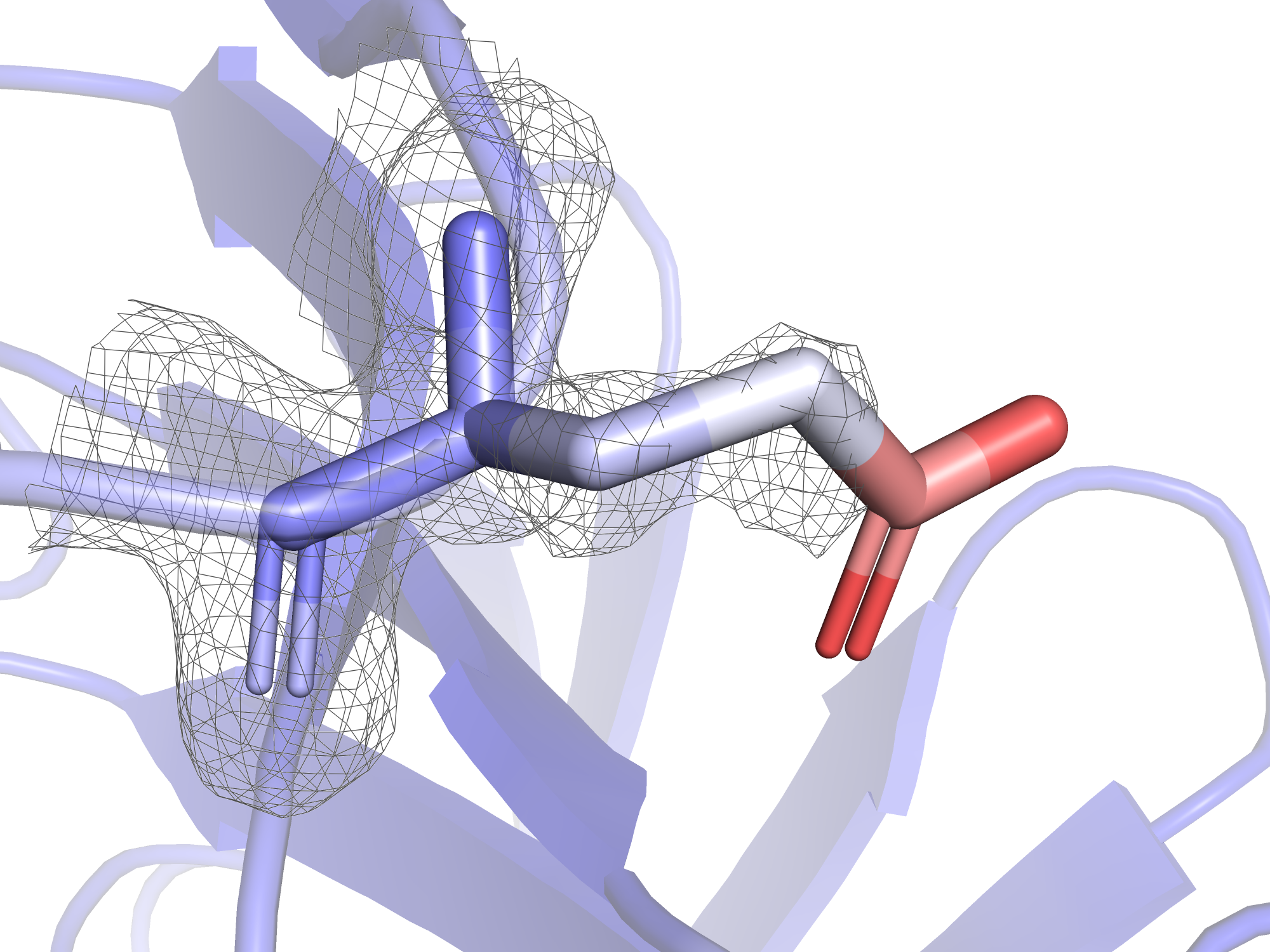
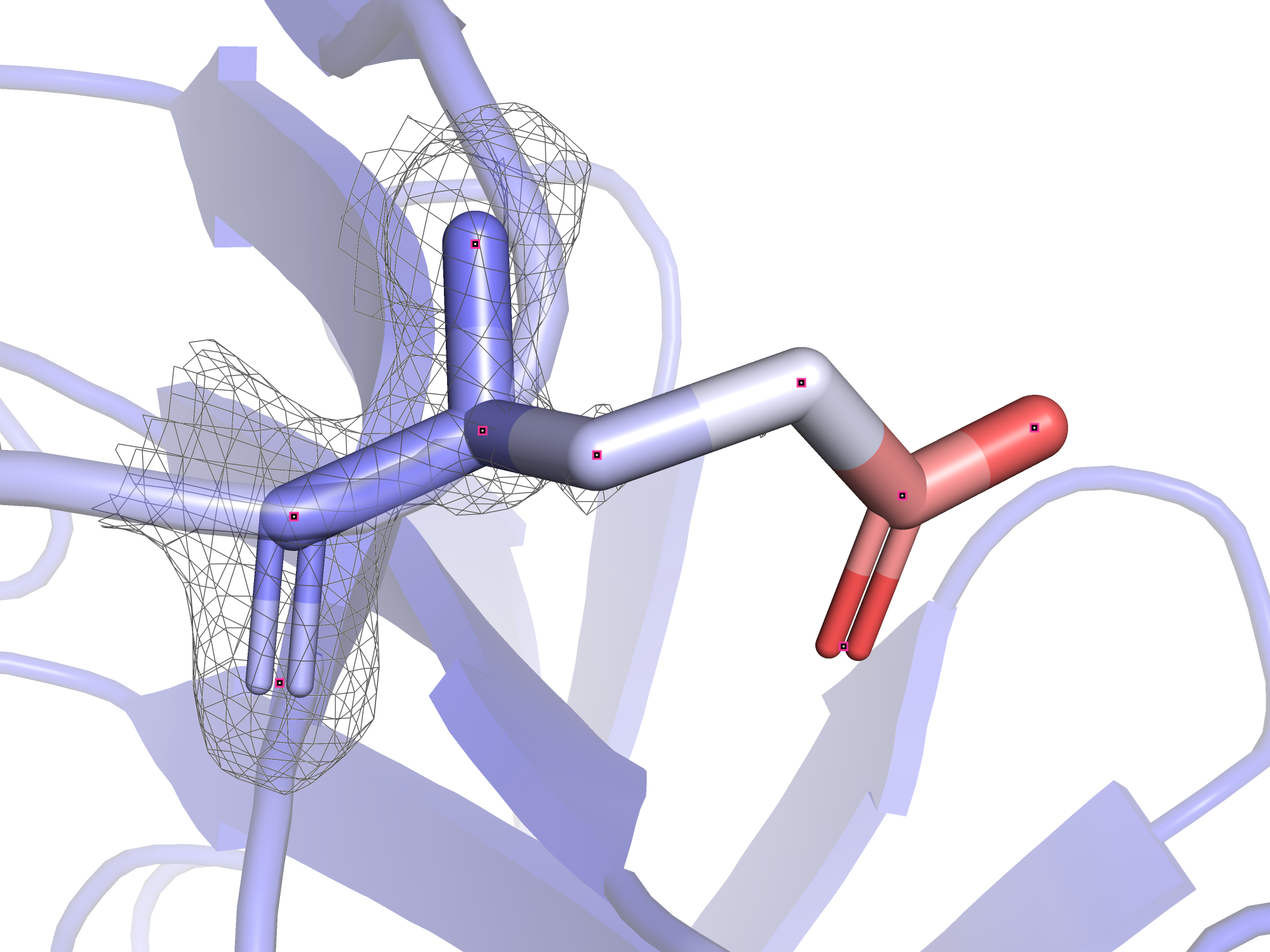
Итак, можно сделать вывод, что высокий В-фактор обычно имеют атомы участков, не имеющих вторичной структуры, а так же участков, лежащих на поверхности белка. Если подключить к раскраске по В-фактору радикалы, оказывается, что радикалы на поверхности белка особенно подвижны. Связь между В-фактором и уровнем подрезки электронной плотности будет рассмотрена на примере глутамата-128. Его остовные атомы имеют относительно низкий В-фактор, а атомы радикала "краснеют" (т.е. становятся всё более лабильными) к концу.
 |
 |
 |
 |
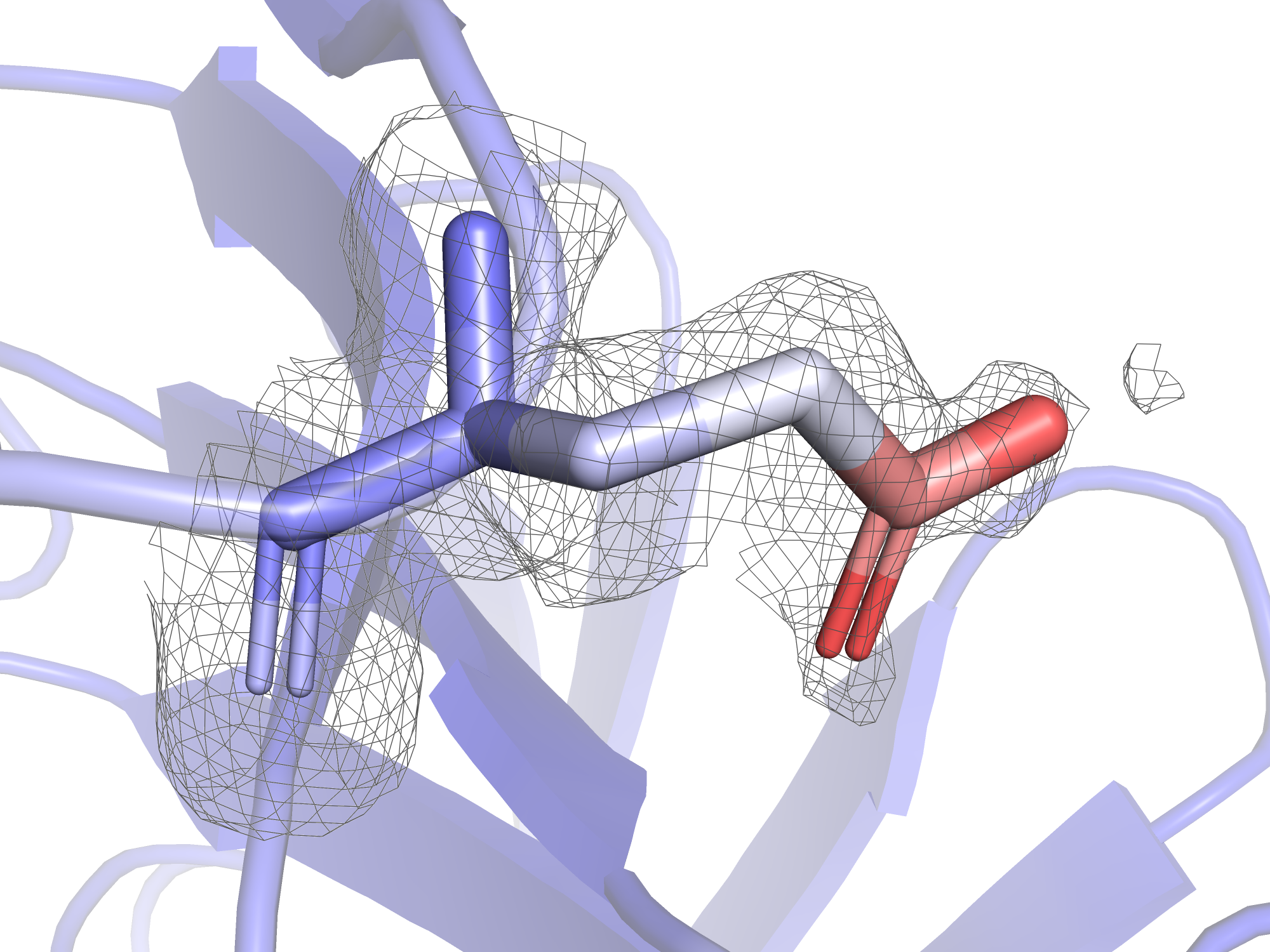
| Рис.4. Glu-128, уровень подрезки 0.5 | Рис.5. Glu-128, уровень подрезки 0.7 | Рис.6. Glu-128, уровень подрезки 1.0 | Рис.7.Glu-128, уровень подрезки 1.5 |
На рисунках 4-7 представлены электронные плотности с разными уровнями подрезки вокруг глутамата-128. В практикуме 1 было показано, что при увеличении уровня подрезки дольше остаются покрытыми электронной плотностью те атомы, у которых больше электронов: кислород, азот, ароматические системы. На примере глутамата-128 видно, что это соображение про количество электронов менее важно, чем В-фактор: при увеличении уровня подрезки электронная плотность "сползает" бысрее с тех атомов, у которых В-фактор больше. Это логично: электронная плотность - это плотность вероятности того, что электрон находится в этой области, суммарно интеграл плотности вероятности должен быть равен количеству электронов (в случае одного атома), поэтому при размазывании плотности по большей области пространства плотность в отдельных небольших участках становится меньше, и поэтому срезается при меньших уровнях подрезки. Так, на уровне подрезки 1.0 электронная плотность не покрывает карбоксильную группу, но покрывает другие углероды радикала. Карбоксильная группа имеет очень высокие значения В-фактора (45 у углерода, 52 у кислородов), она покрыта электронной плотностью только при уровне подрезки 0.5 и менее.
Функция symexp позволяет сгенерировать соседей молекулы белка и расположить их так, как они распологаются в кристалле. На рисунке 8 представлены 7 молекул белка, образующие в кристалле один слой (окрашены красным) и одна молекула белка, лежащая в следующем слое (окрашена малиновым). На таком рисунке можно рассмотреть, как устроена структура кристалла: внутри одного слоя все белки ориентированы одинаково (бета-слои красные, маленькие голубые спирали во всех красных копиях белка смотрят одинаково влево). В следующем слое, представленном малиновой молекулой, все копии белка ориентированы в другую сторону (голубые альфа-спирали смотрят вправо).
 |
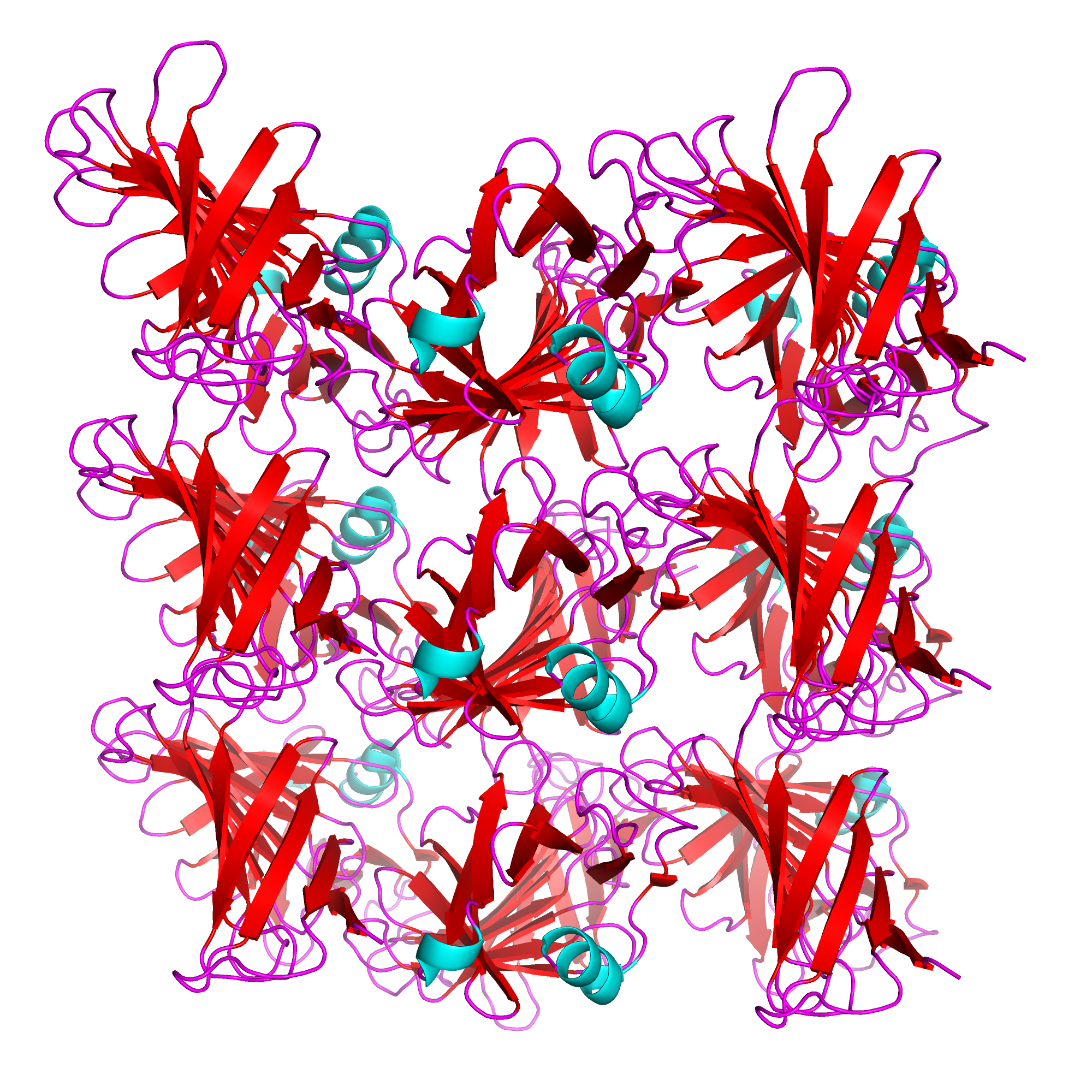 |
| Рис.8. Один "продольный слой" кристалла 6AIS. | Рис.9. Взгляд "с торца". |
На рисунке 9 представлен вид части кристалла "с торца", т.е. со стороны узкой части молекул белка. Видны 9 молекул, из которых 3 молекулы (центральный слой, ориентирован на картинке сверху-вниз) ориентирован одним способом (голубыми альфа-спиралями на зрителя), а 6 других молекул (левый слой из трёх молекул и правый из ещё трёх) ориентирован по-другому (альфа-спиралями от зрителя).
Таким образом, можно посчитать соседей центрального белка: внутри одного продольного слоя у него есть 6 соседей (см. рисунок 8: слева, справа, снизу, сверху, слева-сверху и справа-снизу). При взгляде "с торца" из этих шести соседей видны только двое (на рисунке 9 исходная молекула по центру, она окружена восемью соседями, из которых двое (сверху и снизу от центральной) уже посчитаны,получается, что всего у молекулы белка в таком кристалле 6 + 8 - 2 = 12 соседей. На рисунке 10 я попыталась показать в виде поверхностей, как соседи окружают центральный белок: центральный белок покрашен по элементам, окружающие его 8 соседей (аналогичных рисунку 9) покрашены цветами радуги, четверо соседей "с торца" - разными оттенками серого. Но чтобы посчитать соседей, удобнее использовать рисунки 8-9.
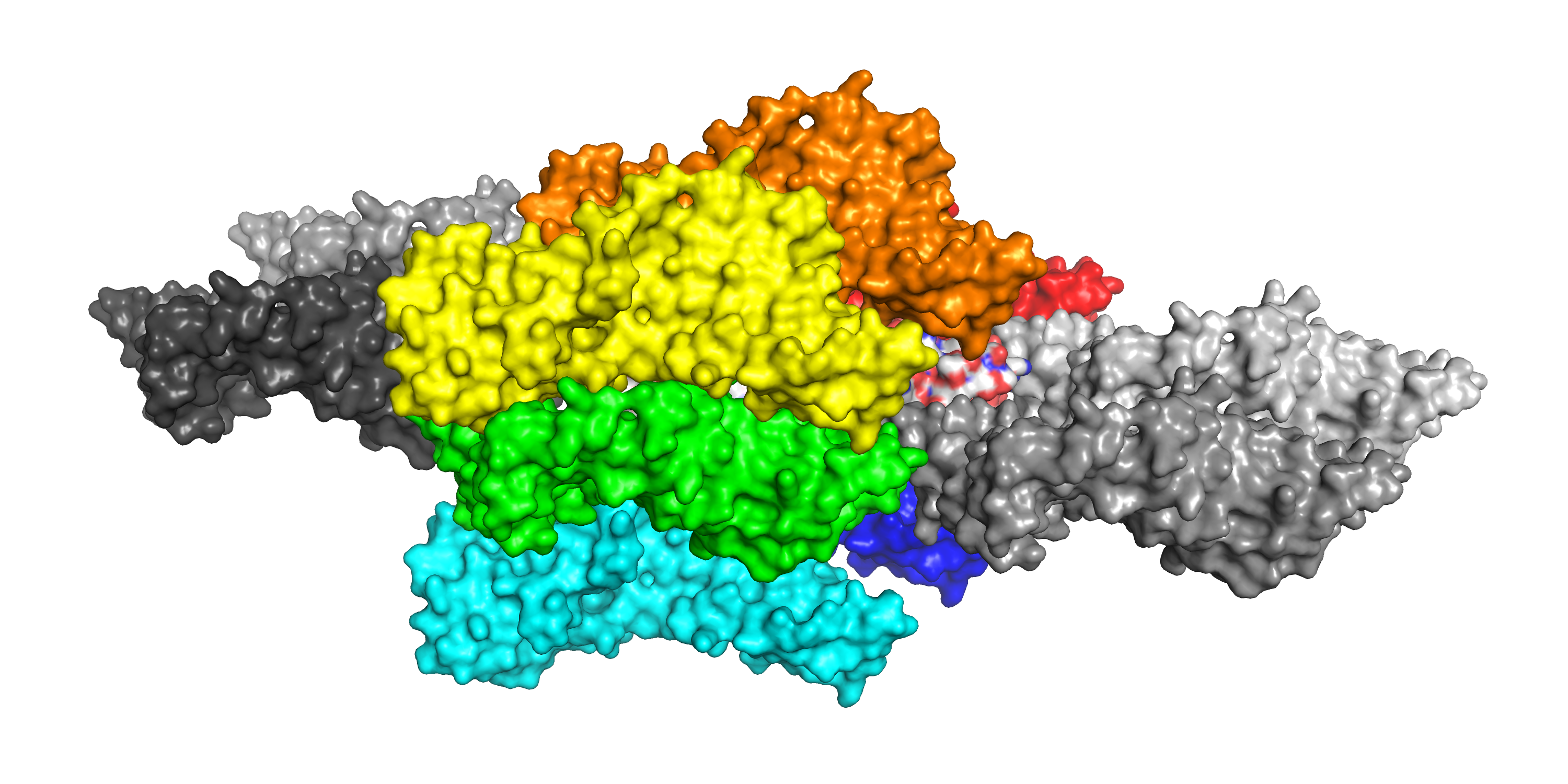
Рис.10. 6AIS (покрашена по элементам, в центре) и её соседи в кристалле.
Вернуться на страницу 7 семестра
© potapenko 2017-2021