В данном практикуме сравниваются две структуры одного белка, полученные разными методами. Название фермента - дигидрофолатредуктаза (DHFR), выделенная из галофильной археи Мёртвого моря Haloferax volcanii. Структура, полученная методом РСА, имеет pdb_id = 1VDR и разрешение 2,55 ангстрем. Структура, полученная методом ЯМР, соответствуеет pdb_id = 2ITH, в файле приведено 20 конформеров.
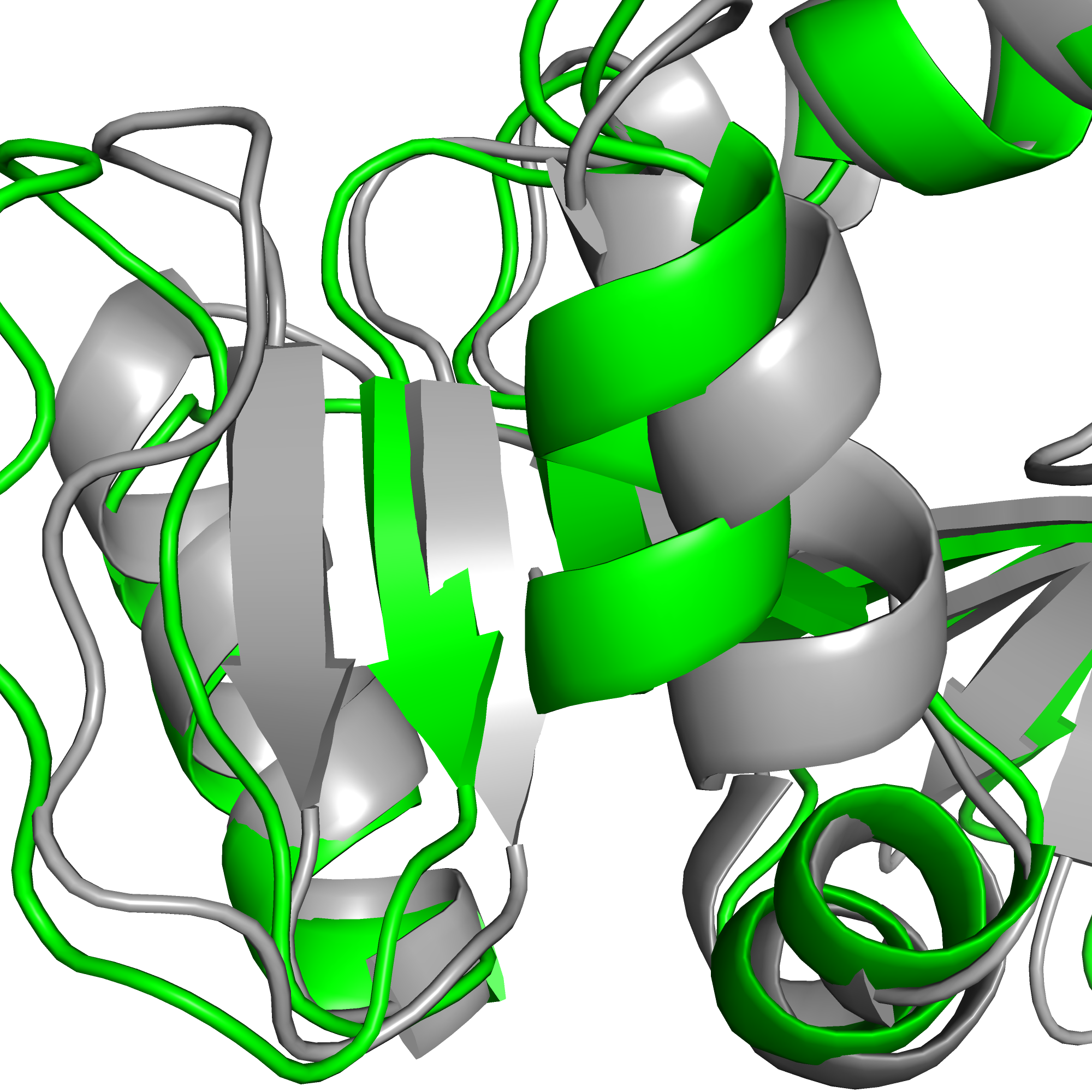
На рисунке 1 приведены все 20 ЯМР-конформеров (покрашены серым), выровененные с РСА-структурой (покрашенной по В-фактору, синий соответствует низким значениям, теплые цвета - высоким). Чтобы отобразить все конформеры, в PyMol нужна команда set all_states, on . Видно, что в целом структуры, полученные двумя методами, очень похожи: и бета-лист, и 4 альфа-спирали хорошо накладываются друг на друга. Но есть и различия: например, оба конца белка в РСА-структуре не попадают в спектр, образуемый концами конформеров ЯМР-структуры. Возможно, это связано с тем, что в данной ЯМР-структуре концы белковой цепи длиннее (N-конец на один а.о., С-конец - на 4 а.о.).
Рис. 1. Наложенные структуры, pdb_id = 2ITH (ЯМР, серая), 1VDR (РСА, покраска по В-фактору).
Видно, что в целом участки белка, образующие бета-слой, совпадают лучше: бета-слой разных конформеров сливается между собой, а разброс между бета-слоем ЯМР-структуры и бета-слоем РСА-структуры совсем небольшой, во многих местах этот участок РСА-структуры попадает между разными конформерами.
Различия в спиральных участках чуть больше: спирали конформеров почти сливаются между собой, но спирали структур, полученных разными методами, не совпадают. Особенно это видно на примере спирали, на рисунке 1 находящейся на рисунке справа сверху. Расстояние между спиралями там составляет несколько ангстрем (в середине спирали меньше, чем по краям).
В неструктурированных петлях разброс между конформерами ещё больше, разброс между конформерами большой, а петли РСА-структуры имеют форму, совсем не похожую на форму петель ЯМР-структуры. В целом, кажется, что количество различий между структурами зависит не напрямую от вторичной структуры этого участка, а от В-фактора. В-фактор, как уже отмечалось в практикуме 2, связан с температурной подвижностью соответствующего участка в кристалле. Можно предположить, что те участки, которые более подвижны в кристалле, могут быть более подвижными и в растворе, что приведёт к большему разбросу между этими участками в конформерах. Например, на рисунке 1 на переднем плане снизу видна петля, которая вроде бы и не является вторичной структурой, но имеет относительно низкий В-фактор и структуры, полученные двумя методами, хорошо совпадают. А некоторые альфа-спирали имеют меньший В-фактор и структуры в соответствующих местах совпадают хуже, чем в некоторых петлях.
Может показаться, что бета-листы накладываются друг на друга лучше, чем альфа-спирали, но мне кажется, что это может быть особенностью данного окнкретного белка, а не общей тенденцией: в этом белке бета-лист расположен ближе к центру глобулы и частично окружен спиралями, находящимися близко к поверхности, рядом со структурированными петялми. Поэтому и положение спиралей в разных моделях отличается сильнее, чем бета-листов.
К отличиям на микро-уровне можно отнести:
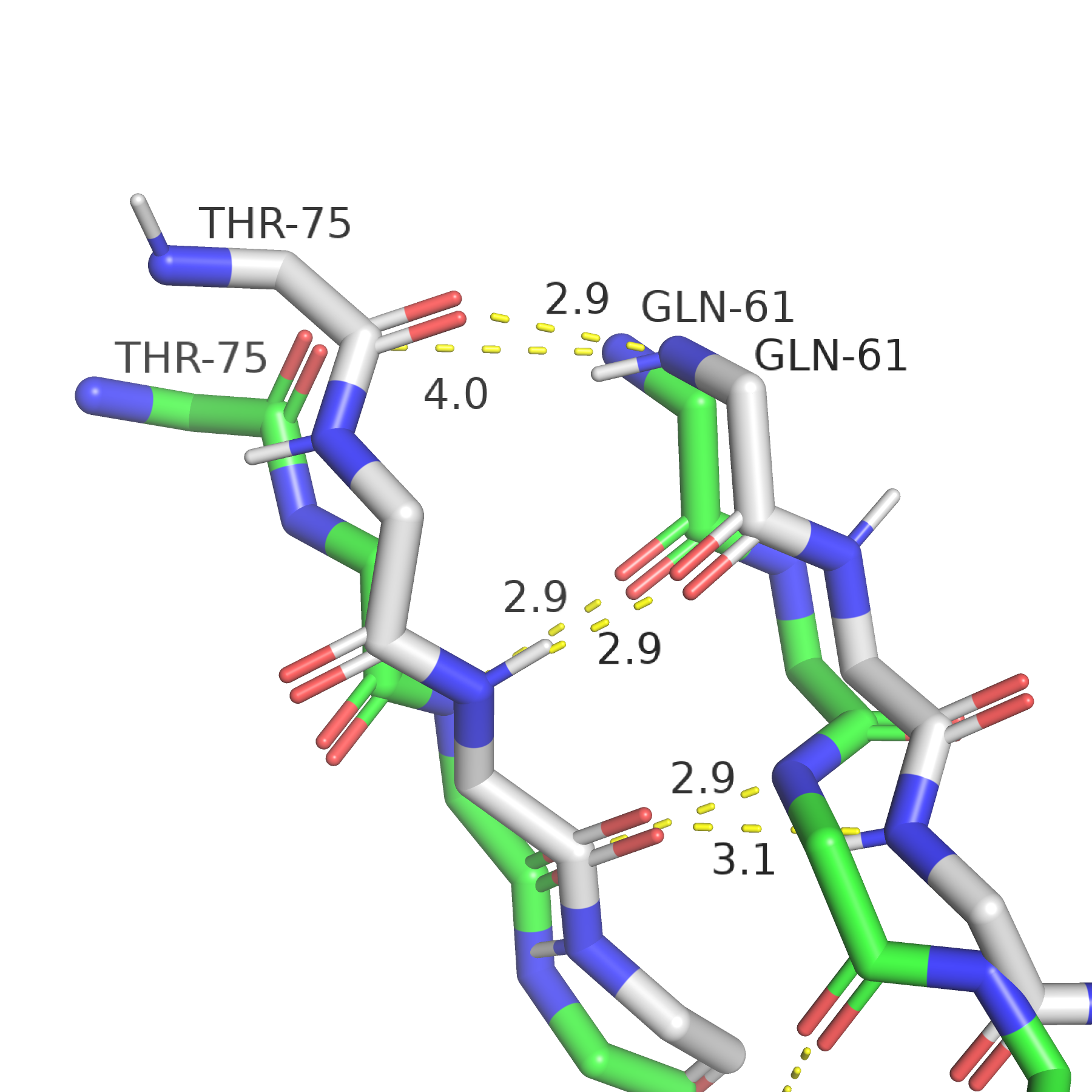
В качестве примера взаимодействий, которые есть в РСА-структуре и котрых нет в ЯМР-структуре, я обратила внимание на цепи бета-листа, приведённые на рисунке 2 (РСА-структура зелёная, ЯМР - серая). Мне показалось странным, что в участок, соответствующий крайней цепи бета-листа в ЯМР-структуре, в РСА-структуре не рассматривается как часть бета-листа и обозначается как неструктурированная петля. На рисунке 3 приведён тот же участок (немного другой ракурс), на котором видно, как цепи РСА-структуры (зелёные) сначала соединены водородными связями (нормальной длины около 3 ангстрем), а затем расходятся: аналогичные атомы в ЯМР-структуре образуют водородную свзяь, а атомы в РСА-структуре находятся на расстоянии 4 ангстрем, так что водородной связи нет и программа не распознаёт цепь как часть бета-листа. Далее эта цепь ещё более отдаляется от аналогичной серой. Мне не удалось найти взаимодействий, которые мешали бы этой цепи приблизиться к бета-листу и образовать связи, возможно, это какой-то артефакт кристаллизации. Более стабильной (и правдоподобной) кажется структура, полученная ЯМР, в которой эта цепь участвует в бета-листе, тем более что все конформеры выглядят похоже в этом месте.
 |  |
| Рис. 2. Различие во вторичной структуре: общий вид. | Рис. 3. Различие во вторичной структуре: наличие водородной связи. |
Цель данного задания - проверить предположение, что В-фактор остатка (для РСА-структуры) связан с RMSF этого же остатка в ЯМР-структуре. График на рисунке 4 построен по 156 остаткам (из последовательности длиной 162 у ЯМР-структуры были убраны несколько концевых остатков, которых нет в РСА-структуре, и исключён один остаток-мутация).
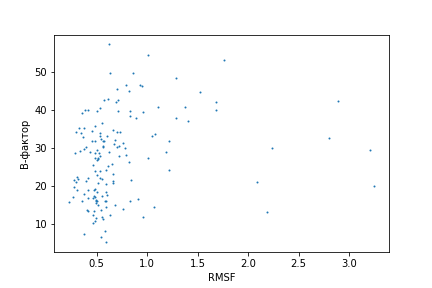
Рис. 4. Зависимость среднего В-фактора остатка от RMSF.
В целом, можно сказать, что большим значениям RMSF чаще соответствуют большие значения В-фактора. Действительно, наличие монотонной зависимости подтверждается значимым (1е-5) коэффициентом корреляции Спирмена, равным 0.34. Зависимость не очень похожа на линейную (на всякий случай я посчитала коэффициент линейной корреляции Пирсона, оснований пологать, что линейная зависимость есть, недостаточно (p-value коэффициента = 0.1).
Грубо говоря, RMSF объясняет (в том числе) подвижность структуры, исследуемой методом ЯМР (насколько конформеры отличаются друг от друга), а В-фактор связан с подвижностью структуры, исследуемой методом РСА. Наличие монотонной зависимости между ними говорит о том, что эти два метода считают подвижными одни и те же элементы структуры (т.е. что одни и те же элементы структуры наиболее подвижны и в растворе, и в кристалле). Большой разброс точек говорит о том, что RMSF может являться показателем различий между конформерами, не связанных с подвижностью, а связанных с неполнотой модели.
На графике (рисунок 4) видно, что RMSF большинства остатков маленький (меньше 1.5). Думаю, это связано, в том числе, с тем, что в этом анализе не учитывались остатки из С-конца (образующие "метёлку", и, следственно, имеющие очень большие RMSF), а в остальном в струтуре мало неструктурированных участков, большинство петель не очень длинные. RMSF > 2 имеют всего семь остатков. Мне стало интересно, что это за остатки, и я решила найти их на графике. Как я и ожидала, эти остатки принадлежат к петлям (на рисунке 5 положение остатков 65-68 выделено красным, положение остатков 123-125 - оранжевым). Однако, нельзя сказать, что эти участки петель как-то сильно отличаются от других участков петель, хотя сооветствующие семь точек на графике кажутся выбивающимися из общей массы.
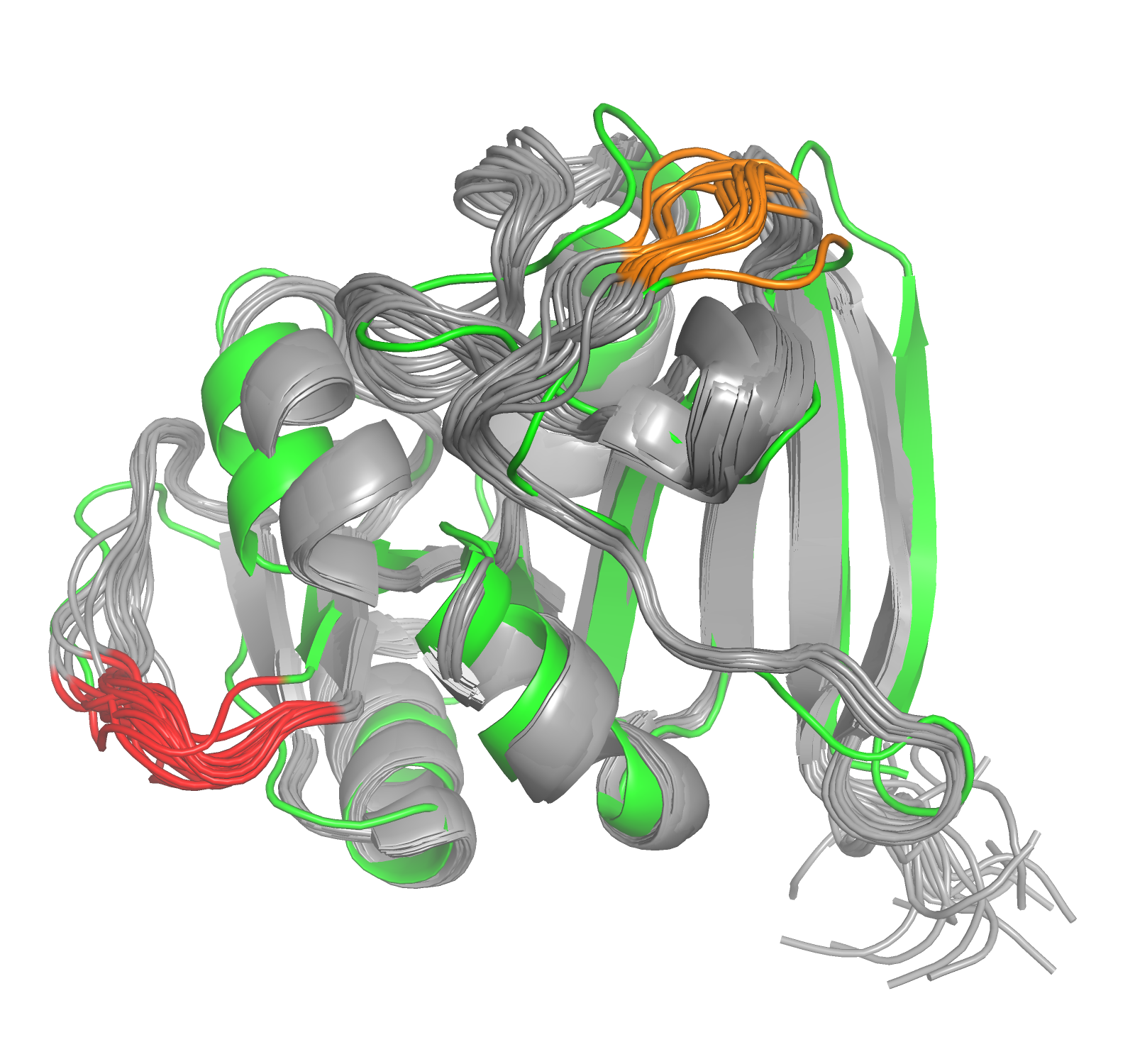
Рис. 5. Остатки с высоким RMSF.
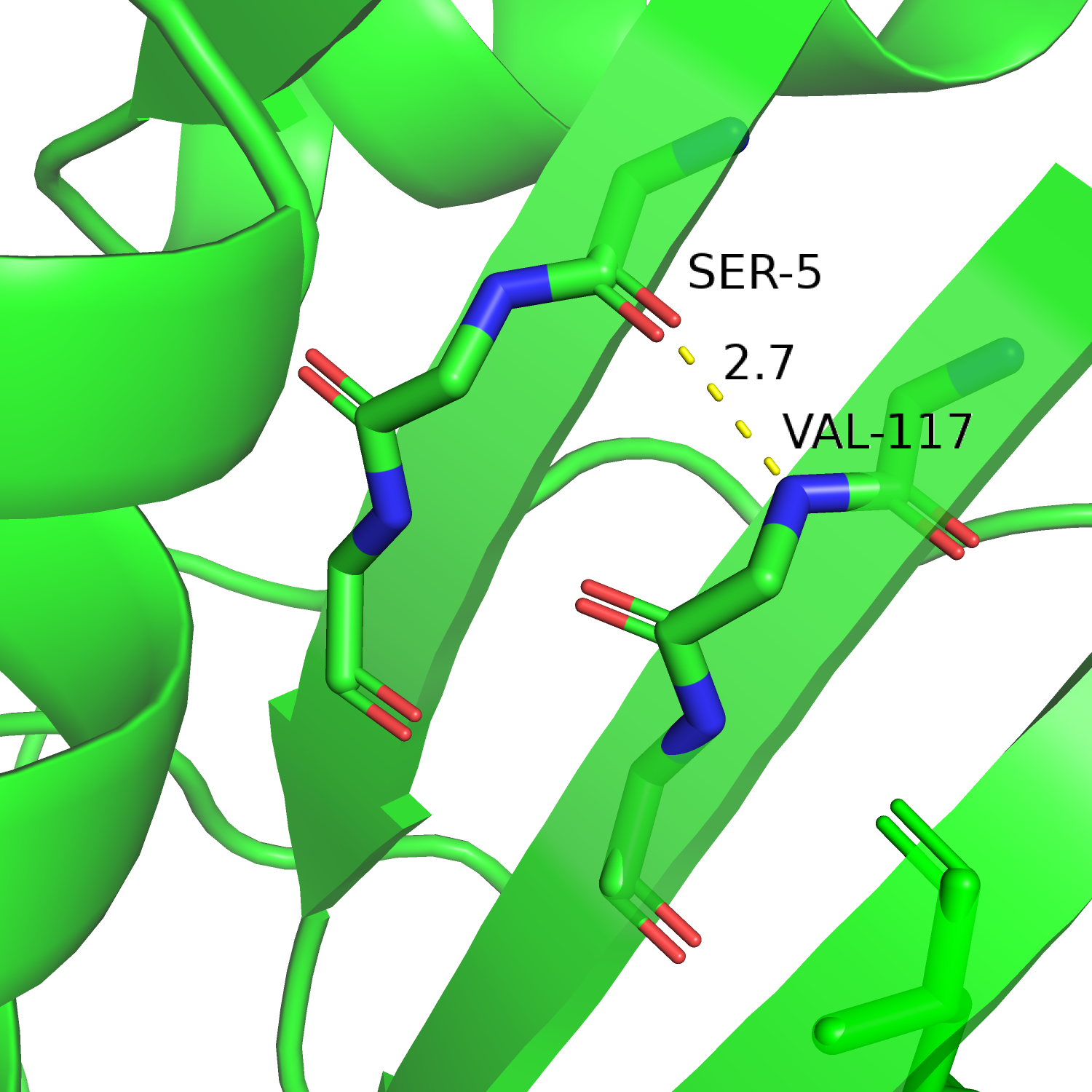
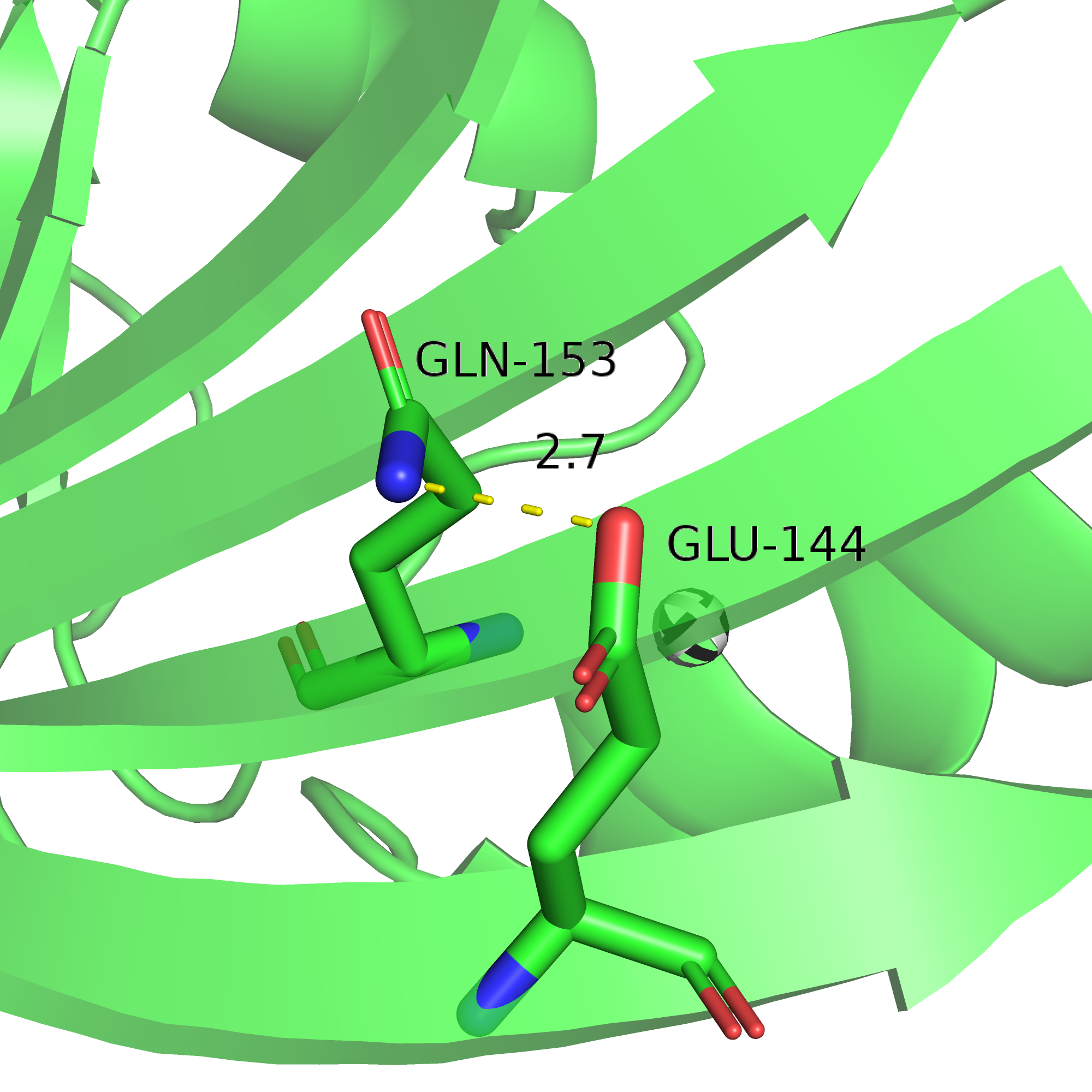
Для измерений были выбраны три водородные связи в разных частях белка: одна связь между остовными атомами в составе вторичной структуре внутри белка, одна - между радикалами а.о., относящихся ко вторичной структуре, и между двумя а.о. в составе петли на оверхности глобулы. Визуализации этих трёх связей представлены на рисунках 6-8, измерения и другая информация приведены в таблице 1.
Примечание: чтобы измерить расстояние во всех конформерах, нужно отключить отображение всех конформеров (set sll_states, o), создать объект измерения, а потом переключаться между конформерами. Наверное, это же можно сделать по-умному, используя Prody (искать в файле нужные атомы и считать декартово расстояние между ними), но я делала вручную.
 |
 |
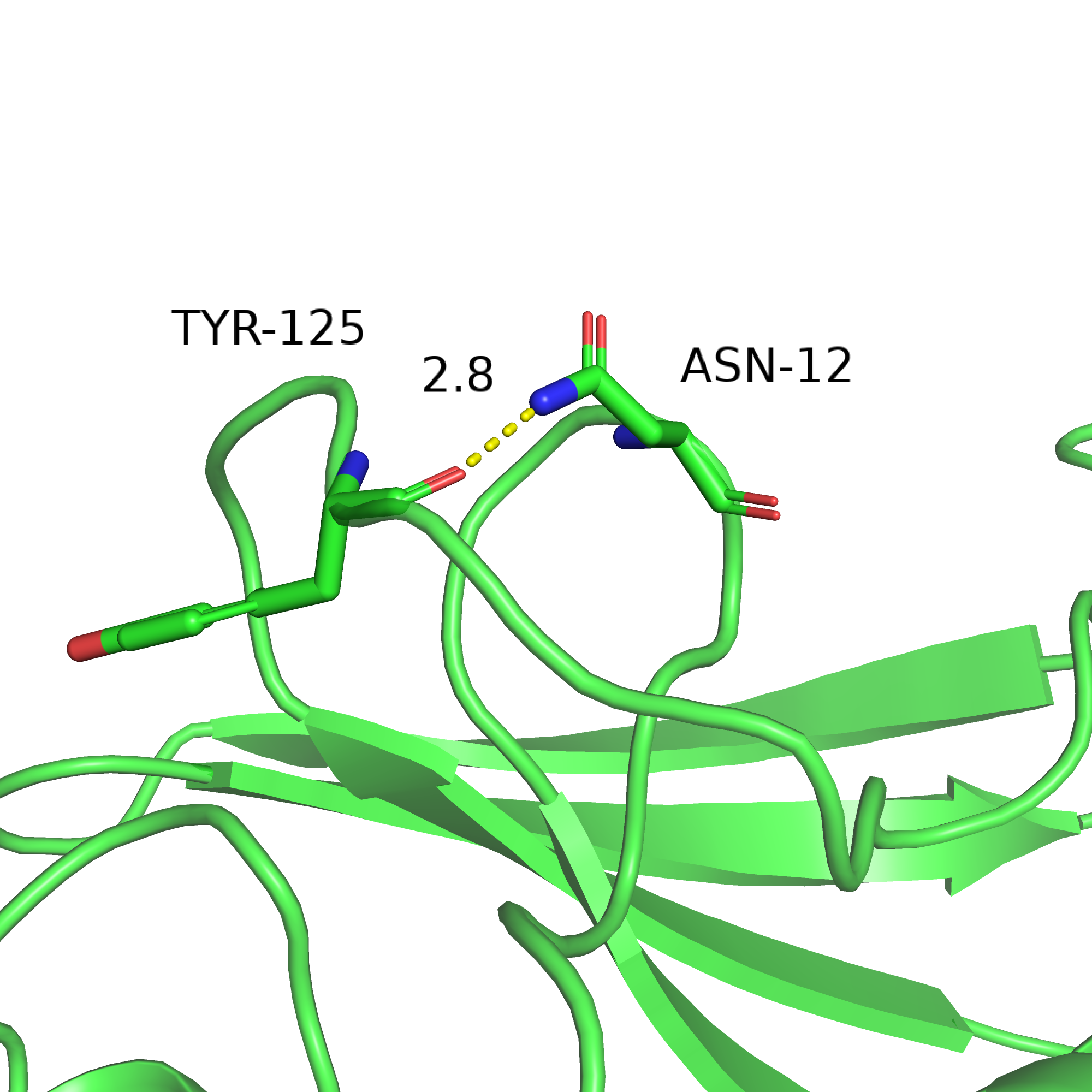 |
| Рис. 6. Cвязь Ser5...Val117 | Рис. 7. Glu144...Gln153 | Рис. 8. Связь Tyr125...Asn12 |
Таблица 1. Сравнение параметров водородных связей в разных частях белка.
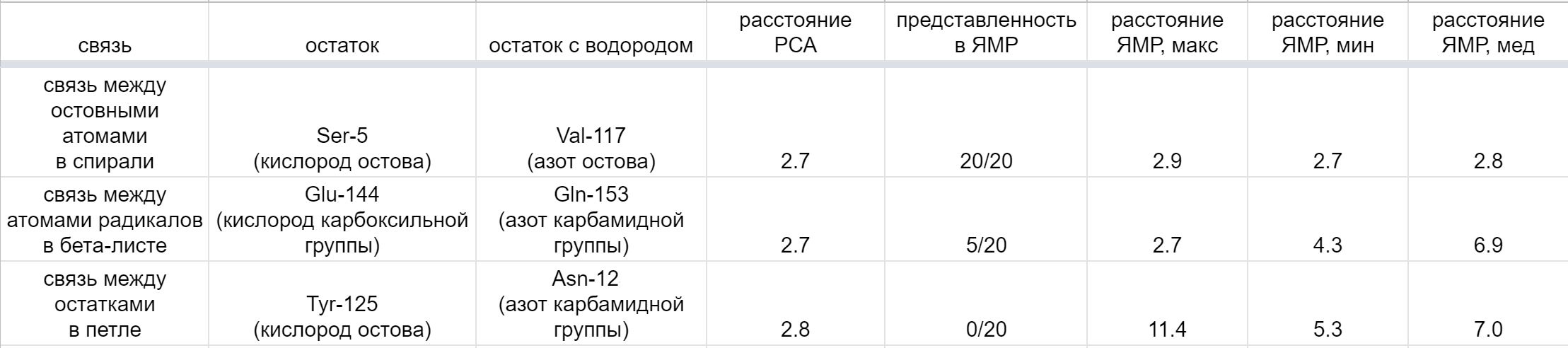
Вполне логично, что водородная связь между остовными атомами (Ser5...Val117) есть во всех конформерах. Как уже обсуждалось выше, вторичная структура, особенно внутри глобулы, вероятно будет иметь низкий MSF, то есть конформеры будут слабо отличаться друг от друга. Насколько я понимаю, вторичные структуры предсказываются точнее (лучше), чем петли, поэтому отличие будет меньше и между конформерами, и между ЯМР-структурой и РСА-структурой. Поэтому связь имеет примерно одинаковые параметры.
Связь между атомами радикалов (Glu144...Gln153) сохраняется только в 5 конформерах из 20. В остальных конформерах радикал отклонён в другую сторону, расстояние получается слишком большим для водородной связи. Это можно объяснить тем, что радикалы более подвижны, чем остов, и тем, что остовные атомы лучше предсказываются по сравнению с атомами радикалов (у остовных атомов более регулярная структура).
Связь между атомами в петле не сохраняется ни в одном из конформеров. Вряд ли статистика из одной связи каждого типа является достаточным подтверждением, но вполне логично предположить, что сходимость результатов ЯМР и РСА (по наличию взаимодействий) лучше всего между атомами остова внутри глобулы, чуть хуже в радикалах в глобуле, самая плохая - на поверхности глобулы, в неструктурированных участках.
Вернуться на страницу 7 семестра
© potapenko 2017-2021