Целью данного задания было воспользоваться программой PoseView на сайте Proteins.Plus, чтобы найти взаимодействия между лигандом и белком в структуре 5REU (главная протеаза коронавируса с ингибитором T4D), и сравнить взаимодействия, найденные автоматически, с взаимодействиями, найденными мной вручную в практикуме 1.
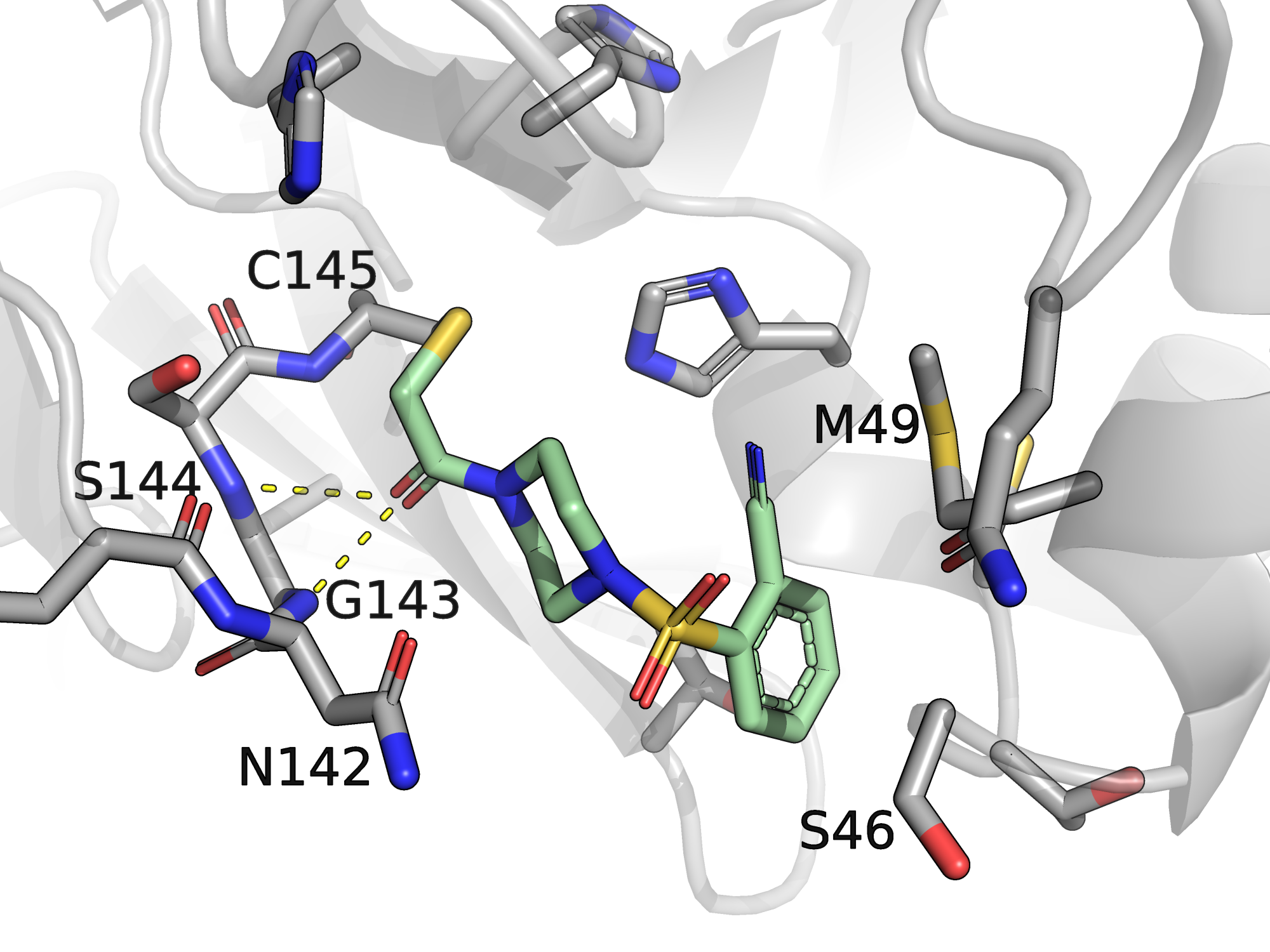
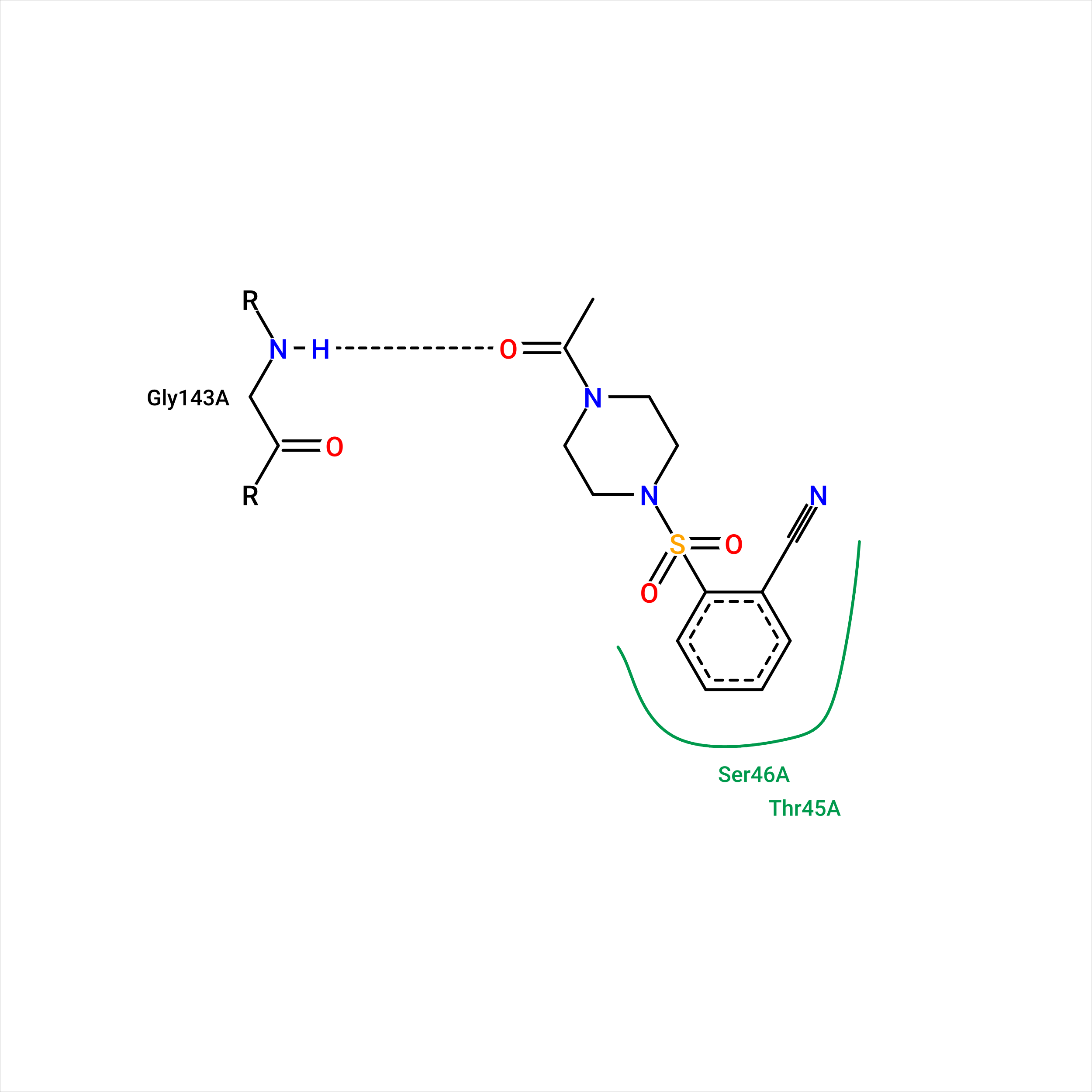
На рисунке 1 приведено изображение взаимодействий, сделанное мной в первом практикуме, без изменений. На рисунке 2 - изображение взаимодействий, сгенерированное программой PoseView (удобно, что изображение плоское, поэтому кажется более понятным).
 |
 |
| Рис. 1. 5REU, взаимодействия, найденные вручную. | Рис. 2. 5REU, взаимодействия, найденные автоматически. |
Вот отличия:
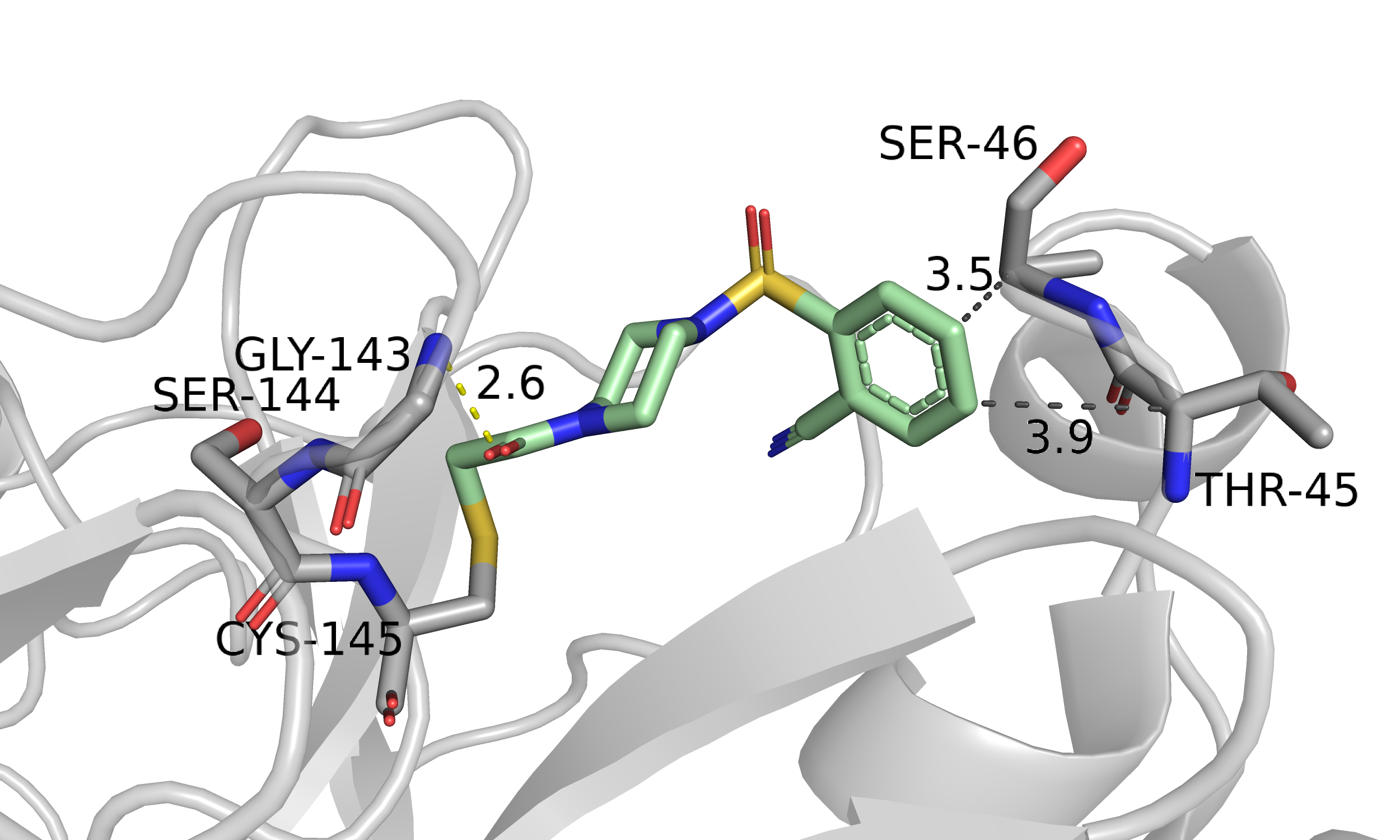
Рис. 3. 5REU, расстояния до гидрофобных участков Ser-46 и Thr-45, с которыми программа нашла взаимодействие.
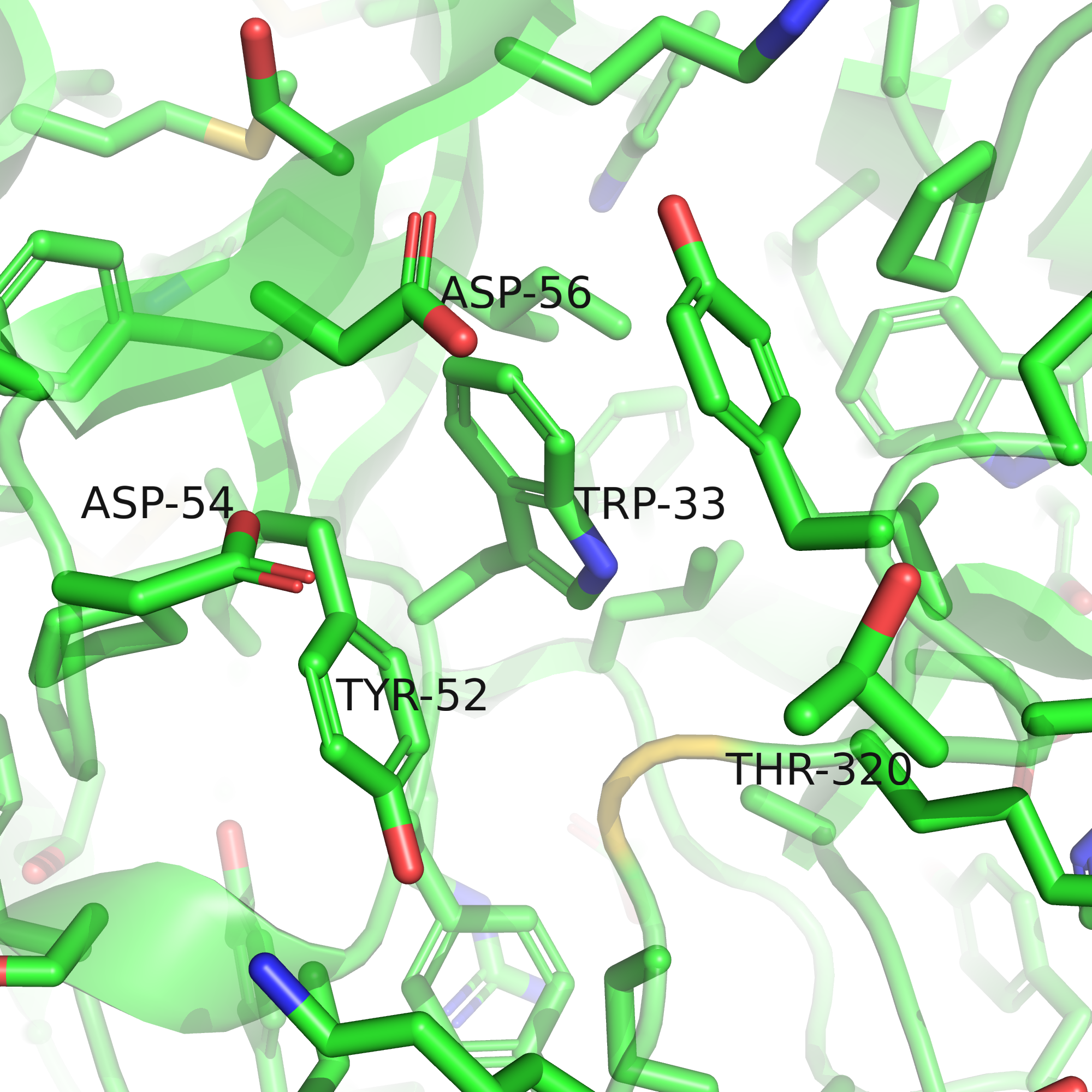
Цель данного задания - попытаться понять по окружению, какой остаток (и какой ротамер этого остатка) был исходно на месте глицина-305 в выданной мне структуре. Я решила не перебирать все остатки, а попытаться по форме и составу кармана угадать, каким этот остаток должен быть. На рисунках 4-5 представлен карман, в сторону которого должен лежать радикал 305го остатка (сам остаток покрашен золотым). На рисунке 4 по форме поверхности можно предположить, что радикал должен быть достаточно крупным, чтобы заполнить собой "дыру", образуемую тирозином-52 (левая стенка дыры), аспартатами-54 и -56 (верх дыры). Большая часть этой послоти гидрофобная, туда хорошо бы "положить" длинную (СН2)-часть радикала, чтобы образовать гидрофобные взаимодействия с тирозином-52; а на краях дыры есть кислороды аспартатов, с которыми можно было бы образовать водородные связи или ионный мостик. Так появляется про крупные радикалы с положительным зарядом на конце (аргинин и лизин, можно также посмотреть в сторону гистидина).
Возможно также, что в исходной структуре вот эта дыра - просто дыра, и радикал какой-то маленький и образует, например, водородную связь с азотом триптофана-33. Я попробовала этот вариант, но азот триптофана-33 находится слишком сбоку от остатка-305, чтобы до него дотянуться, радикалу нужно сильно изогнуться, вписывается плохо. Поэтому я вернулась к основному варианту - про аргинин и лизин.
 |
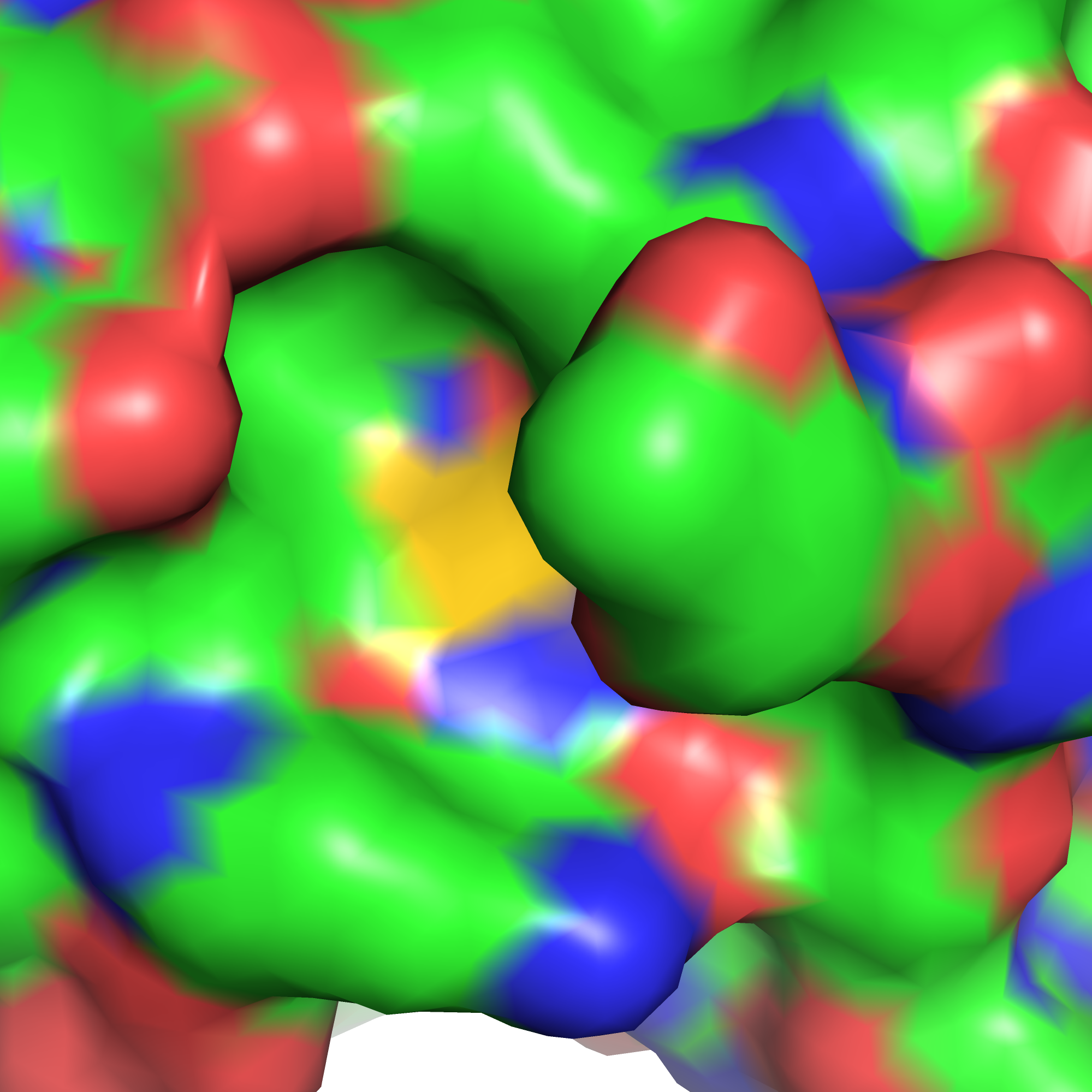 |
| Рис. 4. Карман, куда должен смотреть остаток 305. | Рис. 5. Поверхность кармана, куда должен смотреть остаток 305. |
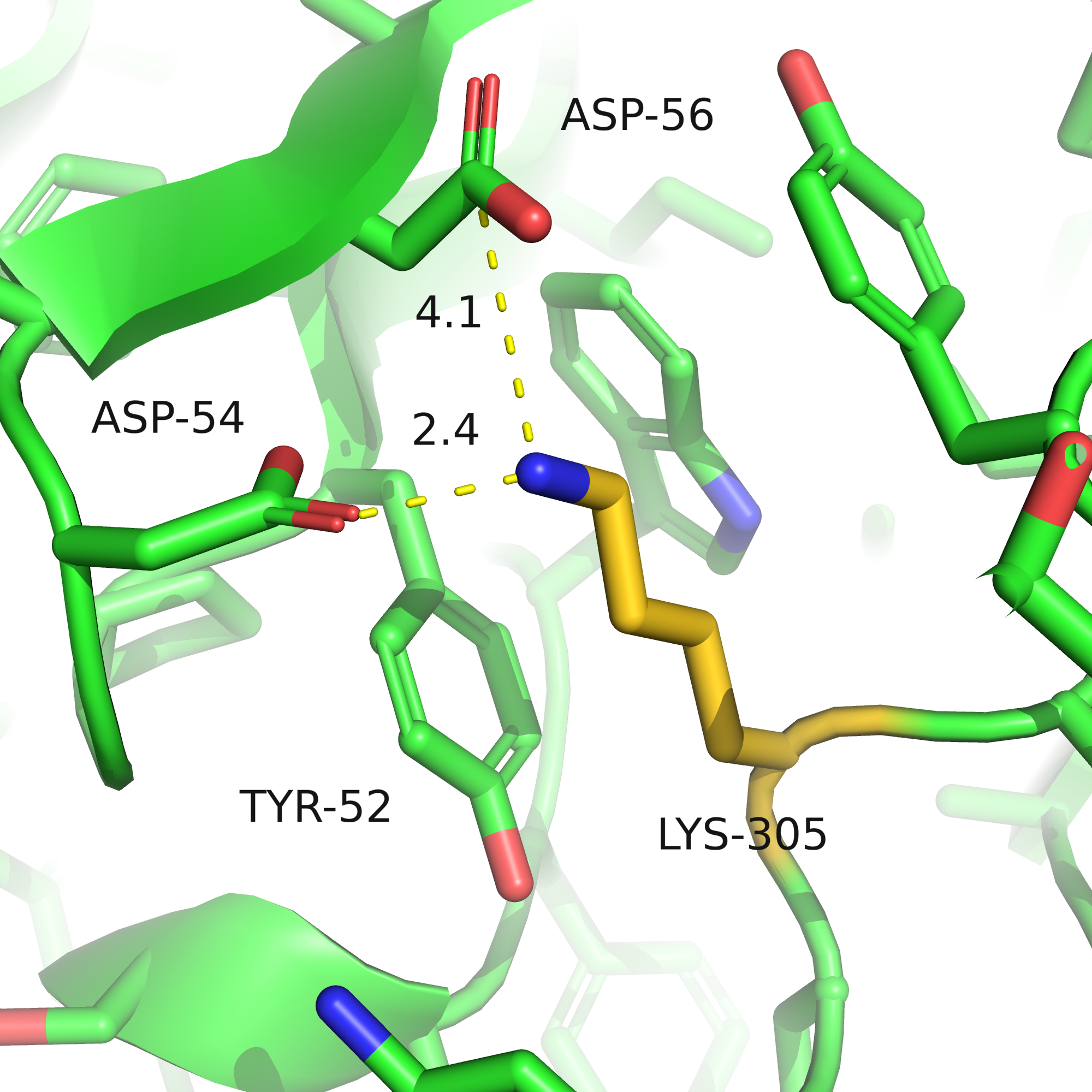
У лизина хорошо вписывался ротамер под номером 2, этот вариант в принципе кажется мне очень удачным: углероды радикала лежат параллельно кольцу тирозина и могут образовывать гидрофобные взаимодействия, а аминная группа на конце радикала может образовывать ионные мостики с обоими аспартатами и водородную связь с одним из них (аспартат-56 чуть далековато). При этом напряжения почти не создаётся (strain=16).
 |
 |
| Рис. 6. LYS-305, ротамер 2, расстояния до аспартатов. | Рис. 7. Вид поверхности, вписан ротамер 2 LYS-305. |
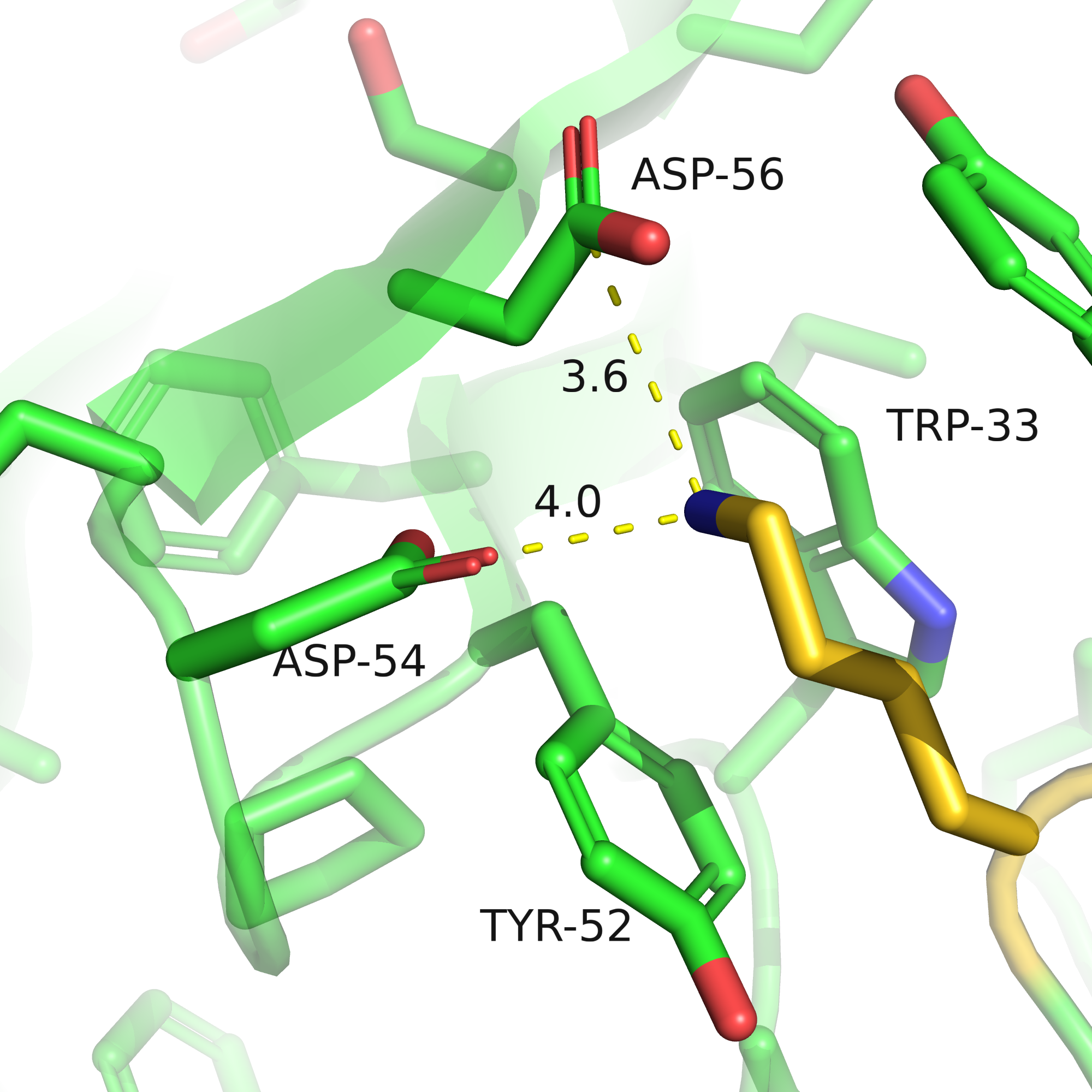
У лизина есть ещё один похожий ротамер (номер 9), отличие от предыдущего только в последнем звене: у девятого ротамера аминная группа лизина направлена вниз к стенке дыры, и "прячется" под карбоксильные группы аспартатов. При этом она оказывается на примерно равном расстоянии от функциональных групп аспартатов (а не ближе к 54му, как во втором ротамере), и для образования водородных связей оказывается далековато, но может образовывать ионный мостик с каждым аспартатом. Но при этом аминная группа лизина не показывается на поверхность, и поверхность получается более гидрофобная, что конечно является минусом этого ротамера в применении к этому карману. Ротамер 9 также проигрывает по представленности ротамера в базе данных: у 9го представленность 2.7%, у 2го - 11.5%.
 |
 |
| Рис. 8. LYS-305, ротамер 9, расстояния до аспартатов. | Рис. 9. Вид поверхности, вписан ротамер 9 LYS-305. |
Также я попробовала аргинин вместо лизина. Наиболее хорошо вписывался ротамер аргинина, идущий так же, как ротамеры лизина (почти совпадая с ними по 3м углеродам радикала), но он более длинный, и если лизин хорошо "дотягивался" до двух аспартатов, то аргинин либо упирался в них, создавая большие значения strain, либо оказывался слишком далеко от них, чтобы взаимодействовать. Также я попробовала гистидин, но он получается слишком коротким.
В целом, мне кажется, что моя первая догадка про лизин - наиболее правильная: он образует ионные мостики (в случае со вторым ротамером, ещё и водородную связь), имеет гидрофобные взаимодействия со стенками кармана, не создаёт напряжение. Но в случае с лизинами меня смущает нависающий выступ, образованный треонином-320. Этот навес виден на рисунках 7 и 9, на рисунке 9 по форме тени видно, как он возвышается над карманом. Мне кажется, что одиночный остаток, даже гидрофильный, не должен в норме так сильно выступать из белка (если это не какая-то область связывания и эта полость не используется для связывания чего-то еще). Я пыталась подобрать какой-нибудь радикал, чтобы он дотянулся до этого выступа, но все радикалы либо оказываются короткими, либо располагаются так неудачно, что не образуют взаимодействий с этим треонином. Аспартаты при этом тоже оказываются без взаимодействий. Так что, я всё же думаю, что остаток 305 - это лизин, ротамер 2 или 9.
На рисунке 10 приведёно окружение мутированного остатка, сам мутированный остаток покрашен зелёным, радикал заменён на метил, чтобы было примерно понятно, куда радикал должен смотреть. Мутированный остаток принадлежит к цепи, идущей параллельно бета-листу, но уже не распознаётся программой как бета-лист, т.к. лежит далековато и классических для бета-листа водородных связей между атомами остова уже нет. Сперва я решила, что радикал мутированного остатка должен быть полярным и не очень крупным, чтобы как раз и образовать связи с атомами остова или радикалов соседней цепи бета-листа. Моё предположение подкреплялось тем, что до остатков из других цепей достаточно далеко (на рисунке 10 показаны расстояния до следующей цепи бета-листа и до неструктурированной петли из другой цепи).
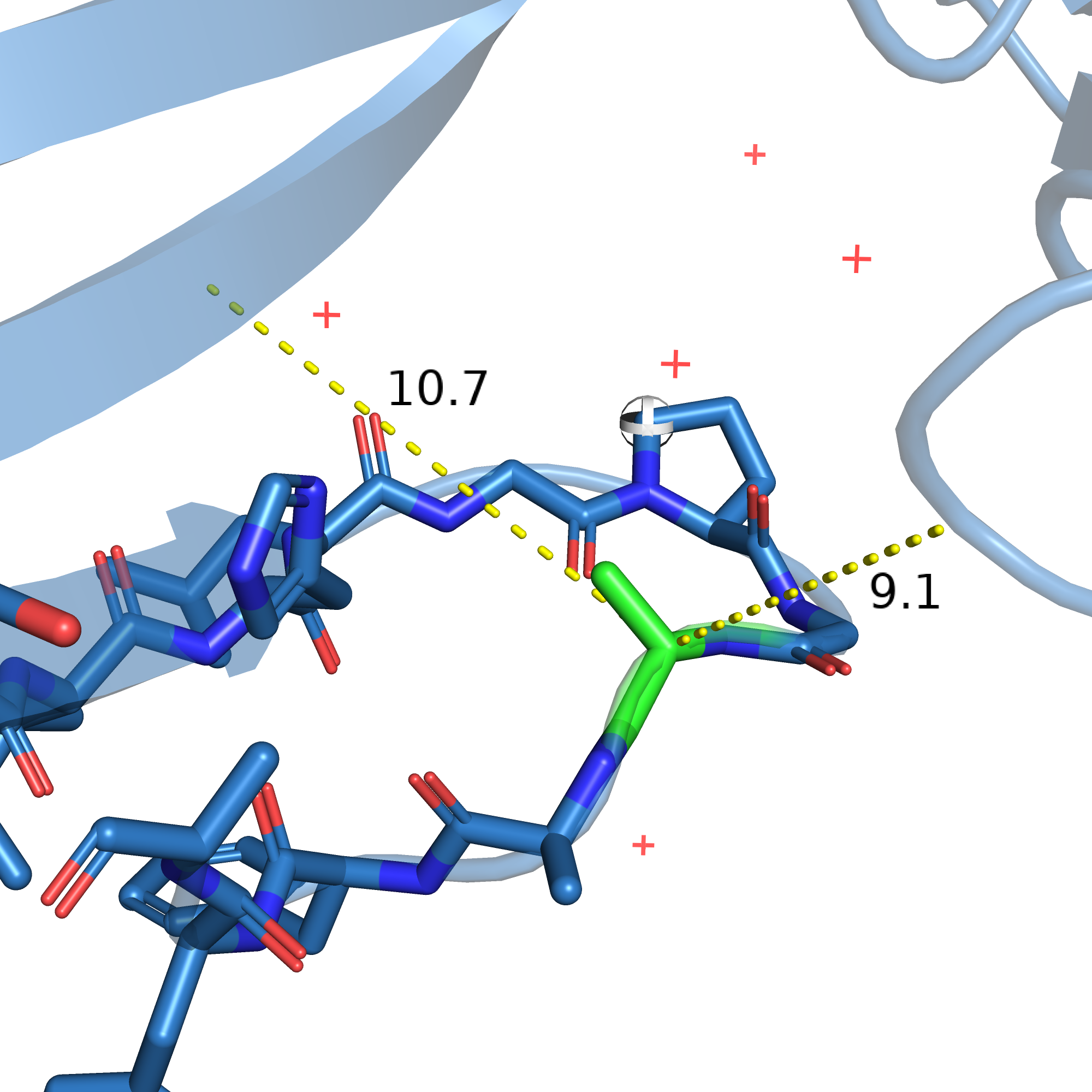
Рис. 10. Окружение мутированного остатка 315 (выделен зелёным).
Однако, когда я начала перебирать некрупные полярные остатки, получалось, что взаимодействовать им особо не с чем. Я решила обратить внимание на последовательность этой цепи и соседних цепей бета-листа, и оказалось, что среди них очень много остатков с ароматическими кольцами. Так, например, следующая цепь бета-листа содержит 5 тирозинов подряд. Я также заметила, что с разных краёв кармана есть две ароматические системы (тирозин-100J и триптофан-33 из петли), практически параллельные друг другу, и находящиеся на расстоянии около 7 ангстрем друг от друга. Мне показалось логичным, что если в окружении много ароматических остатков, то логично попробовать вписать радикал, который будет участвовать в стекинге. Кроме того, я помнила, что между соседними основаниями в ДНК примерно 3.4 ангстрема, т.е. расстояние в 7 ангстрем вполне может быть стекингом из трёх колец.
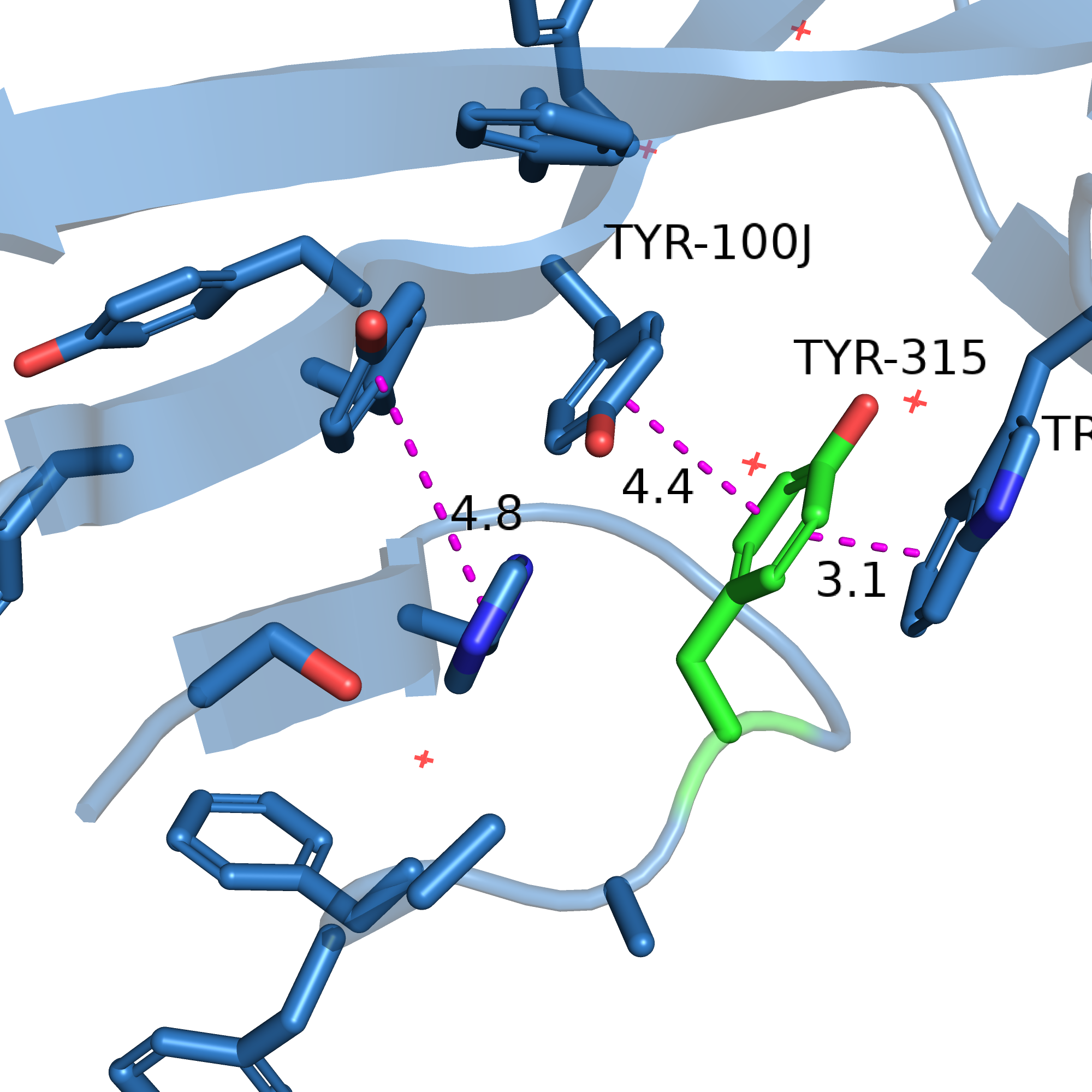
У меня получилось вписать по одному ротамеру тирозина и фенилаланина (см. рисунки 11-12). Мне кажется, что они могут участвовать в стекинг-взаимодействии из Tyr-100J и Trp-33. Расстояние до них почти подходящее: 4.4 ангстрем в одну сторону и 3.1 в другую. 3.1 - это немного маловато, и это создаёт напряжённость (strain = 22 для тирозина и 34 для фенилаланина, что, в общем-то, многовато). Но мне кажется, что реальный остаток может немного отличаться от ротамера углами, и отклонение от правильного угла между связями будет компенсировано двойным стекинг-взаимодействием (показаны фиолетовым на рисунках 11-12).
 |
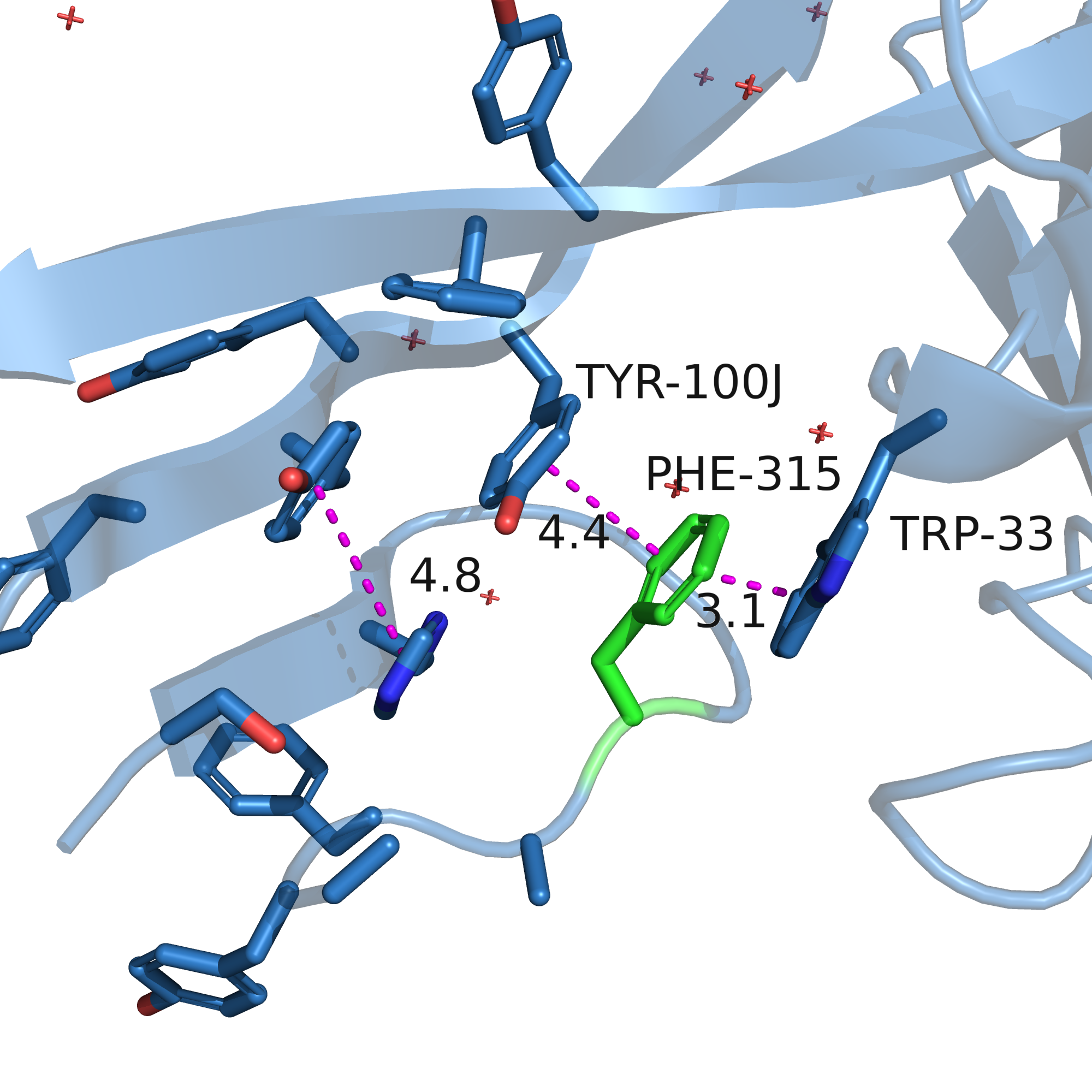 |
| Рис. 11. Остаток 315 мутирован на тирозин. | Рис. 12. Остаток 315 мутирован на фенилаланин. |
У меня нет аргументированного решения, какой остаток (тирозин или фенилаланин) вписывается лучше. Мне кажется, что тирозин: пусть ротамеры тирозина и фенилаланина и идут практически параллельно, напряжённость у первого меньше. Мне не удалось найти атом белка, с которым мог бы образовывать взаимодействие кислород тирозина, но в структуре в кармане указаны молекулы воды, так что этот небольшой гидрофильный участок вполне может быть стабилизирован молекулами воды. Этот ротамер у обоих остатков представлен примерно одинаково, около 82%. Ещё слабым аргументом в пользу тирозина является то, что окружающие области в белке очень богаты тирозинами, а фенилаланинов в них не так много.
Кроме того, я пробовала заменять 215 остаток на какой-нибудь длинный, чтобы "дотянуться" до соседней петли (которая на рисунке 10 справа). Оказалось, что 17й ротамер лизина достаточно хорошо вписывается: заряженной частью он приближается к аспартату-53, так что может образовывать водородную связь и ионный мостик (см. рисунок 13), а гидрофобная часть радикала оказывается в более-менее гидрофобном окружении ароматических колец. При этом напряжение намного меньше, чем у варианта с тирозином, strain = 9. Но вариант с тирозином кажется мне более интересным.
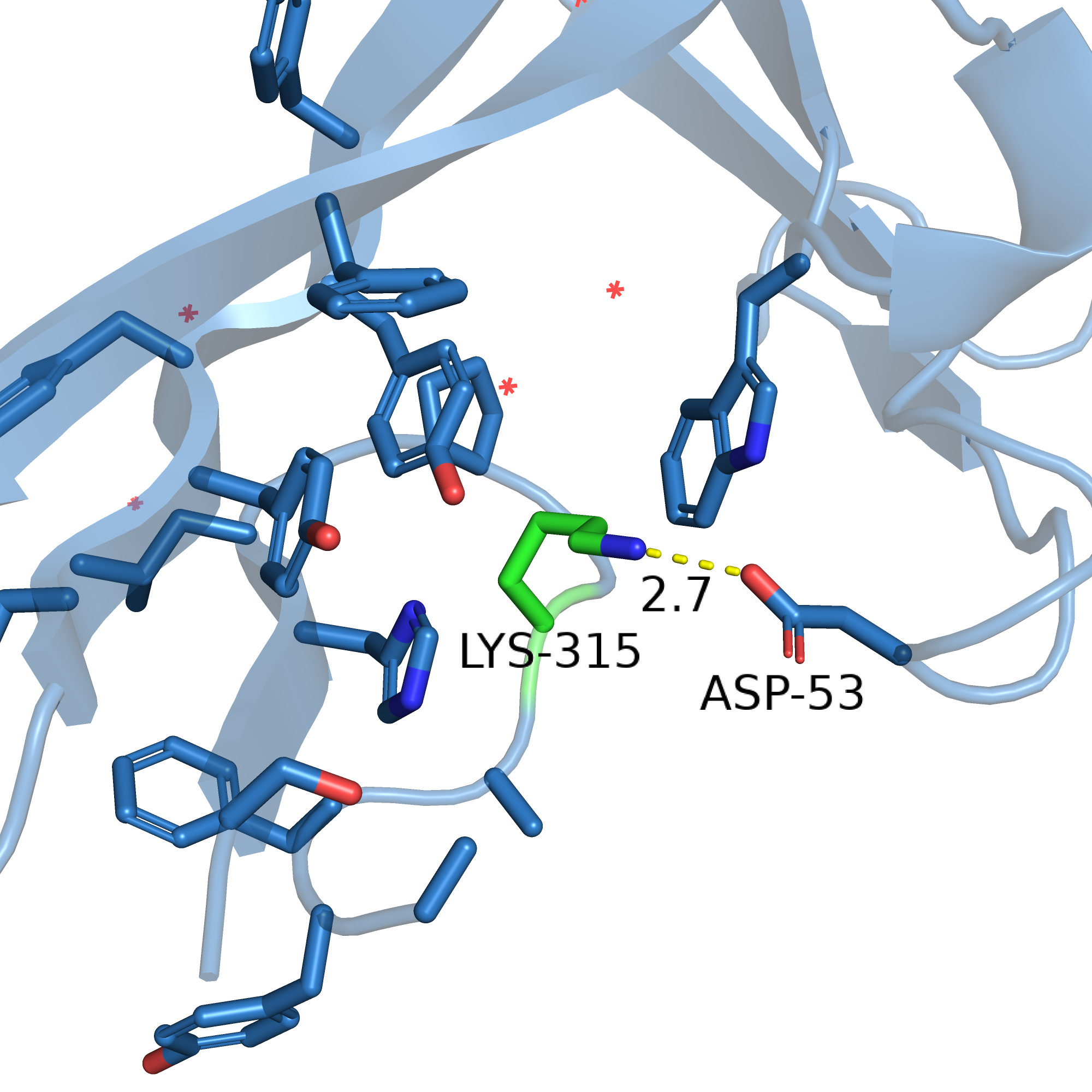
Рис. 13. Остаток 315 заменён на лизин.
Вернуться на страницу 7 семестра
© potapenko 2017-2021