Для выполнения этого задания мне было дано 10 pdb-структур, относящихся к белками, имеющим не более 40% сходства попарно. Цель задания - посмотреть, обладают ли эти белки общей третичной структурой, несмотря на различие последовательностей.
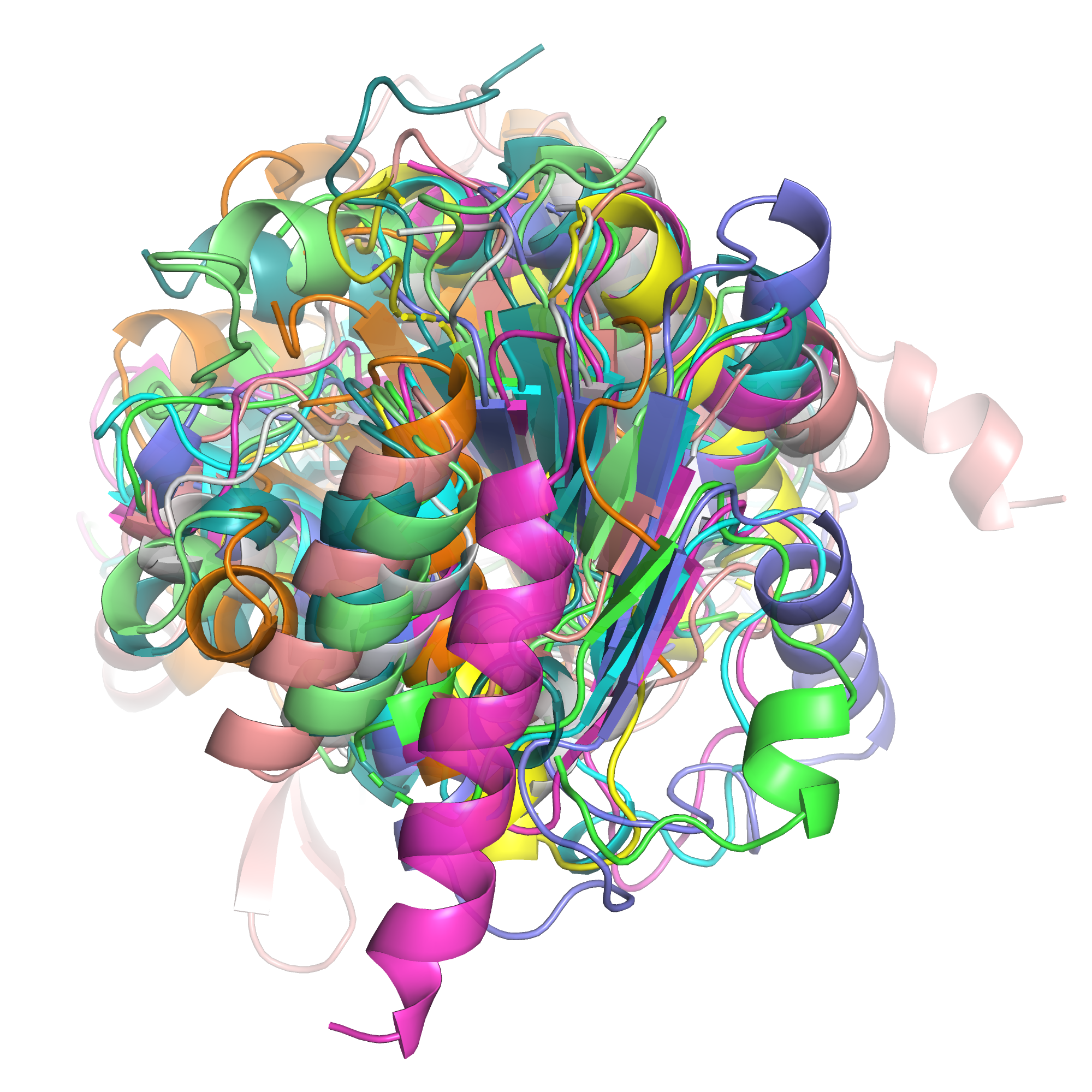
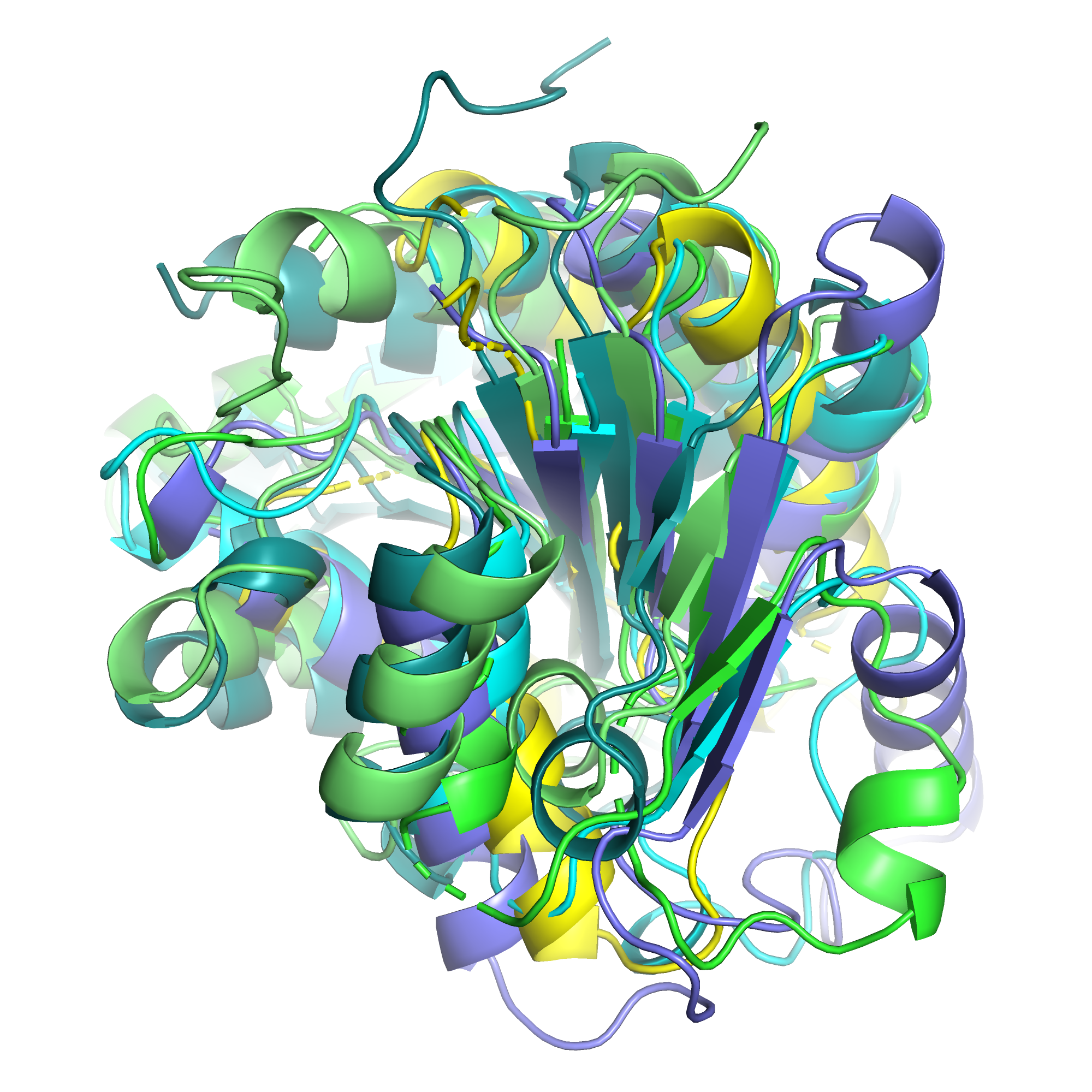
На рисунке 1 представлены все 10 структур. Структура 1t35 была выбрана как опорная (случайным образом), остальные 9 структур были выровнены по ней. На рисунке 2 представлены выровненные 6 структур (ракурс тот же, я исключила из изображения 4 структуры, имевшие наибольшие отличия, чтобы легче было рассмотреть сходство). Сказать, что эти белки обладают общей структурой, можно только если с большими оговорками. В центре всех структур лежит достаточно узкий, слегка закрученный бета-лист, положение цепей листа достаточно хорошо совпадает у структур. Бета лист с двух сторон окружают альфа-спирали, в большинстве структур их три с одной стороны и 4 с другой. Но если положение листа хорошо повторяется между структурами, то спирали имеют очень разное положение относитльно листа в разных структурах: они лежат под разным углом, имеют разную длину, в двух структурах одна из спиралей заменяется на вытянутый узкий бета-лист. Думаю, большее сходство бета-листа по сравнению со спиралаями связано не только с типом вторичной структуры, но и с тем, что спирали лежат на поверхности, а лист - внутри глобулы. Наибольшие отличия набляюдаются в неструктурированных участках. В отдельных структурах в составе петель образуются короткие спирали (1-2 витка), но они не повторяются или почти не повторяются между десятью структурами.
 |
 |
| Рис. 1. Наложение 10 структур. | Рис. 2. Наложение 6 структур. |
На рисунке 3 приведён вид 10 выровненных структур с другой стороны, где неструктурированных участков больше, и ещё более заметно, что структуры достаточно разные. Видно так же, как одна из спиралей заменена на бета-лист.
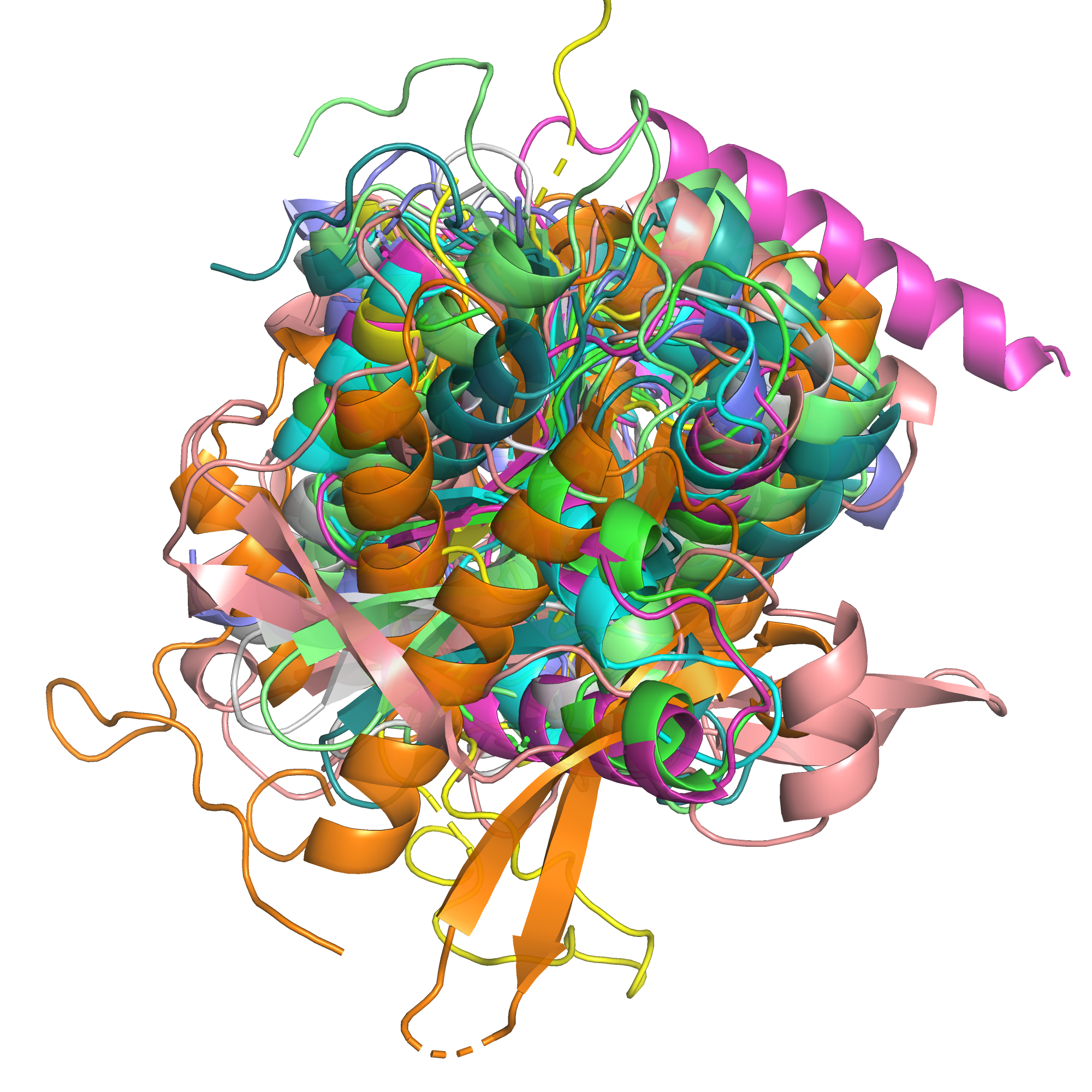
Рис. 3. Наложение 10 структур, вид с менее совпадающей стороны.
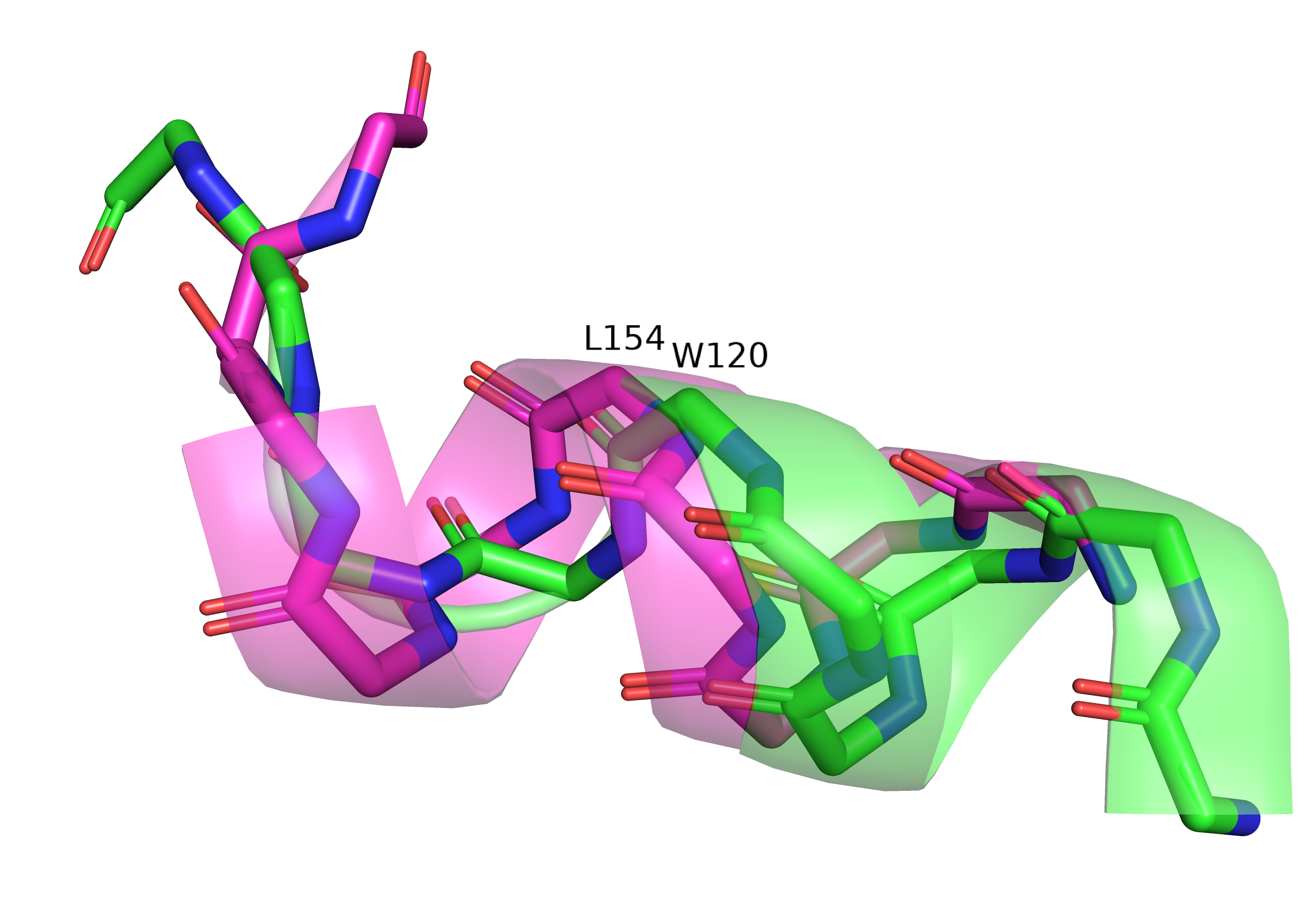
В этом задании нужно было найти участок, на котором белковая цепь идёт более-менее одинаково, но один из них распознаётся как участок со вторичной структурой, а другой нет, и предположить, насколько это обоснованно. Для выполнения задания я выбрала очень типичный (и скучный) случай: альфа-спиарил двух структур почти совпадают на протяжении нескольких оборотов, но одна из спиралей заканчивается раньше, и следующие несколько остатков детектируются уже как часть петли.
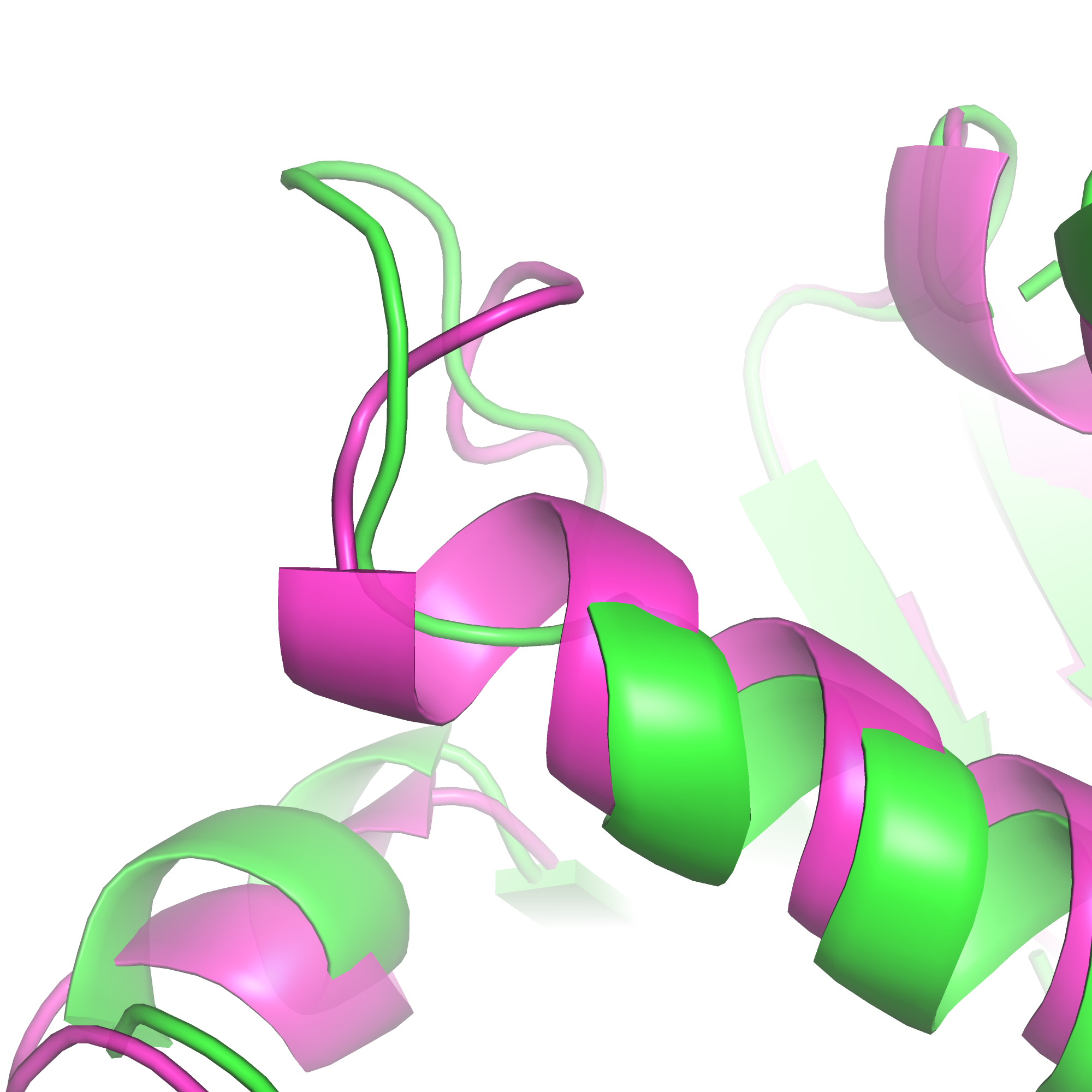
Общее положение такого участка, выбранного мною для примера, показано на рисунке 4 (структура 1е35 - зелёная, 1wek - малиновая). Рядом на рисунке 5 показаны атомы остова соответствующего участка. Видно, что 120й остаток зелёной структуры соответствует 154му розовой, а разметка спирали в зелёной структуре заканчивается на 2.5 остатка раньше (т.е. на почти целый оборот спирали).
 |
 |
| Рис. 4. | Рис. 5. |
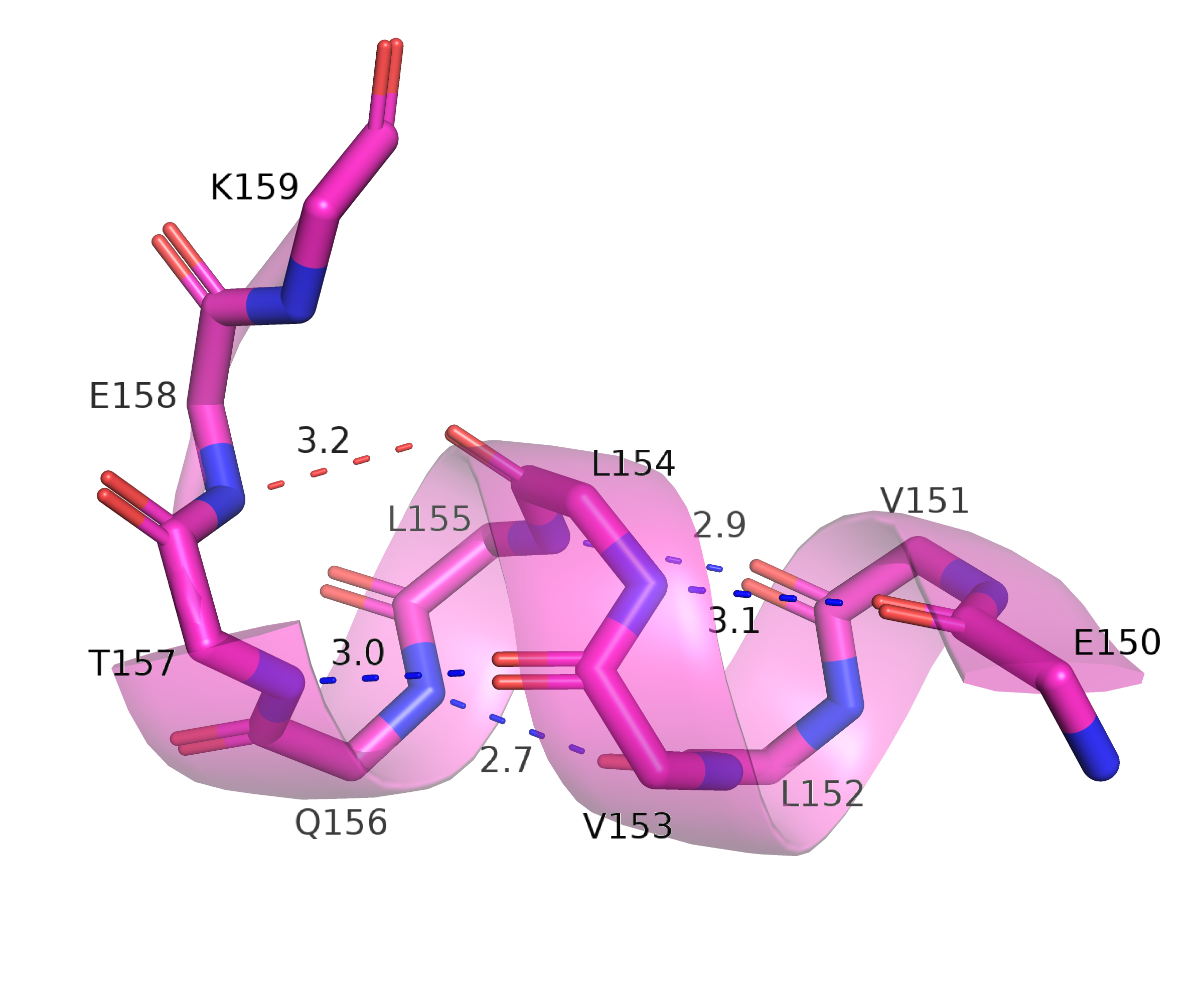
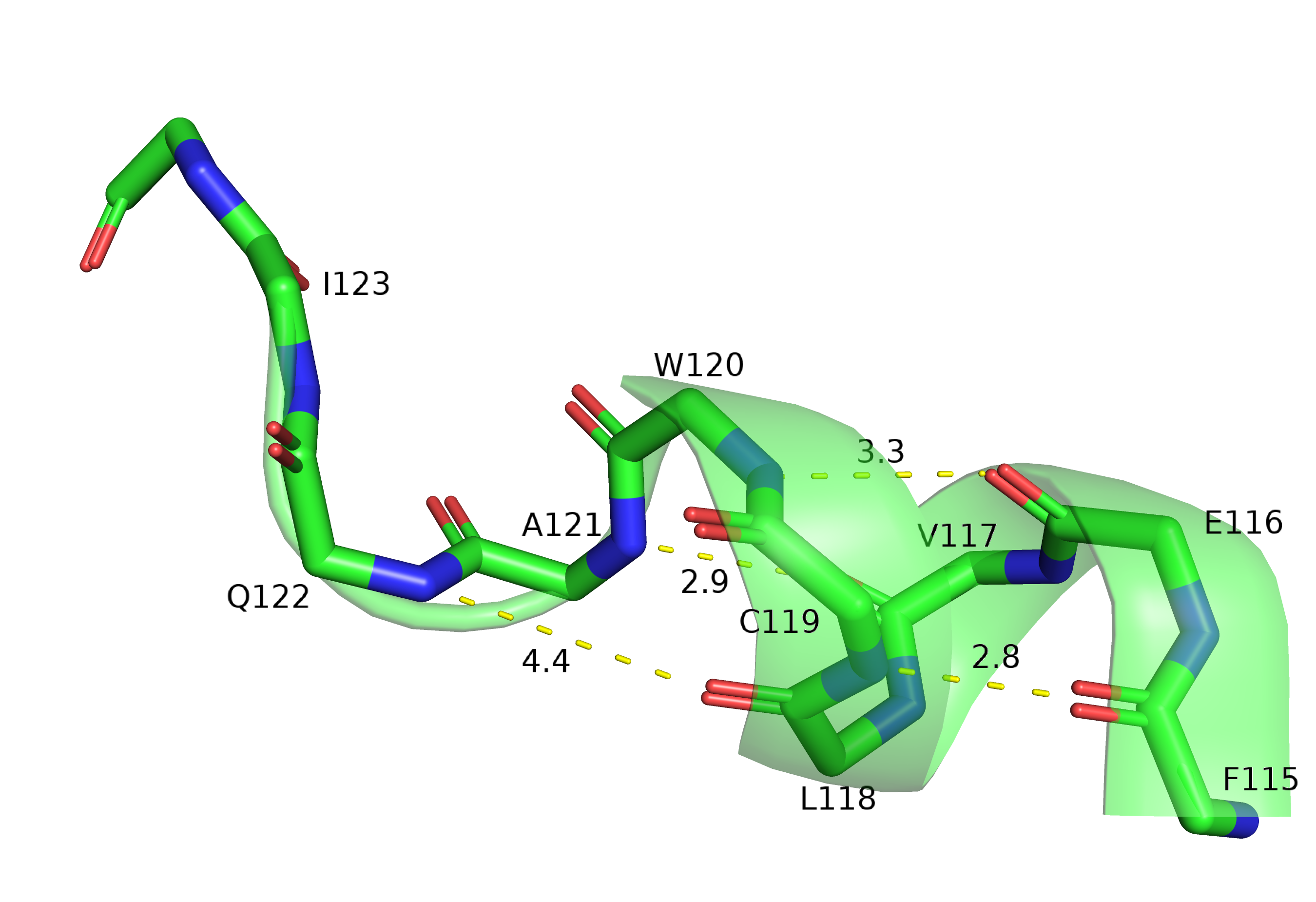
На рисунках ниже (6, 7) приведены расстояния между атомами остова, связь между которыми характерна для альфа-спирали: от кислорода i-го остатка до азота i + 4. Видно, что в розовой структуре самый левый остаток, на азот которого приходит водородная связь (приемлемой длины и геометрии) - это T157, а в зелёной структуре это А121, то есть "конец" спирали различается на две водородных связи остова.
 |
 |
| Рис. 6. | Рис. 7. |
Мне кажется, что такое небольшое различие в разметке вполне оправдано: вторичная структура определяется (в том числе) остов-остовными связями, и если остов-остовной связи нет - значит, есть какие-то другие взаимодействия, стабилизирующий структуру; значит, этот участок структуры уже не обладает жесткостью спирали.
Думаю, в каждой точке белка образуются те связи, сумма которых делайт этот участок более стабильным, и в тех местах, где остов-остовных связей нет, это компенсируется наличием других взаимодействий. Так, в "зелёной" структуре глутамин-122 образует водородную связь с остатком из другой спирали (см. рисунок 8), а в "розовой" структуре такой связи не образуется, т.к. для этого нужно утянуть радикал глутамина (вместе со всем остатком) в другую сторону, что не позволит образоваться остов-остовной связи. Отсутствие одной водородной связи компенсируется наличием другой.
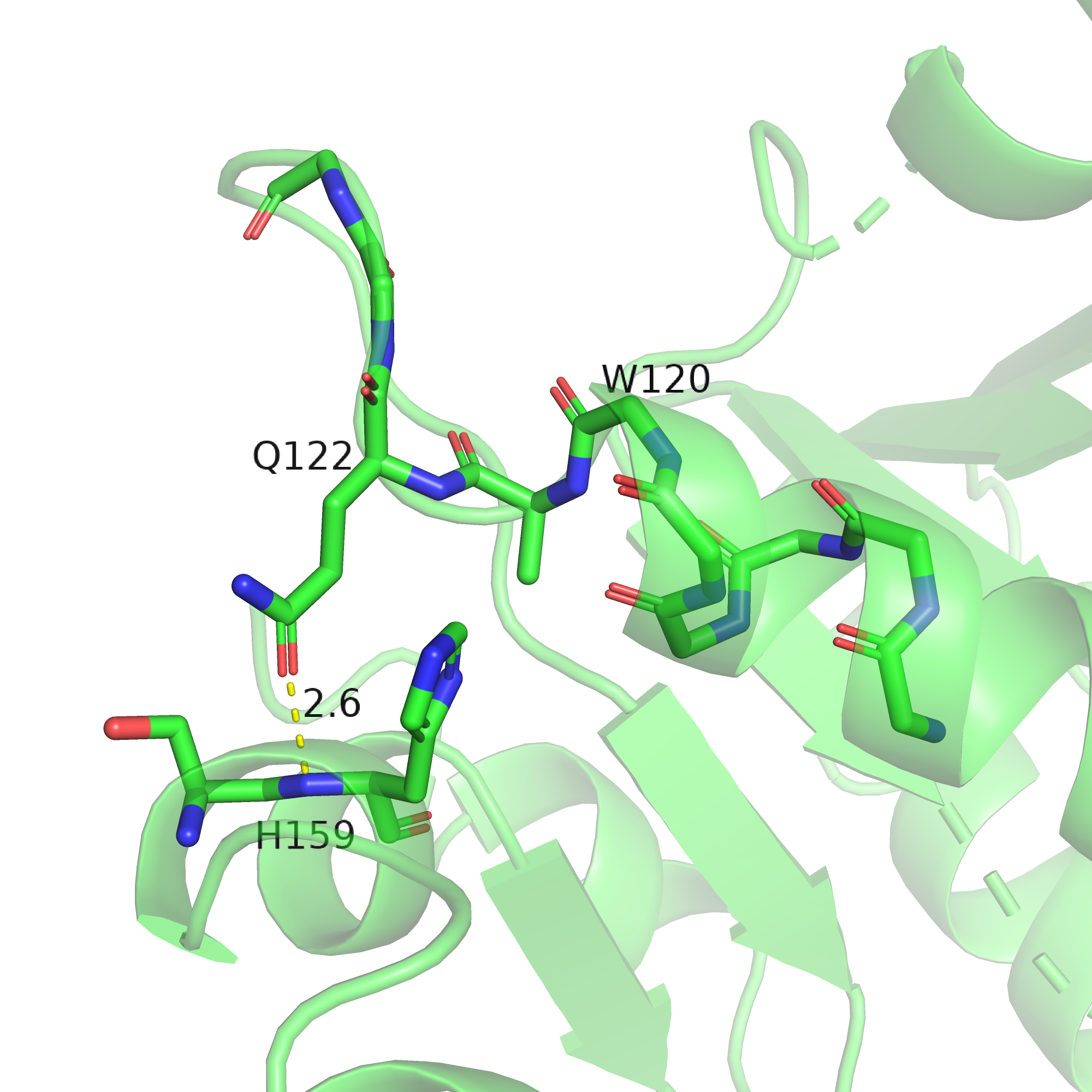
Рис. 8.
В данном задании для каждого из 20 типов остатков была посчитана amino acid secondary structure propensity, то есть склонность этого остатка образовывать конкретный тип структуры (в нашем упрощенном варианте - альфа-спираль, бета-лист или петлю). Эта величина рассчитывалась по выборке из 10 белков (из заданий 1-2), и численно она равна отношению (доли этого остатка среди остатков, относящихся к данной структуре) к (доле этого остатка среди всех остатков в выборке).
Я не стала использовать псевдокаунты, потому что не уверена, какими их стоит сделать. Кажется, псевдокаунты - это способ учесть данные об априорном распределении, когда при построении новой модели учитываются данные эксперимента (т.е. выборки остатков) и представления о выборке, которое у нас было до проведения эксперимента. В данном случае у меня в голове нет априорного распределения, поэтому нет особой информации, которую мне хотелось бы учесть. Кроме того, моя выборка достаточно большая, так что возникающих по случайным причинам нулей тоже нет.
Намного чаще, чем в петлях и в бета-цепях, в альфа-спиралях встречается аланин. Также достаточно склонны встречаться в альфа-цепях аргинин и глутамат. Наверное, это можно объяснить так: аланин маленький и гидрофобный, его радикал удобно "спрятать" внутрь спирали, а заряженные радикалы, наоборот, можно экспонировать в растворитель, ведь многие альфа-спирали находятся на поверзности глобулы.
В бета-листе лидирует изолейцин, также много валина и цистеина. Это можно оъяснить тем, что бета-листы (особенно в моей выборке) спрятаны внутрь глобулы, где выгоднее иметь гидрофобные радикалы. В петлях много пролина и гистидина - мне кажется, это связано не с тем, что петлям выгодно иметь пролин и гистидин, а с тем, что их совсем мало в структурированных участках, и на фоне альфа-спирали в петле получается, что пролина много.
Конечно, этим результатам нельзя доверять, ведь они построены всего по 10 белкам. И дело даже не в том, что выборка маленькая, а в том, что выборка состоит из белков, имеющих похожую вторичную структуру, кажется, что если делать подобный анализ на небольшой выборке, нужно взять более разные структуры. В данных структурах, например, большинство альфа-спиралей на поверхности, а бета-лист запрятан, думаю, что для спирали, находящейся внутри глобулы, распределение остатков будет немного другое.
Картинка с получившимися у меня значениями:

Вернуться на страницу 7 семестра
© potapenko 2017-2021