Внутренности белков и макромолекулярных комплексов
|
< |
Текст скрипта 2. Плотность упаковки атомов в гидрофобном ядре
Текст скрипта 3. Изображение белка в комплексе с ДНК
Описание гидрофобного ядра
С помощью сервера CluD в белке альфа-галактозидазы Streptomyces avermitilis MA-4680 = NBRC 14893 обнаружено 11 гидрофобных ядер. Их характеристики представлены в таблице 1. На рисунке показаны наиболее крупные из них - core1 и core9.
Таблица 1. Харакеристики гидрофобных ядер белка
| Гидрофобное ядро | Число атомов | Процент от общего числа атомов,% |
| core1 | 624 | 18.68 |
| core2 | 9 | 0.27 |
| core3 | 6 | 0.18 |
| core4 | 5 | 0.15 |
| core5 | 24 | 0.72 |
| core6 | 19 | 0.57 |
| core7 | 9 | 0.27 |
| core8 | 4 | 0.12 |
| core9 | 133 | 3.98 |
| core10 | 4 | 0.12 |
| core11 | 7 | 0.21 |
Плотность упаковки атомов в гидрофобном ядре
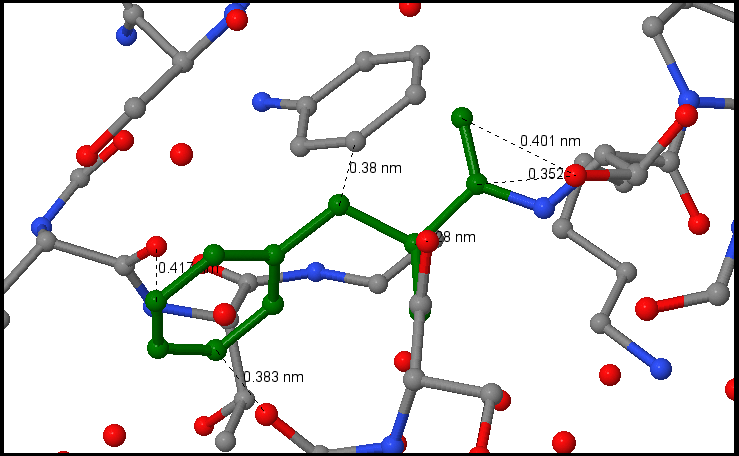
Для определения плотности упаковки атомов в гидрофобном ядре был взят остаток фенилаланина PHE299. На расстоянии не более 6 ангстрем от остатка фенилаланина находятся атомы, которые практически полностью покрывают его поверхность. На расстоянии не более 7 ангстрем добавляются атомы, не покрывающие незанятую площадь данного остатка фенилаланина. Были измерены расстояния между соседними не связанными ковалентно атомами в белке (расстояния от атомов остатка до ближайших к остатку атомов) и найдено характерное расстояние, принятое за вычисленное среднее - 0.37 нм или 3.7 ангстрем. Измеренные расстояния представлены на рисунке 1. Для того,чтобы определить, можно ли поместить между соседними атомами гидрофобного ядра еще один атом, примем молекулу воды за атом кислорода c соответствующим диаметром 1.4+1.4=2.8 ангстрема. Берем атомы с наименьшим радиусам (из предложенных в задании это атомы кислорода) и рассчитаем расстояние между ними с учётом вычисленного характерного расстояния между ковалентно несвязанными атомами: 3.7-1.4*2=0.9 ангстрема. Сопоставляя это значение с диаметром молекулы воды, можно сделать вывод, что молекулы воды не могут поместиться в гидрофобном ядре между другими атомами.
Рисунок 1. Расстояния до ближайших атомов остатка
Белок в комплексе с ДНК
На изображении комплекса белка с ДНК можно увидеть комплекс человеческой ДНК-полимеразы eta с ДНК. ДНК-полимераза - это фермент, участвующий в репликации ДНК. Ферменты этого класса катализируют полимеризацию дезоксирибонуклеотидов вдоль цепочки нуклеотидов ДНК, которую фермент «читает» и использует в качестве шаблона. ДНК-полимеразы eta принадлежат к семейству ДНК-полимераз, представители которого отличаются от прочих низкой производительностью на целостных шаблонах, а также способностью осуществлять репликацию на шаблонах поврежденных ДНК. [1] Функционирование ДНК тесно связано с ее взаимодействиями с белками. В клетке она связана со структурными белками - гистонами - и образует компактную структуру, называющуюся хроматином. Существуют белки, узнающие специфические последовательности ДНК и присоединяющиеся к ним. Например, различные классы факторов транскрипции. Для протекания жизненно важных процессов ДНК, находящаяся в клетке в суперскрученном состоянии, должна быть раскручена, что производится двумя группами белков-ферментов — топоизомеразами и хеликазами. В различных процессах, происходящих в клетке, например, рекомбинации и репарации, участвуют ферменты, способные разрезать (нуклеазы) и восстанавливать целостность (лигазы) нитей ДНК. Существует также важная для метаболизма ДНК группа ферментов, которые синтезируют цепи полинуклеотидов из нуклеозидтрифосфатов — ДНК-полимеразы.[2]
Источники:
[1] https://ru.wikipedia.org/wiki/ДНК-полимераза
[2] https://ru.wikipedia.org/wiki/Дезоксирибонуклеиновая_кислота
© Potemkina Elena, 2016