На Рис. 1 показана биологическая сборка 4AAW. Данный белок представляет собой гомотример.
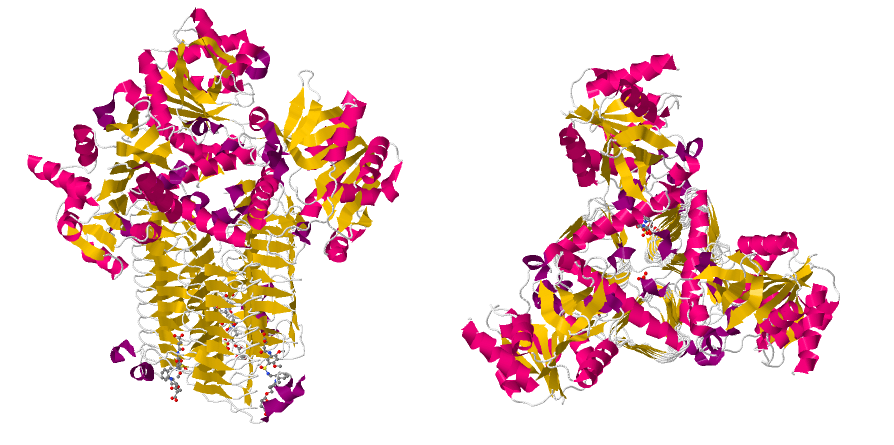
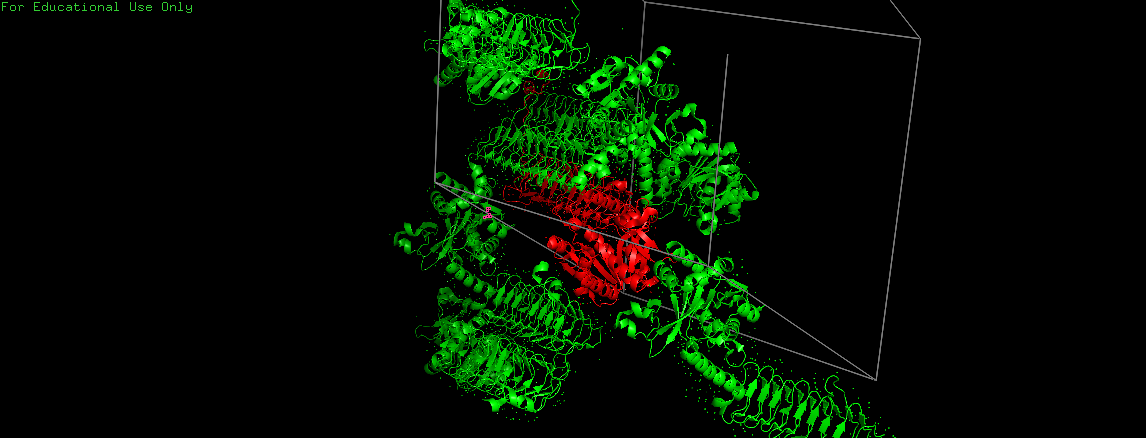
Содержимое элементарной ячейки изображено на Рис. 2. Элементарная асимметрическая единица (наименьшая область, из которой посредством операций симметрии можно воссоздать весь кристалл) показана красным цветом.
Фрагмент кристалла с выделенной элементарной ячейкой в разных ракурсах показан на Рис. 3 и Рис. 4.

Контакты в кристалле
После визуализации полярных контактов (для водородных связей устанавливался порог расстояния 3.5 Å так же выделялась вода, способная потенциально образовывать водяные мостики) было определено, что одна ассиметрическая единица данного белка контактирует с 6 другими: 2 из своей биологической сборки и ещё 4 из соседних (Рис. 5)
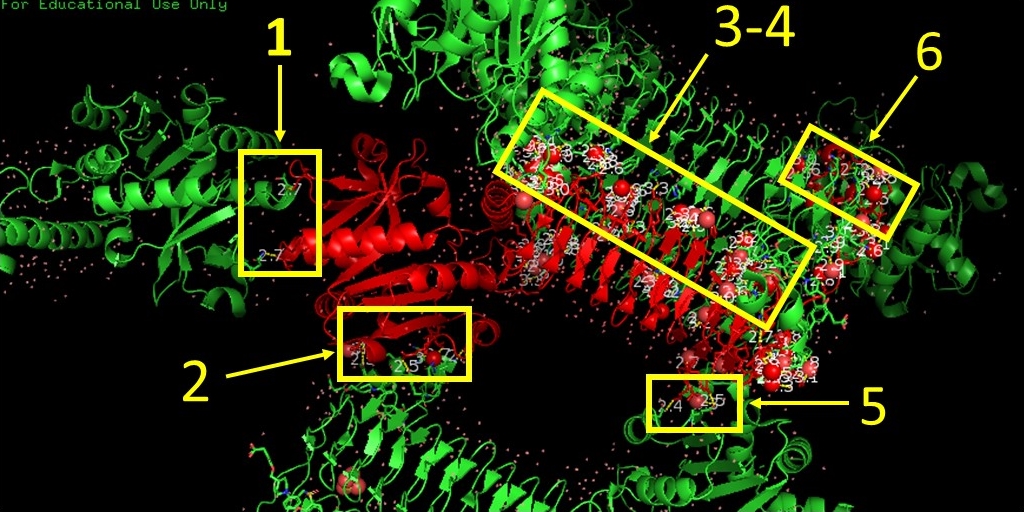
Далее последовательно рассмотрим данные зоны контактов.
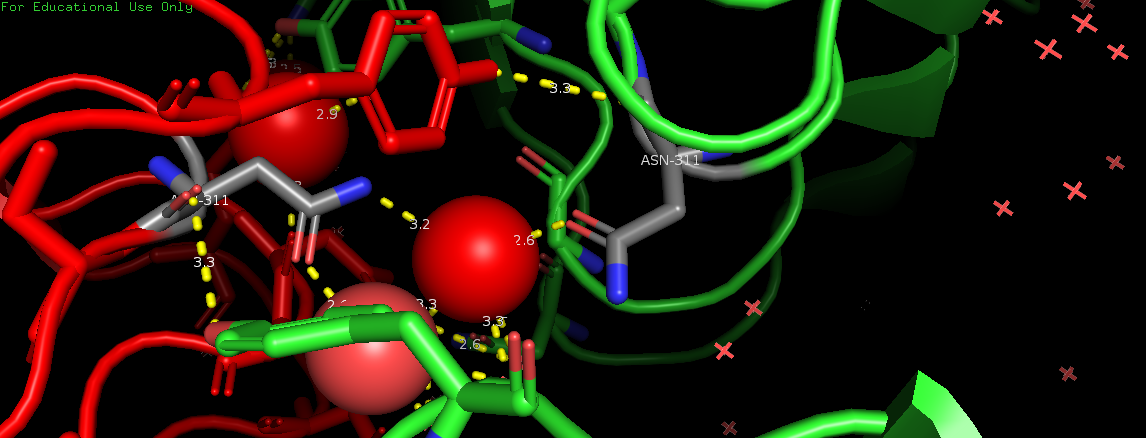
На Рис. 6, 7, 8 и 9 изображены полярные контакты в областях 1, 2, 5 и 6 соответственно. Молекулы воды показаны в виде крестиков и сфер.
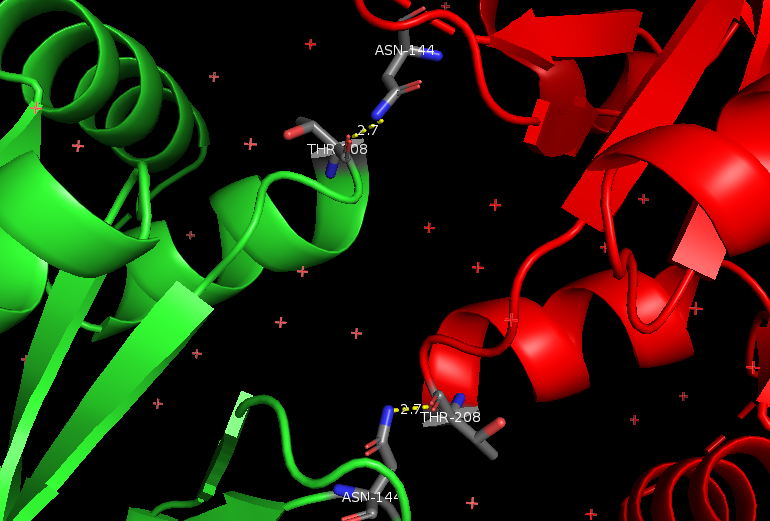
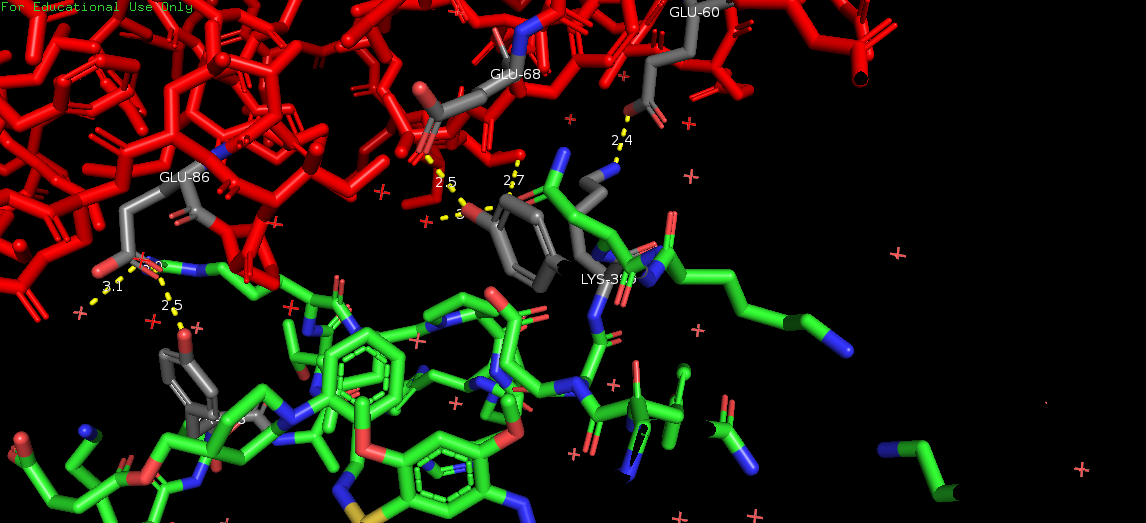
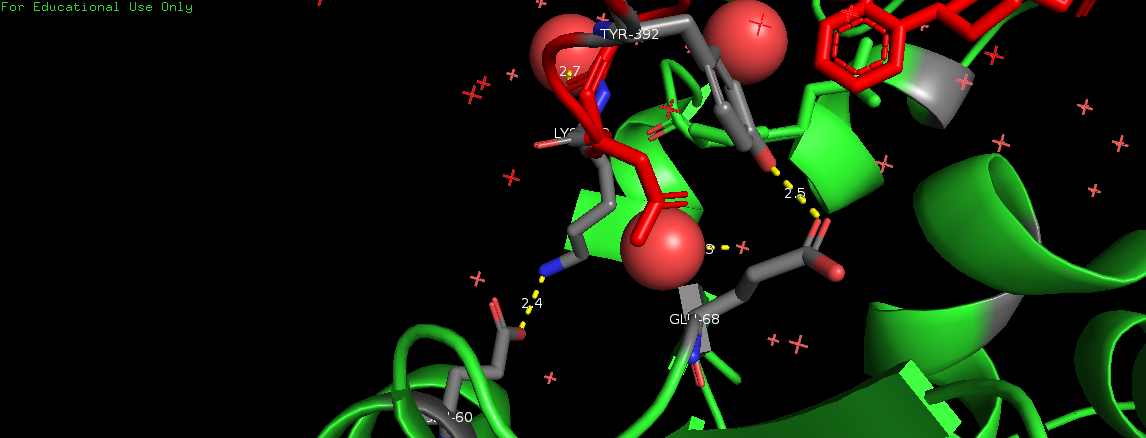
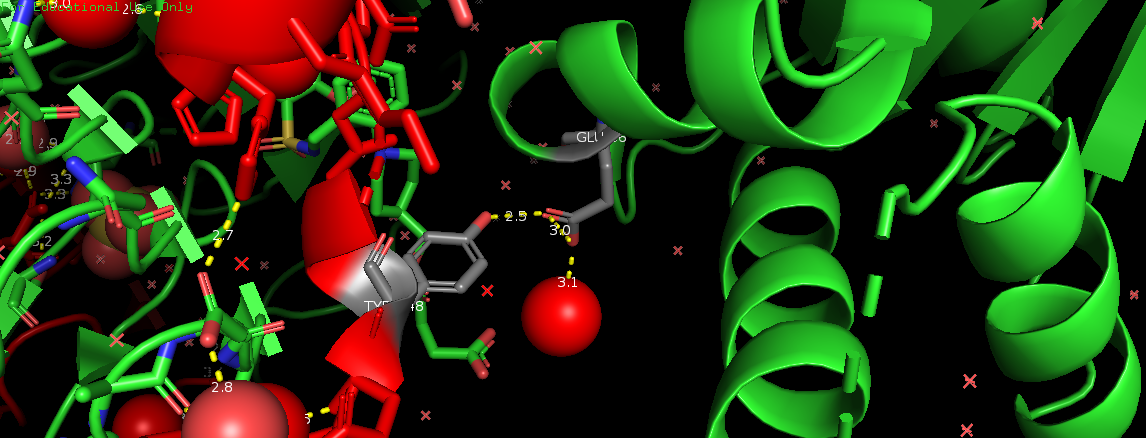
Это зоны контакта асимметрической единицы с молекулами белка из соседних сборок. Видно, что каждая из них представлена небольшим числом волородных связей. В отличие от областей контактов данной единицы с молекулами из своей сборки. В этих областях (3 и 4) очень много водородных связей, большую роль играют молекулы воды, участвующие в образовании многочисленных водяных мостиков, один из которых представлен на Рис. 10.
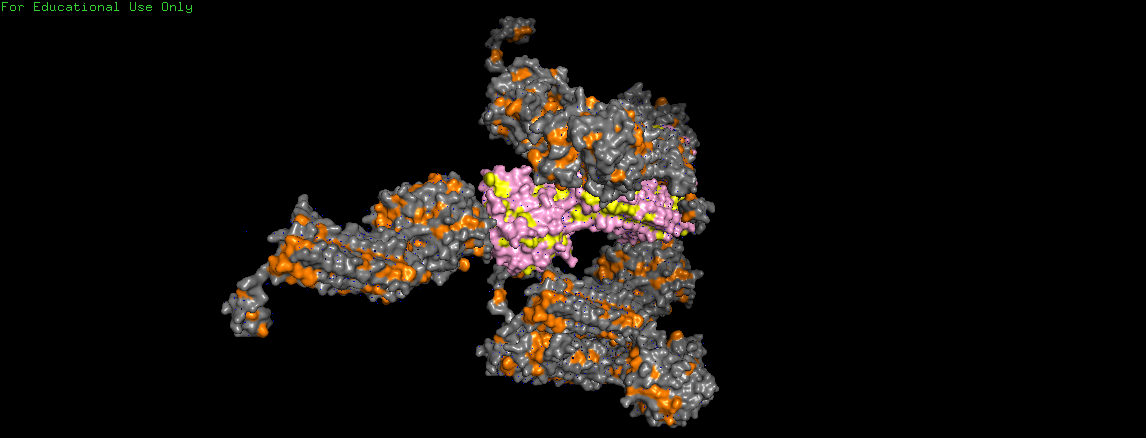
Далее проводился анализ гидрофобных взаимодействий. На Рис. 11 аминокислоты с гидрофобным радикалом у рассматриваемой ассиметрической единицы (выделена розовым) показаны желтым, а у соседних молекул (выделены серым) - оранжевым. Видно, что в областях контакта между молекулами скопления гидрофобных остатков не наблюдается.
Чтобы убедиться в том, что гидрофобные взаимодействия между белками ячеек слабо выражены, были визуализированы молекулы воды (на Рис. 12 и Рис. 13 показаны синим).
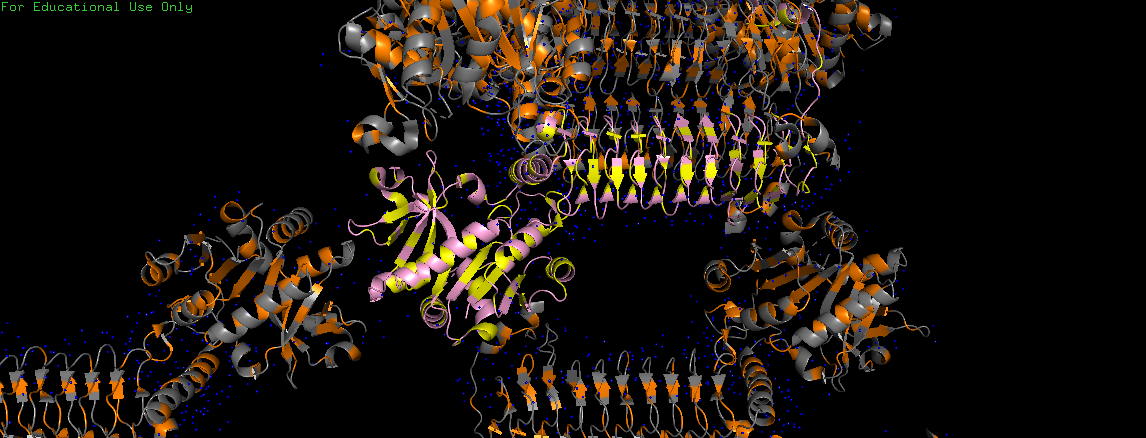
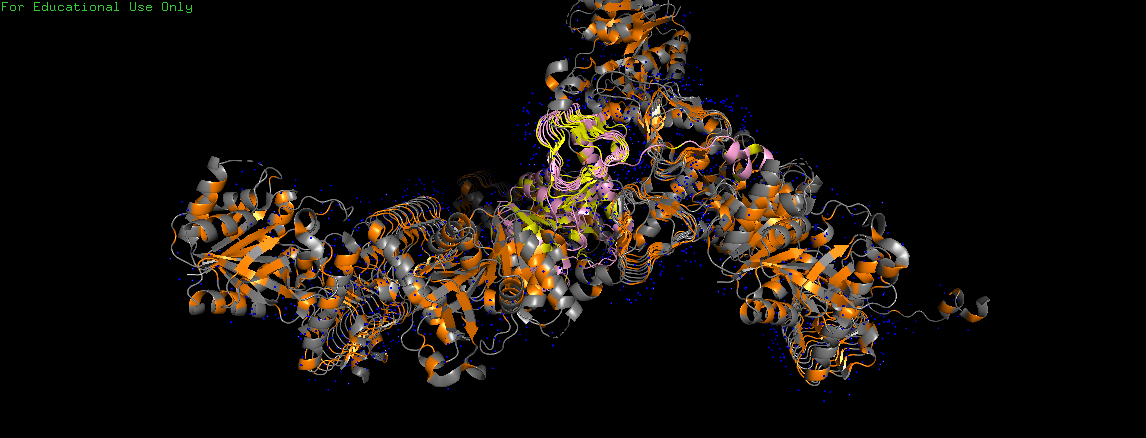
Видим, что все молекулы довольно равномерно покрывают молекулы воды, которые должны вытесняться при существовании гидрофобных взаимодействий.
Таким образом, одна асимметрическая единица данного белка в кристалле взаимодействует в сумме с 6 другими (с двумя из своей биологической сборки, образуя гомотример, и с 4 субъединицами из соседних сборок). Контакты образуются за счёт водородных связей и водяных мостиков, гидрофобные взаимодействия существенной роли не играют.
Странное расположение белковой цепи в структуре ДНК-белкового комплекса 3HDD
Структура 3HDD содержит двухцепочечную ДНК и две молекулы гомеодоменов D. melanogaster, взаимодействующих с ДНК.
"Странность": В этой структуре одна из молекул белка (показана жёлтым цветом на Рис. 14) находится на краю молекулы ДНК.
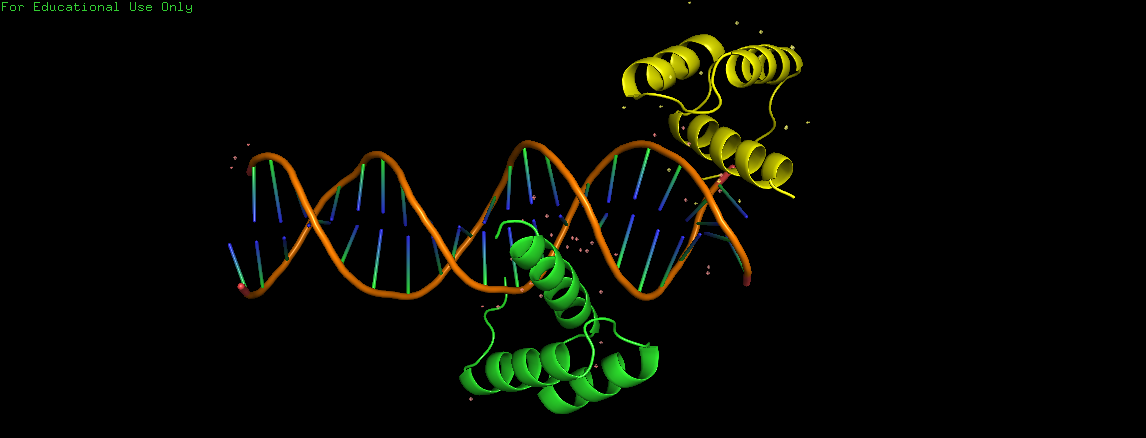
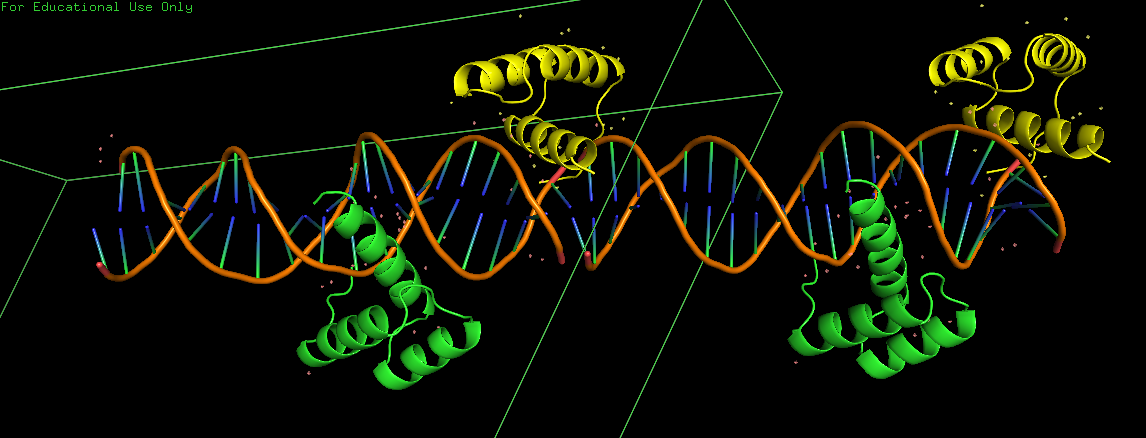
При достроении соседней ячейки можно заметить, что концевые нуклеотиды соседних цепей ДНК образуют комплементарную пару. То есть молекула белка (синяя) расположена не на краю цепи ДНК и взаимодействует так же с ДНК из соседней ячейки.
Ассиметричекая единица и биологичекая единица
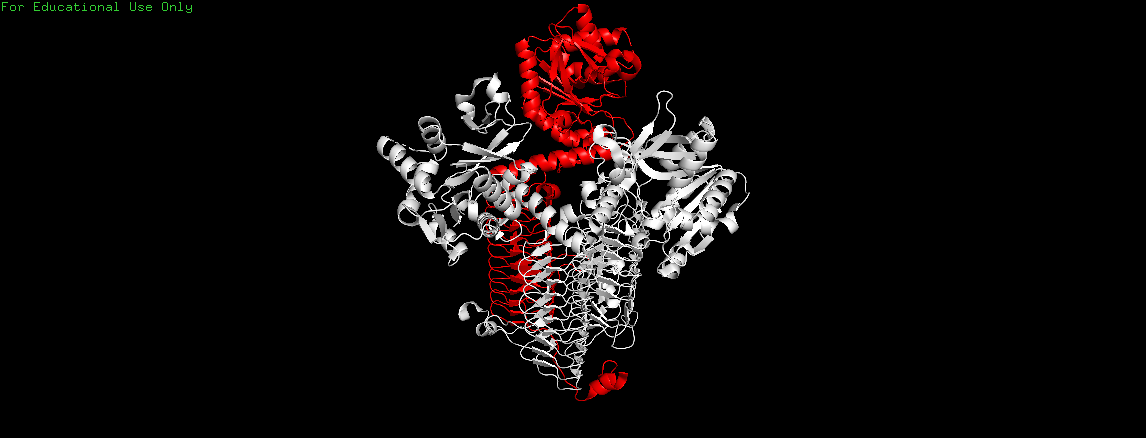
Одним из примеров, где ассиметрическая единица не совпадает с биологической, является уже рассмотренная структура бифункционального белка GlmU из организма Streptococcus pneumoniae(PDB: 4AAW), для которой ассиметрическая единица состоит из одной субъединица, а биологическая представляет собой гомотример (Рис. 15).
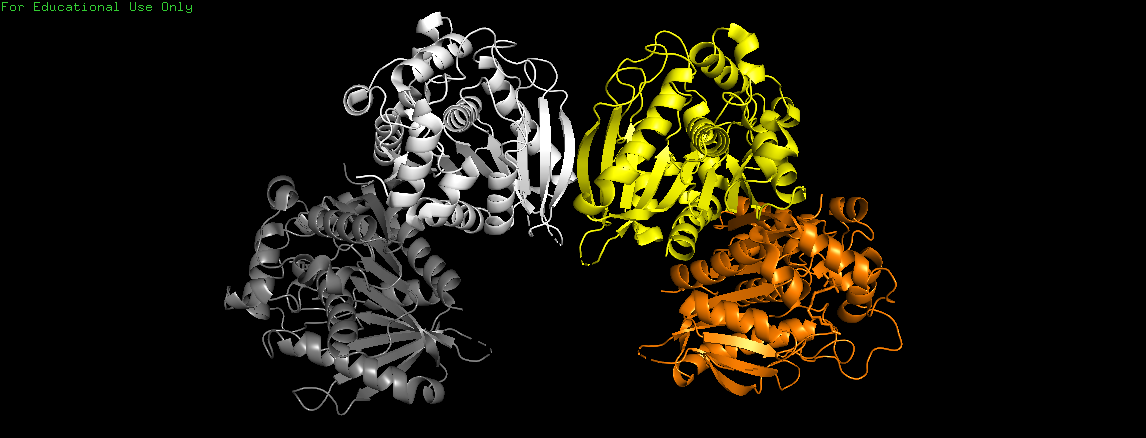
В качестве другого примера рассмотрим структуру белка карбоксилэстеразы 2 из гриба Tuber melanosporum, PDB: 5MIF (Рис. 16).
Здесь, наоборот, ассиметрическая единица содержит больше субъединиц (4), чем биологическая сборка (две - показаны желтым и оранжевым).
© Павел Волик
Факультет биоинженерии и биоинформатики, МГУ