Таблица 1. Сравнение водородных связей в ЯМР и РСА моделях. | ||||||
| Водородная связь | Положение | Расстояние между атомами (РСА) | Минимальное расстояние между атомами (ЯМР) | Медиана (ЯМР) | Максимальное расстояние между атомами (ЯМР) | Встречаемость |
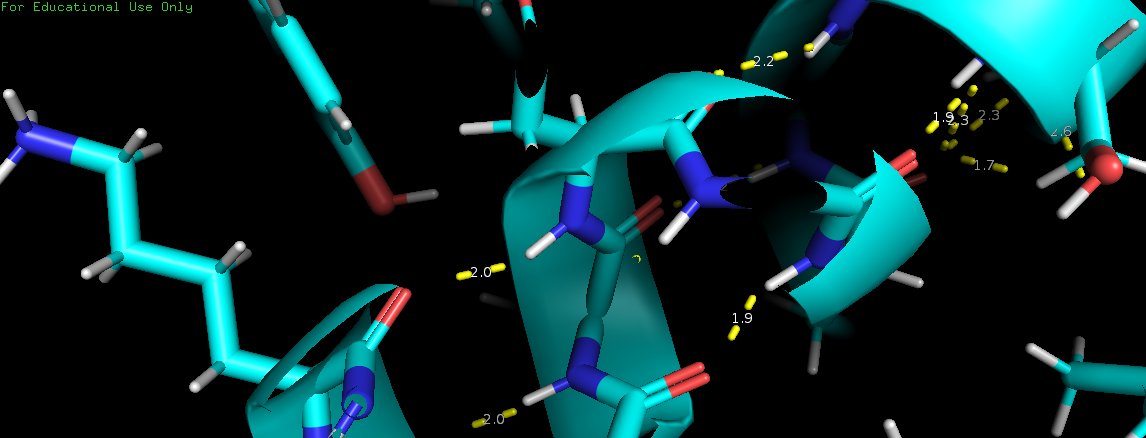
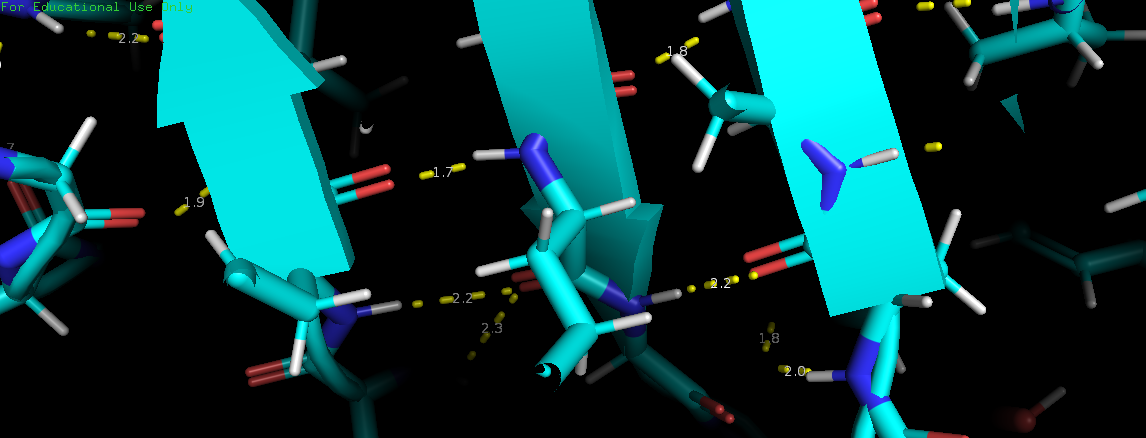
| альфа-спираль | карбоксильный кислород Lys31 - аминогруппа Asn35 | 2.0Å | 1.9Å | 2.0Å | 2.3Å | 100% |
| аминогруппа Arg55 - карбоксильная группа Gln63 | в ядре между бета-тяжами | 1.7Å | 1.7Å | 1.8Å | 1.9Å | 100% |
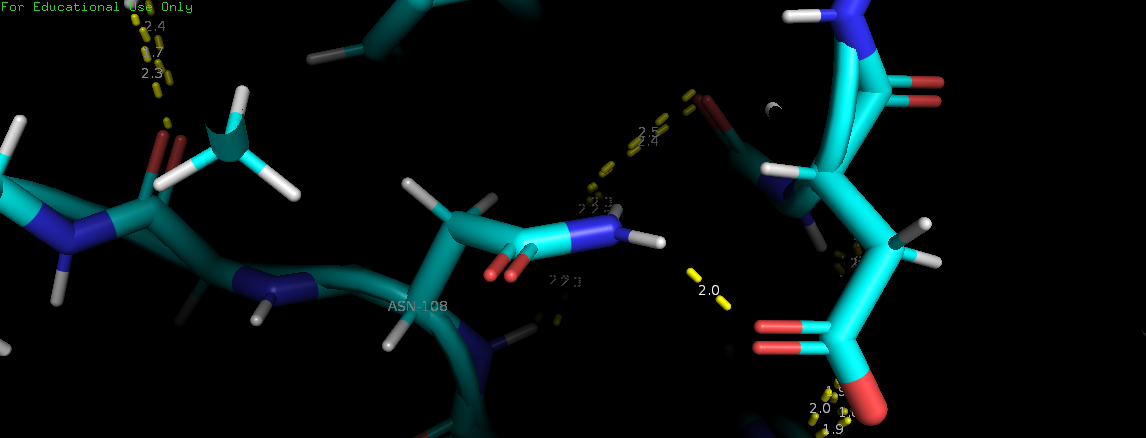
| амидная группой Asn108 - карбоксильная группа боковой цепи Asp85 | на поверхности белка | 2.0Å | 1.7Å | 1.8Å | 1.9Å | 40% |
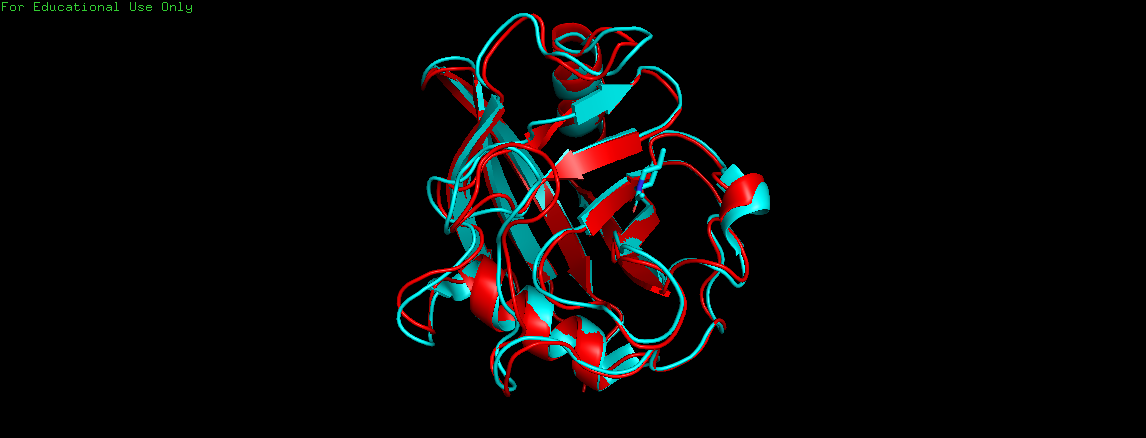
Таким образом, структуры белка, полученные методами РСА и ЯМР схожи, но не идентичны. Это можно объяснить подвижностью белка в растворе, что не может не влиять на результаты ЯМР.
Bодородныt связи внутри альфа-спирали и внутри белка между бета-тяжами стабильны (присутствуют во всех структурах). В то же время связи между боковыми радикалами на поверхности белка нестабильны: сохраняются лишь в 40% структур ЯМР.
© Павел Волик
Факультет биоинженерии и биоинформатики, МГУ