Остовные водородные связи
1. α-спирали
На рисунке 1 изображен остов одной из α-спиралей белка. Белым показаны водородные связи.
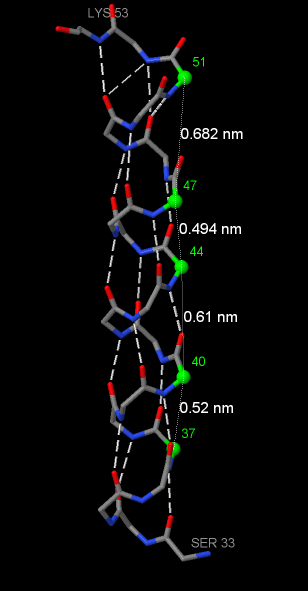
Рис.1 Структура одной из α-спиралей в белке CPAF. Азот показан синим, кислород - красным, углерод - серым. Водород и боковые группы не показаны. Номера и названия первой и последней аминокислот подписаны. Белым отмечены водородные связи в остове спирали. Зелеными шариками показаны атомы, выбранные для определения параметров спирали.
Видно, что связь идет между кислородом С=О группы (донор электронной пары) и водородом N-H группы (акцептор электронной пары). Каждая C=O и N-H группа остова задействована в водородной связи. N-H группа находится через 10 атомов (4 аминокислоты) от остатка, содержащего связанную с ней C=O группу. Зеленым отмечены атомы, стоящие друг над другом: видно, что между 37 и 51 атомами 4 витка спирали. Тогда число аминокислотных остатков на виток: (51-37+1)/4=3.75. Шаг спирали найдем по среднему арифметическому расстояний между зелеными атомами: (0.52+0.61+0.494+0.682)/4=0.5765 нм.
Рис.2 Положение выбранной α-спирали в структуре белка.
Параметры спирали:- Шаг спирали: 0.5765 нм;
- Число остатков спирали на 1 виток: 3.75
2. β-листы
На рисунке 2 показана β-структура, состоящая из 7 цепей.
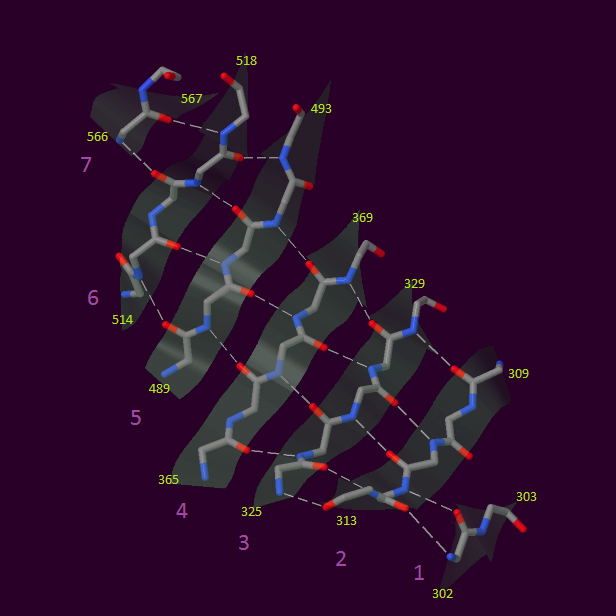
Рис.2 Структура β-слоя из 7 цепей в белке CPAF. Показаны остовы цепей; зелеными стрелками показана ориентация цепей. Белым отмечены водородные связи. Подписаны желтым номера первой и последней аминокислоты в каждой цепи. Розовым подписаны данные условно номера цепей.
В β-структурах, состоящих только из двух цепей, лишь половина C=O и N-H групп образуют водородные связи, что снижает прочность. Однако за счет укладывания рядом нескольких цепей удается связать больше групп, как видно на нашей структуре. Вторая цепь направлена антипараллельно первой и третьей, остальные параллельны третьей.
При антипараллельной укладке группы C=O и N-H из одного аминокислотного остатка в цепи 1 соединяются, соответственно, с группами N-H и C=O из одного аминокислотного остатка в цепи 2. Но C=O и N-H следующих аминокислот "торчат" в другую сторону: у цепи 1 они не образуют связи, а у цепи 2 замыкаются на цепь 3 (также антипараллельно).
При параллельной укладке, аналогично, C=O и N-H одного аминокислотного остатка замыкаются на одну цепь, а следующего за ним - на другую.