По данным PDB, белок CPAF относится группе сериновых эндопептидаз, то есть он связывает и расщепляет пептидную связь с помощью содержащегося в его активном центре остатка серина, осуществляющего нуклеофильную атаку на углерод карбонильной группы. Такие ферменты, как трипсин, химотрипсин, фактор свертывания крови тромбин, и бактериальная протеаза субтилизин, относится к сериновым эндопептидазам.
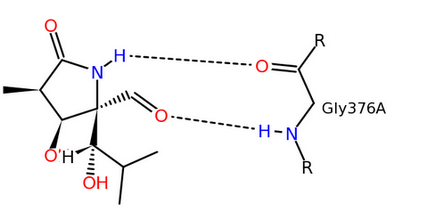
Единственный лиганд, приведенный в файле белка, нисколько не похож на пептид - это лактацистин (LAS). Эта молекула, синтезируемая стрептомицетами, является ингибитором протеасомы - внутриклеточной протеазы, деградирующей ненужные белки до коротких пептидов. Видимо, он может садиться и на активные сайты других протеаз, таких как CPAF. По данным из приведенного на PDB абстракта статьи PubMed, LAS был добавлен для определения активного сайта CPAF.
На рисунке 1 приведено изображение области контакта лиганда с белком. Скрипт Jmol, с помощью которого получено изображение, можно получить по ссылке: 3DPM-ligand.spt
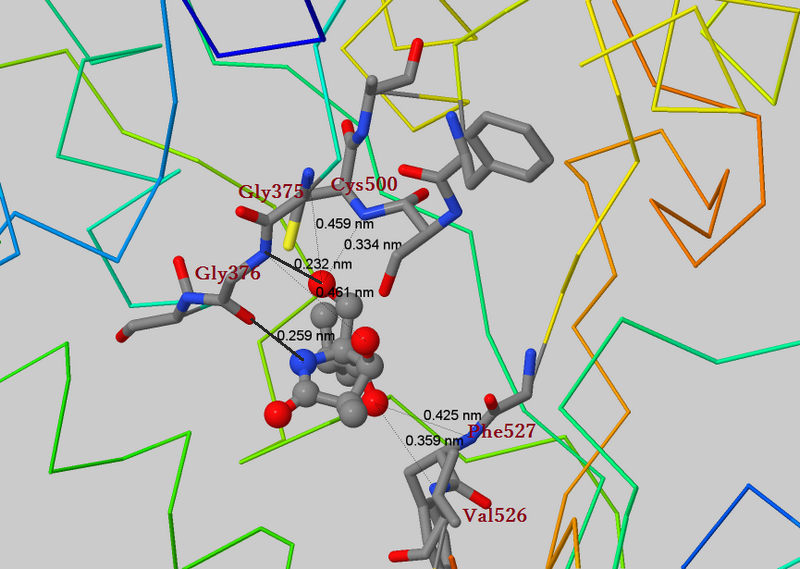
Рис.1 Область связывания CPAF и лактацистина. Показаны возможные связи между положительными и отрицательными атомами, связывающие лиганд. Самые короткие показаны более жирными линиями.
На странице белка в PDB также приведен рисунок, показывающий связи лиганда с активным центром. Они соответствуют выделенным жирным связям на рисунке 1.