Взаимодействия боковых цепей
1.Солевые мостики
Для нахождения солевых мостиков я сделала скрипт, отбирающий положительно заряженные атомы боковых цепей, находящиеся на расстоянии не более 3.5 Å от отрицательно заряженных. Скрипт приведен ниже.
load "\3DPM.pdb" define hbn asp.od1, asp.od2, glu.oe1, glu.oe2 define hbp arg.ne, arg.nh1, arg.nh2, lys.nz cartoons off cpk off define salt ((within (3.5, hbn)) and hbp) define salt1 ((within (3.5, hbp)) and hbn) select salt or salt1 cpk color cpk select not (salt or salt1) color translucent 0.8 zoom 50
На рисунке 1 показан результат действия скрипта:
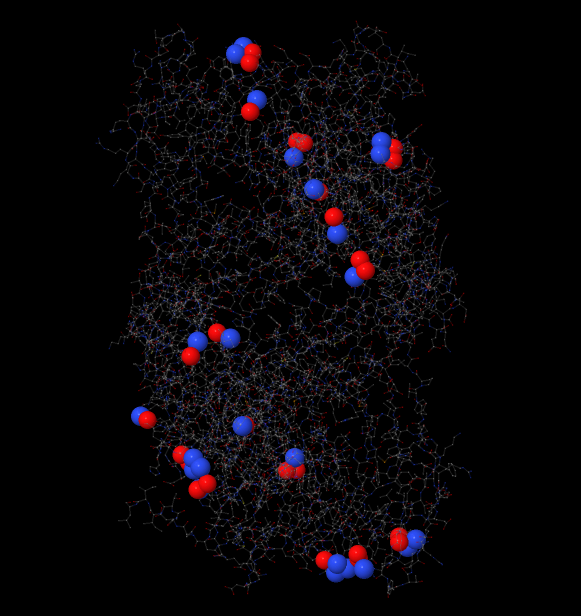
Рис.1 Атомы боковых цепей, потенциально участвующие в образовании солевых мостиков. Синим покрашены положительно заряженные атомы азота, красным - отрицательно заряженные атомы кислорода.
Не все выявленные скриптом атомы участвуют в солевых мостиках. Многие выделенные атомы находятся по-соседству в основной цепи, тогда как солевой мостик соединяет две удаленные области белка. Чтобы было проще разобраться, я воспользовалась сервисом Protein Interactions calculator. В нем можно рассчитать взаимодействия в молекуле белка из pdb-файла, в том числе ионные. Получилась таблица:
Ionic Interactions within 3.5 Angstroms Position Residue Chain Position Residue Chain 53 LYS B 406 GLU B 57 LYS A 61 GLU A 57 LYS B 61 GLU B 60 LYS A 558 GLU A 60 LYS B 558 GLU B 124 LYS A 175 GLU A 127 ASP A 129 ARG A 127 ASP B 129 ARG B 129 ARG B 147 GLU B 143 ARG B 146 ASP B 146 ASP B 204 ARG B 147 GLU B 203 ARG B 317 ASP A 323 HIS A 329 ARG A 369 ASP A 329 ARG B 369 ASP B 394 GLU B 476 LYS B 509 LYS B 563 GLU B 510 ASP A 551 ARG A 510 ASP A 553 HIS A 510 ASP B 551 ARG B 551 ARG B 563 GLU B
Взаимодействия, при которых атомы достаточно удалены:
Position Residue Chain Position Residue Chain 53 LYS B 406 GLU B 60 LYS A 558 GLU A 60 LYS B 558 GLU B 124 LYS A 175 GLU A 129 ARG B 147 GLU B 146 ASP B 204 ARG B 147 GLU B 203 ARG B 329 ARG A 369 ASP A 329 ARG B 369 ASP B 394 GLU B 476 LYS B 509 LYS B 563 GLU B 510 ASP A 551 ARG A 510 ASP A 553 HIS A 510 ASP B 551 ARG B
Выберем одну из этих связей, например лизин 124 и глутаминовая кислота 175 на цепи B. Приближенное изображение представлено на рисунке 2.
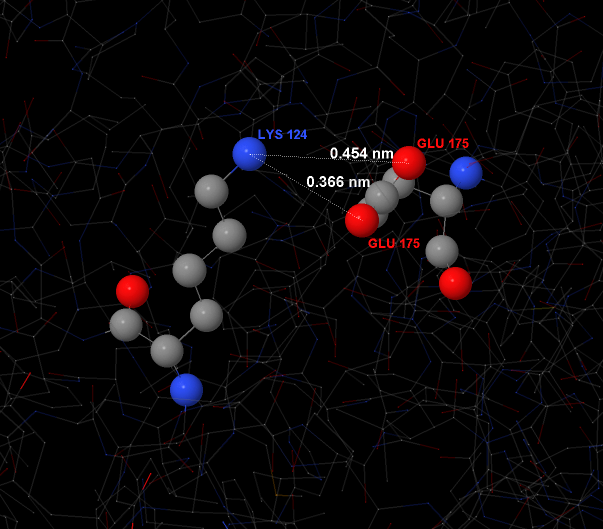
Рис.2 Один из солевых мостиков, учавствующих в поддержании структуры CPAF. Связь происходит между молекулой глутаминовой кислоты и лизина. Посчитаны расстояния между положительно заряженным атомом азота в лизине и двумя отрицательно заряженными атомами кислорода в глутаминовой кислоте. Видно, что одна связь короче и близка к установленному при поиске порогу (0.35 нм).
2. Водородная связь, не являющаяся солевым мостиком
Для обнаружения водородных связей в боковых группах была применена команда set hbondsRASMOL FALSE, а затем - calculate hbonds. В таком случае вычисляются водородные связи и между атомами остова, и между атомами боковых групп. Одна из водородных связей, между тирозином 218 и глутаминовой кислотой 114, приведена на рисунке 3.
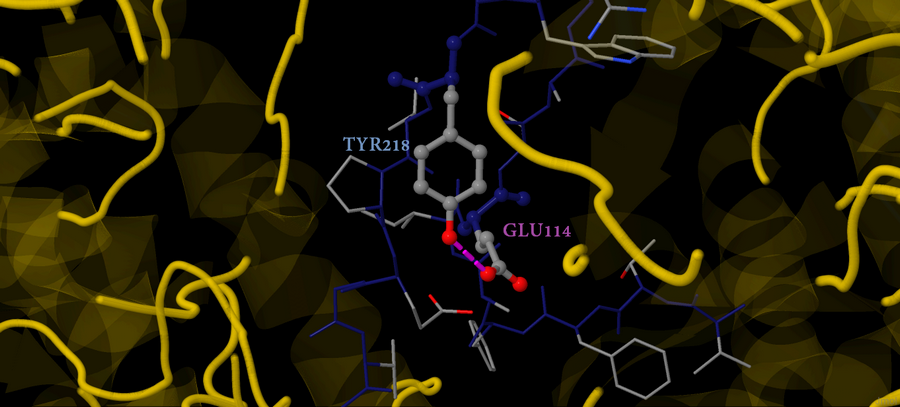
Рис.3 Рис.3 Водородная связь между водородом OH-группы Tyr218 и кислородом Glu114 цепи B. Связь показана розовым.
3. Дисульфидные связи
К сожалению, в данном белке не было дисульфидных связей. В базе PDB я нашла другой белок, принадлежащий этой же бактерии - Асимметричную Ap4A-гидролазу nudH (идентификатор 4ILQ).
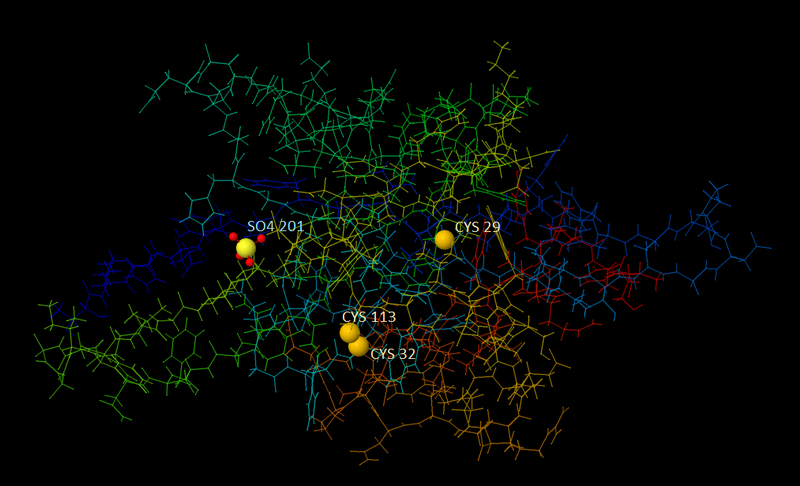
Рис.3 Изображение белка nudH. Атомы серы показаны желтыми шариками. Один из атомов входит в состав группы SO4, остальные - в состав цистеина, 2 из них образуют мостик.
В ней есть 4 атома серы, два из которых образуют цистеиновый мостик. На рисунке 4 дано общее изображение белка, на рисунке 5 - приближение S-S мостика.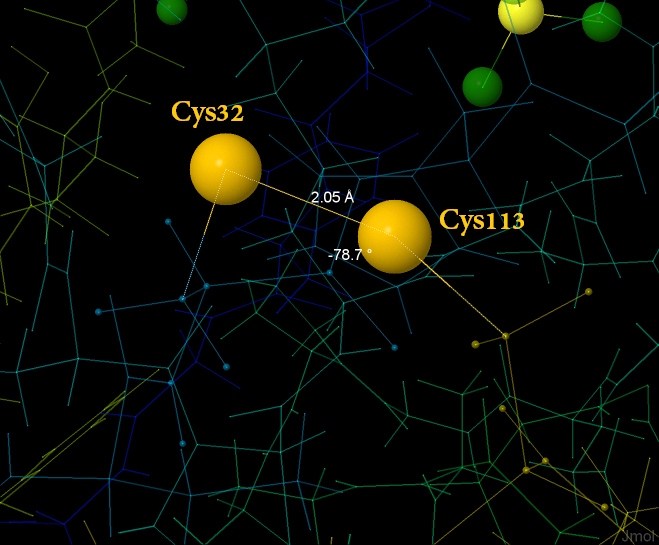
Рис.5 Дисульфидный мостик в молекуле белка nudH. Выделены атомы серы и подписано расстояние между атомами и двугранный угол при дисульфидной связи
3. Гидрофобные взаимодействия
На рисунке 5 приведены изображения гидрофобных атомов в CPAF. Слева гидрофильные атомы изображены в модели spacefill, чтобы нагляднее показать соотношение гидрофильных и гидрофобных частей молекулы, справа в spacefill оставлены только гидрофобные атомы.
Гидрофобные атомы были определены в Jmol по вывешенному на kodomo скрипту (раздел "HYDROPHOBIC, PROTEIN"). Следуя скрипту, мы можем считать гидрофобными все S и C, не соединенные непосредственно с полярными атомами. Такие встречаются во всех аминокислотах, кроме глицина и серина.
Гидрофобные атомы составляют меньшую часть молекулы (2458 против 5762), распологаются в основном в глубине структуры, хотя часто выходят на поверхность.
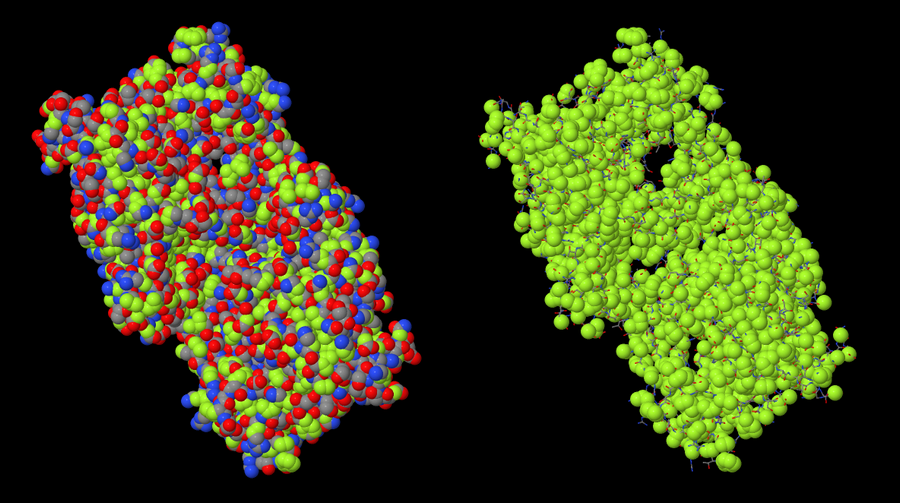
Рис.5 Гидрофобные атомы в белке CPAF. Гидрофобные атомы в модели spacefill изображены зеленым, гидрофильные покрашены соответственно элементам (цвета cpk). Слева гидрофильные в модели spacefill, справа - в модели wireframe.