Для сравнения структур, полученных путем ЯМР и PCA я выбрала белок среди PDB-структур, полученных разными методами. Белок рибонуклеаза T1 имеет множество страниц в PDB, среди них 2 расчитаны путем ЯМР. Для сравнения я взяла ЯМР структуру с идентификатором 1IYY и PCA структуру с идентификатором 3URP. ЯМР структура имеет 24 модели.
Если посмотреть на две структуры в PyMol, они весьма схожи, и состоят из одной α-спирали и 7 β-тяжей (показать все ЯМР модели одновременно можно командой "show all_states, on").
a) |
б) |
Рис.1. Структуры рибонуклеазы T1, полученные разными методами. а) - ЯМР-структура б) - PCA-структура.
В PCA структуре нужно было найти различные водородные связи (команда action -> find -> polar contacts)и проверить их наличие в ЯМР-модели. Считалось, между донором и акцептором есть водородная связь, если расстояние между ними меньше 3,5 Å, и водород не слишком отклоняется от линии донор-акцептор.
1. Связь в α-спирали:
на рис. 2 показана водородная связь между остовными кислородом Asp15 и азотом Ala19 в α-спирали 3URP. Длина связи 3,1 Å, при этом O, N и гипотетический H азота не находятся на одной прямой.
Как и ожидалось, в ЯМР-структуре эта связь присутствует во всех моделях, и составляет от 2,1 до 2,6 Å (измерить связь можно в Wizard -> Measurement). Медианная длина гораздо меньше, чем в PCA-модели, и равна 2,35 Å. При этом гораздо больше атомов находятся на одной прямой:
a) |
б) |
Рис.2. Водородная связь между Asp15 и Ala19 в α-спирали рибонуклеазы T1. а) - PCA-структура б) - ЯМР-структура.
2. Связь водородных цепей в ядре белка:
Я нашла близко расположенные полярные группы среди боковых групп аминокислотных остатков (action -> find -> polar contacts -> just intra-side chain). Большинство находится близко к поверхности, т.к. ядро белка гидрофобно, поэтому найти связь в ядре белка сложно. Я выбрала связь между Glu58 и Nδ атомом Arg77. Длина связи равна 3,3 Å.
В ЯМР-структуре, однако, расстояние между одним из кислородов Glu58 и водородом Nδ Arg77 меньше 3,5 Å только в одной модели (и равно 3,4 Å). При этом группы расположены близко, и есть несколько контактов между кислородом Glu58 и Nω-группами Agr77.
a) |
б) |
Рис.3. Водородная связь между Glu58 и Arg77 в ядре белка. а) - PCA-структура б) - ЯМР-структура.
3. Связь в петле, выходящей на поверхность глобулы:
Я выбрала контакт между боковыми группами Asn9 и Asp76 в петлях белка. Как видно, связь находится на поверхности глобулы (рис.4):
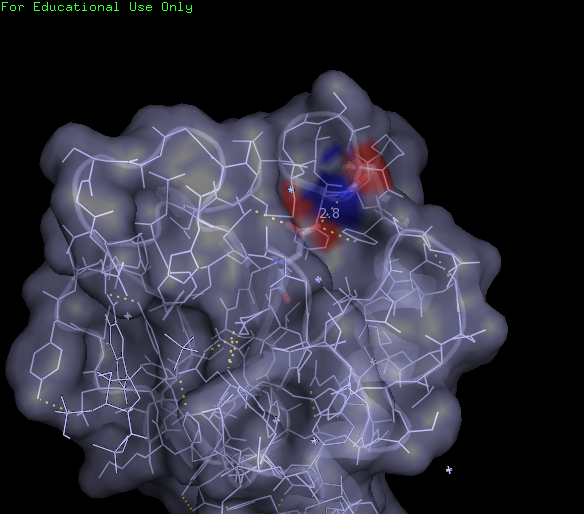
Рис.4. Положение Asn9 и Asp76 в глобуле белка.
Водородная связь длиной 2.8 Å. В ЯМР-структуре, однако, данная связь, длиной 2,2 Å, присутствует только в одной модели. Из-за свободного вращения боковых групп водородная связь нестабильна, отличие от остовных связей в элементах вторичной структуры.
a) |
б) |
Рис.5. Водородная связь между Asn9 и Asp76 в петлях белка. а) - PCA-структура б) - ЯМР-структура.
Итого:
| Какая связь | Расстояние в PCA | Доля моделей в ЯМР | min расстояние в ЯМР | med расстояние в ЯМР | max расстояние в ЯМР |
| 1. В α-спирали | 3,1 | 1 | 2,1 | 2,35 | 2,6 |
| 2. В ядре белка | 3,3 | 1/24 | - | 3,4 | - |
| 3. В наружных петлях | 2,8 | 1/24 | - | 2,2 | - |