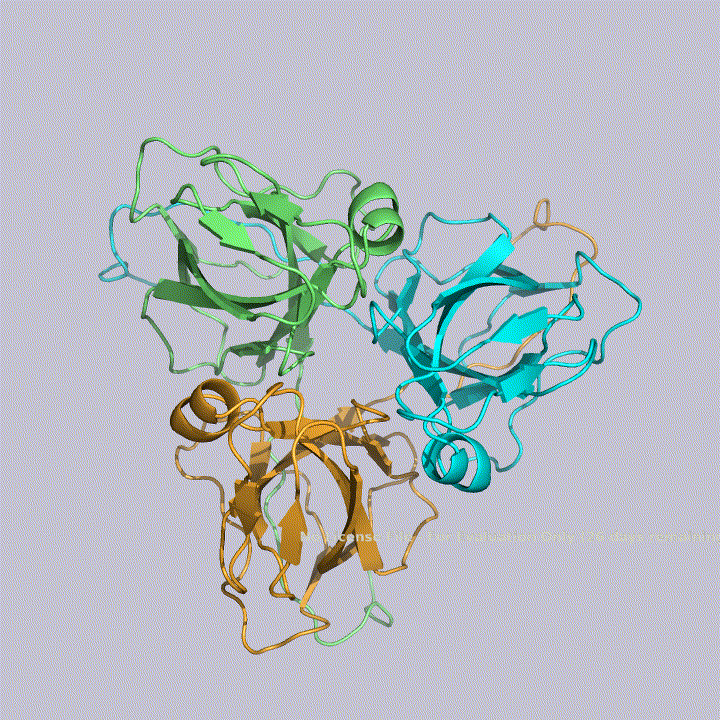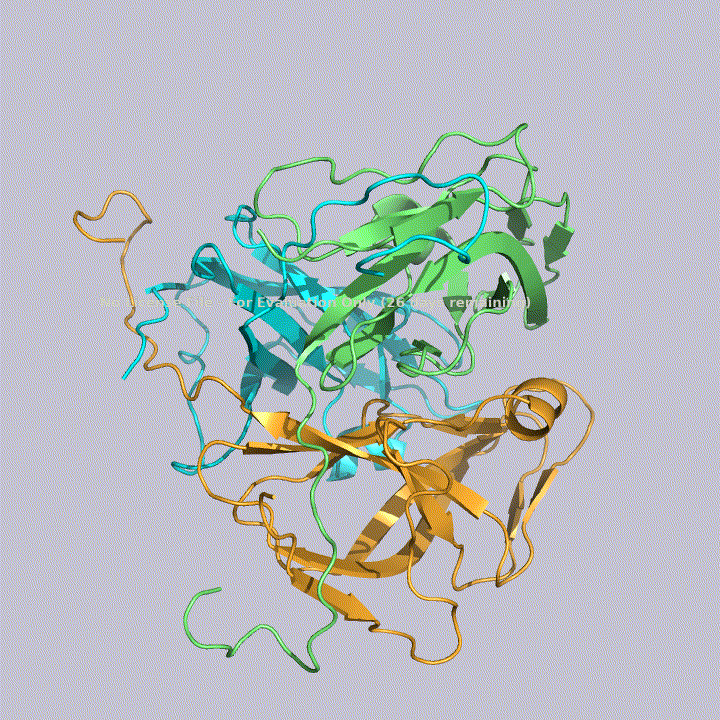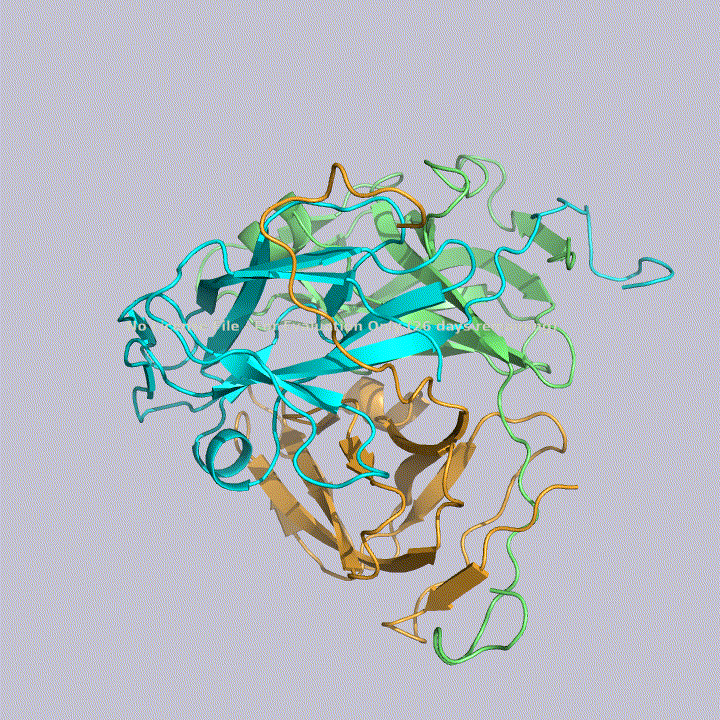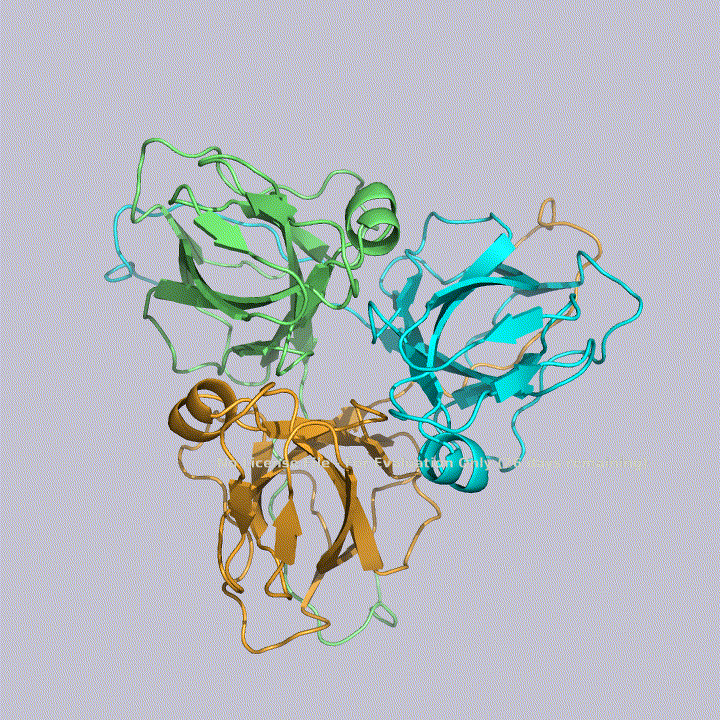Описание структуры dUTPазы M. tuberculosis
Ответы на вопросы о структуре в целом
Представлен белок-фермент dUTPаза из семейства гидролаз.
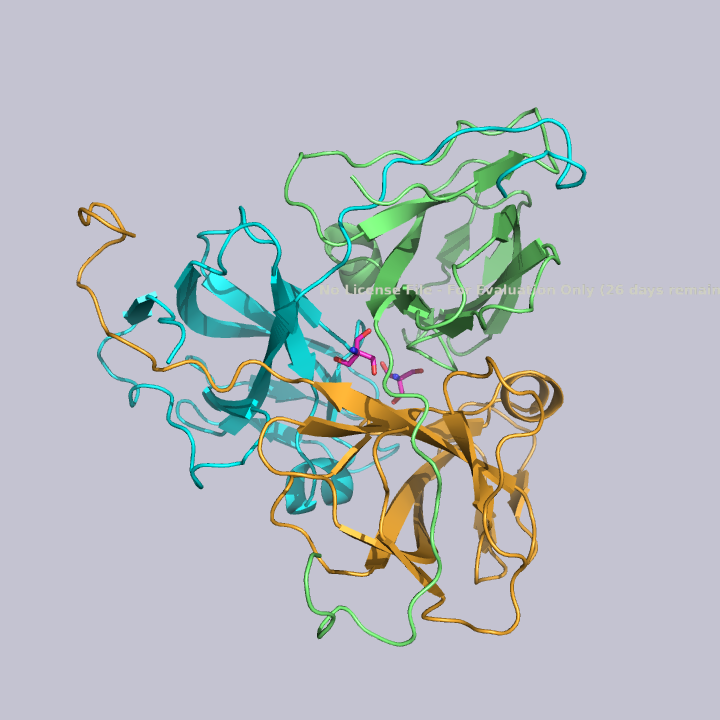
Его ассиметрическая единица состоит из одной цепи, а биологическая в свою очередь состоит из трех ассиметрических единиц, расположенных по кругу, как показано на рисунке 2. Получается, исследуемый белок — гомотример.
Ответы на вопросы об отдельных цепях
Белок принадлежит организму Mycobacterium tuberculosis, его идентификатор в Uniprot: P9WNS5. По-русски белок называется дезоксиуридин 5`-трифосфат нуклеотидгидролаза. В организме бактерии белок занимается гидролизом dUTP до пирофосфата и dUMP. Уменьшение концентрации dUTP в среде способствует тому, что dUTP не встраивается в ДНК. Также, dUMP является предшествеником тимидиновых нуклеотидов. В аминокислотной последовательности нет мутаций относиельно референса. Также, в первичной структуре белка не содержится модифицированных аминокислотных остатков.
Ответ на вопрос о типе структур
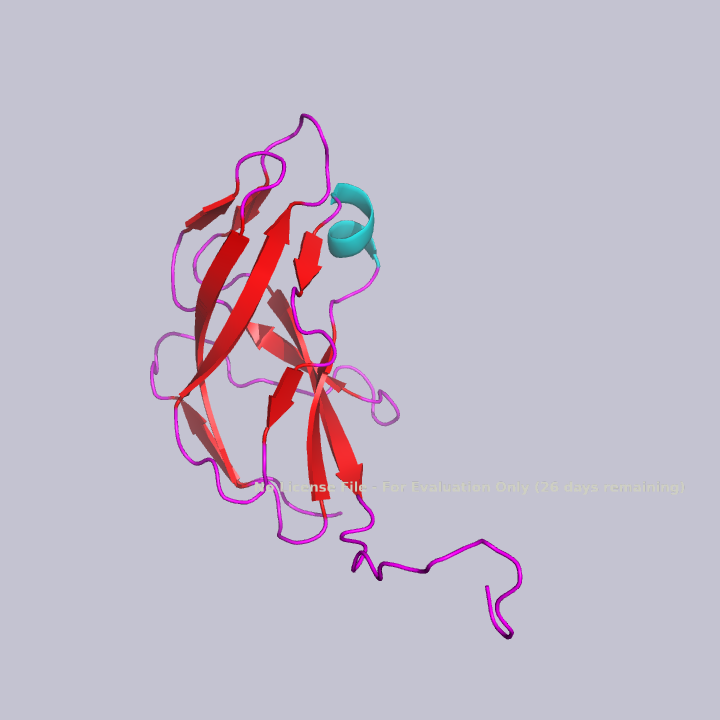
Вторичная структура белка состоит из одной короткой альфа-спирали, нескольких бета-листов и петель, как видно на рисунке 3.
Ответы на вопросы о малых молекулах
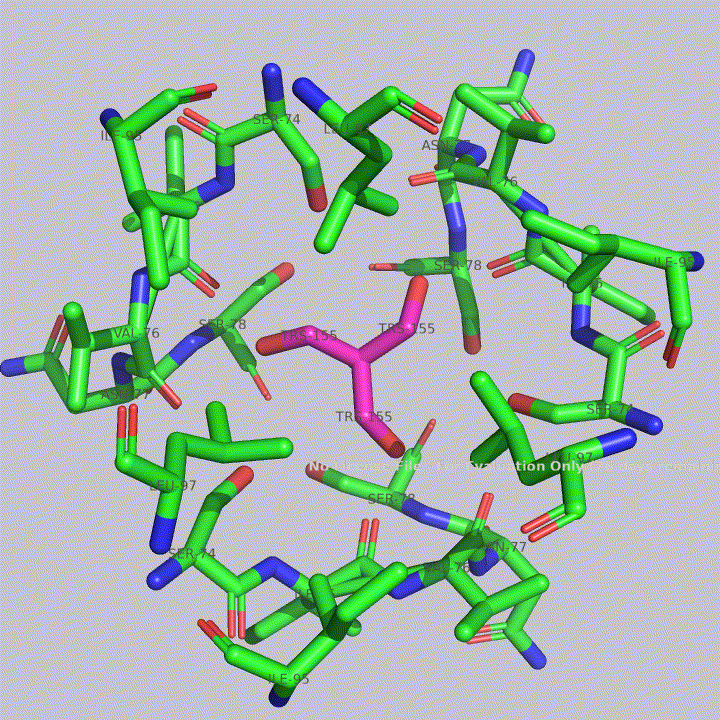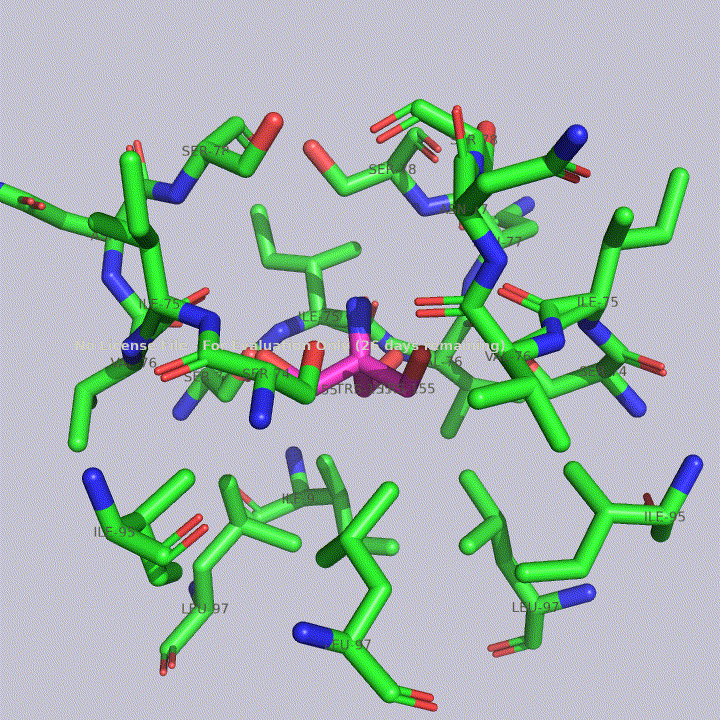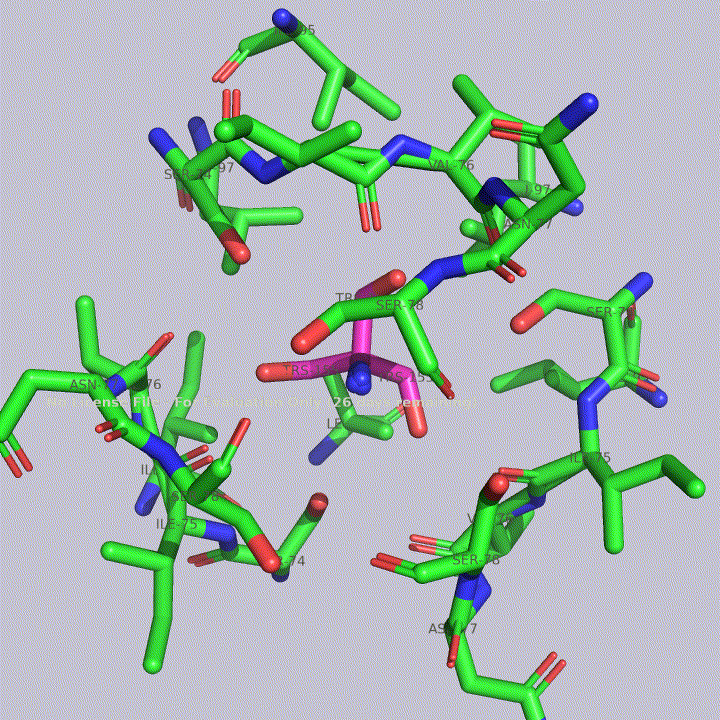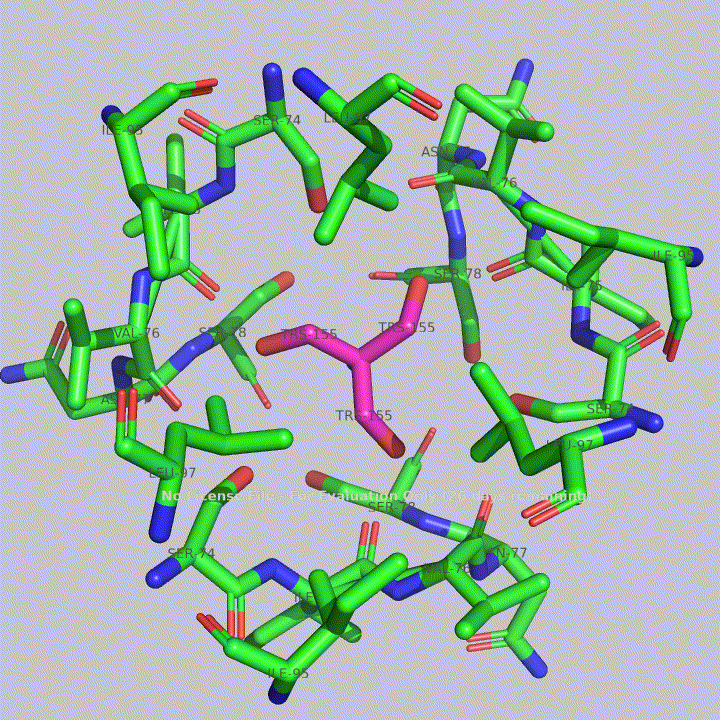
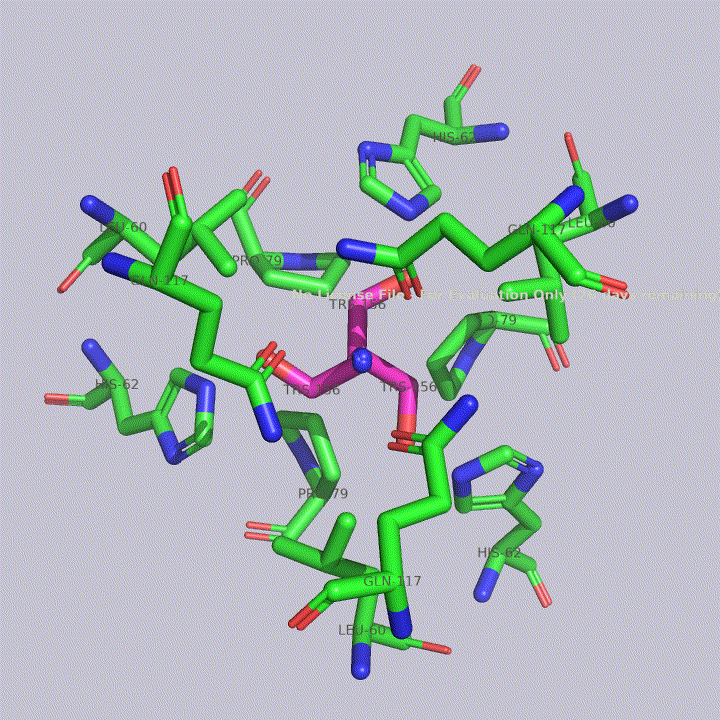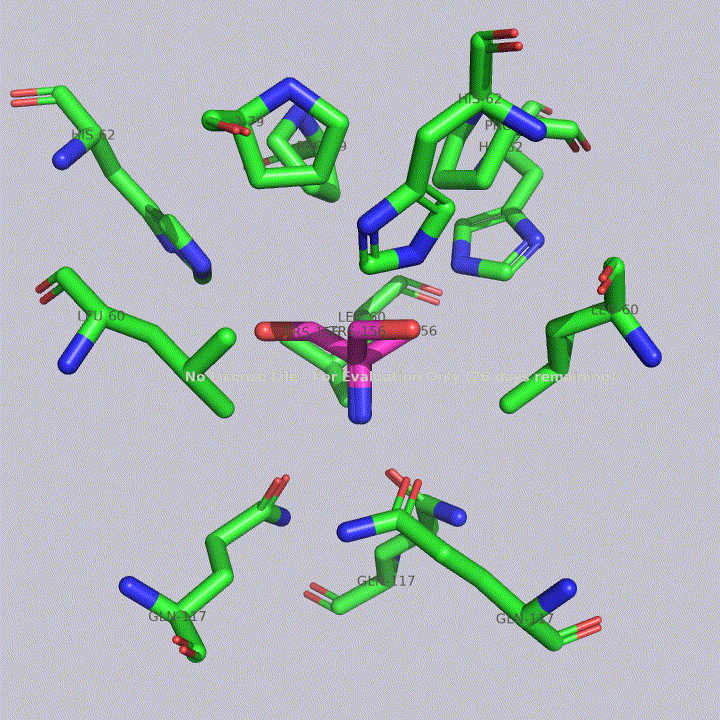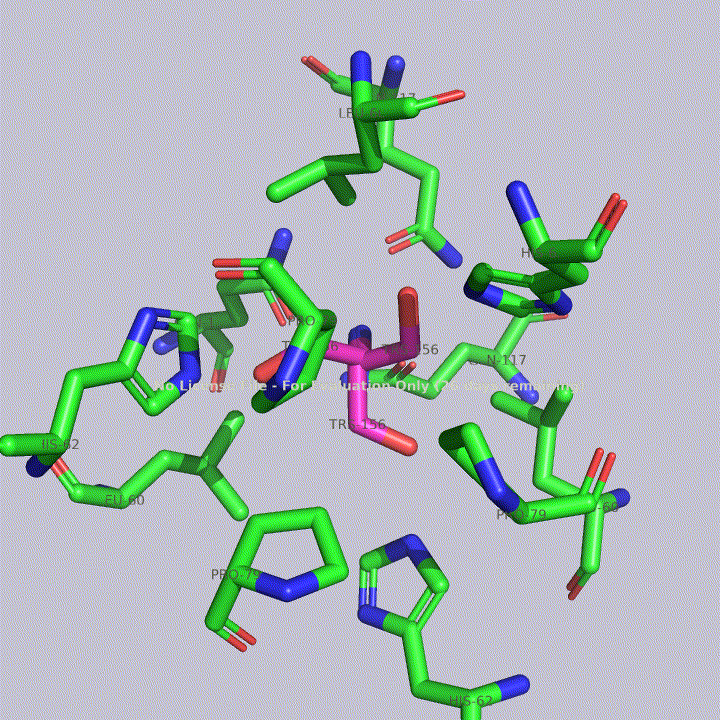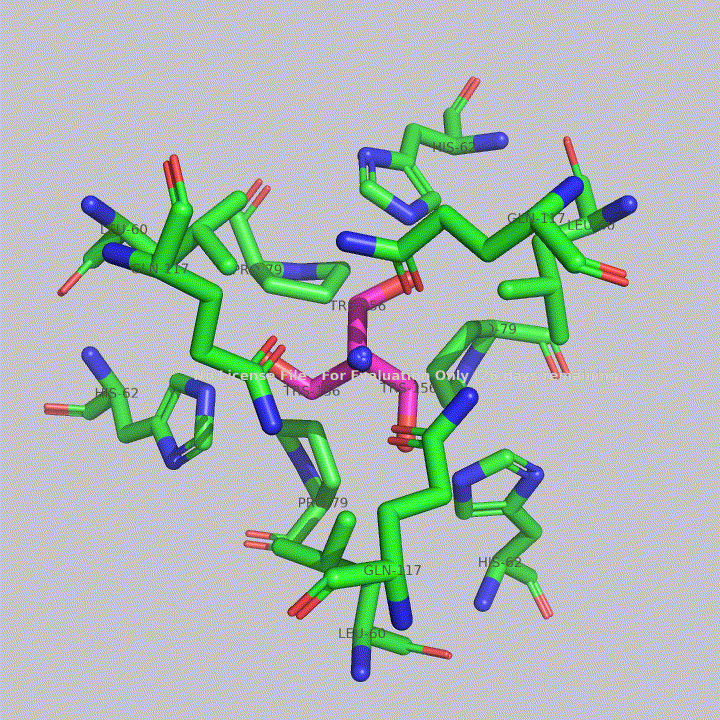
Из малых молекул в запись помимо молекул воды попали две молекулы триса - 2-амино-2-гидроксиметилпропандиола-1,3. Это вещество используется в соствае широко распространенных буферов. Собственно, почитав статью исследователей этого белка, можно прийти к выводу, что трис попал в запись именно из буфера. Исследователи, по связям триса с белком, предположили, что производные триса могут использоваться для ингибирования этого белка. Молекулы триса располагаются в полости между тремя субъединицами фермента, что показано на рисунке 4. На рисунках 5 и 6 показаны белковые окружения первой и второй молекул триса соответственно.
Ссылка на файл с кодом TRS.Информация о межатомных взаимодействиях в белке
Дисульфидных мостиков в белке не оказалось: из серусодержащих аминокислот в белке представлен только метионин (по одному остатку в каждой из трех цепей), соответсвенно нет цистеина, а значит и возможности образовать дисульфидные мостики.
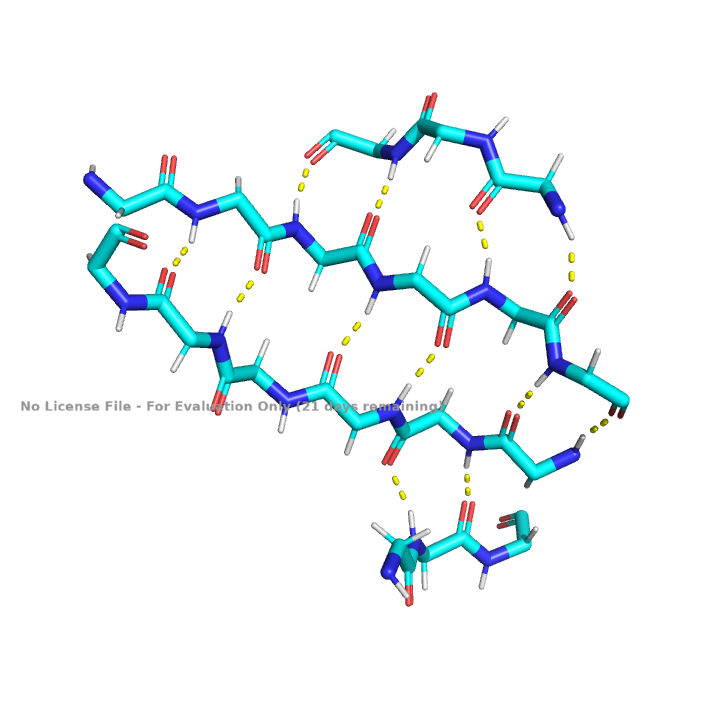
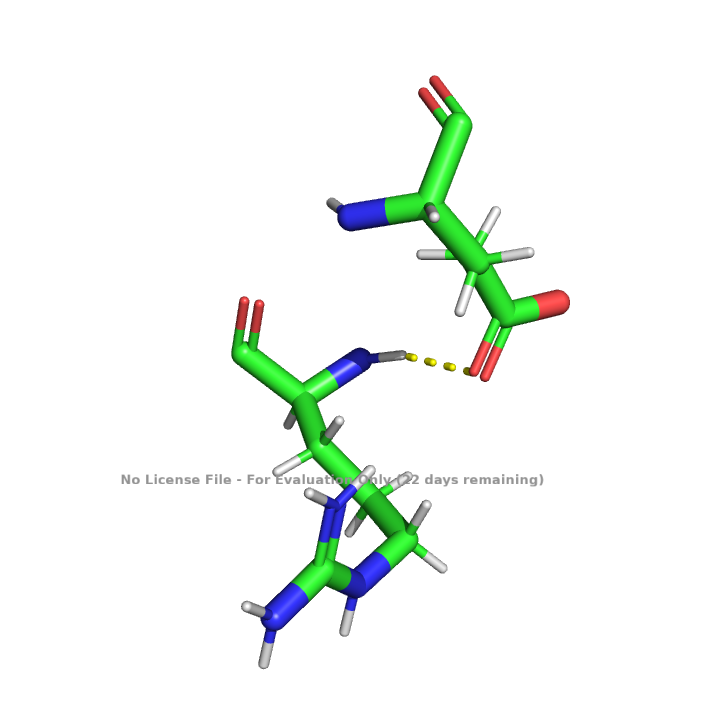
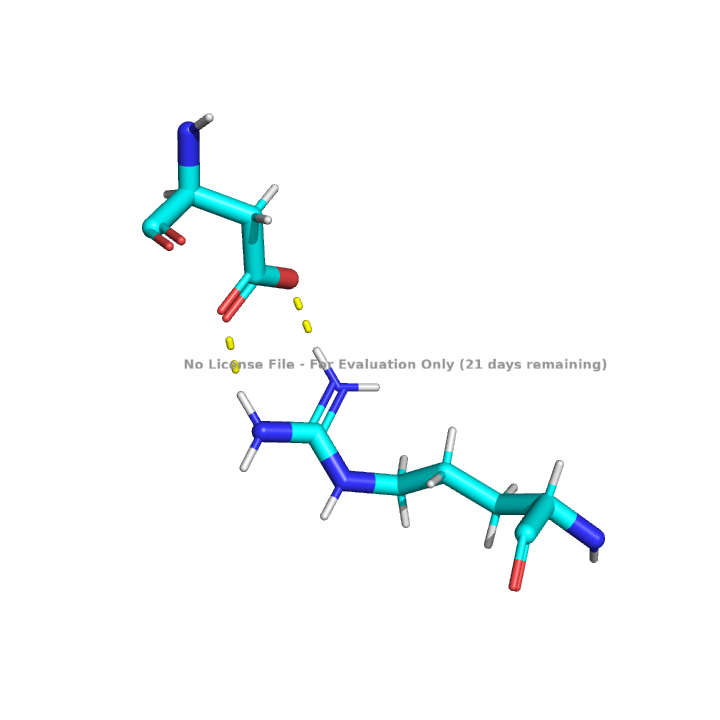
Белок изобилует водородными связями. Как было сказано выше в белке присутствуют альфа-спирали и бета-листы. Такие типы вторичной структуры стабилизируются водородными связями между атомами аминокислотного остова белка, показанными на рисунках 7 и 8. Водородные связи существуют не только в пределах аминокислотного остова белка, что показано на рисунке 9.
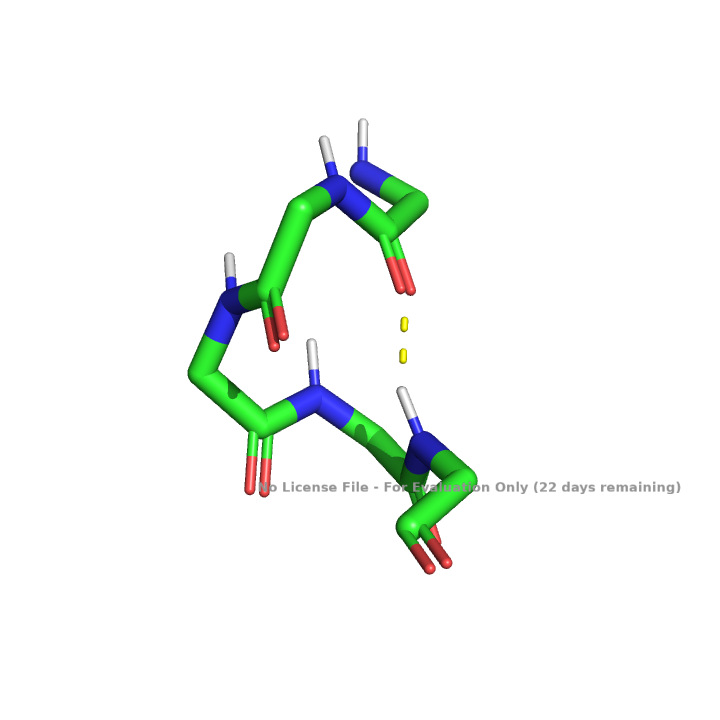
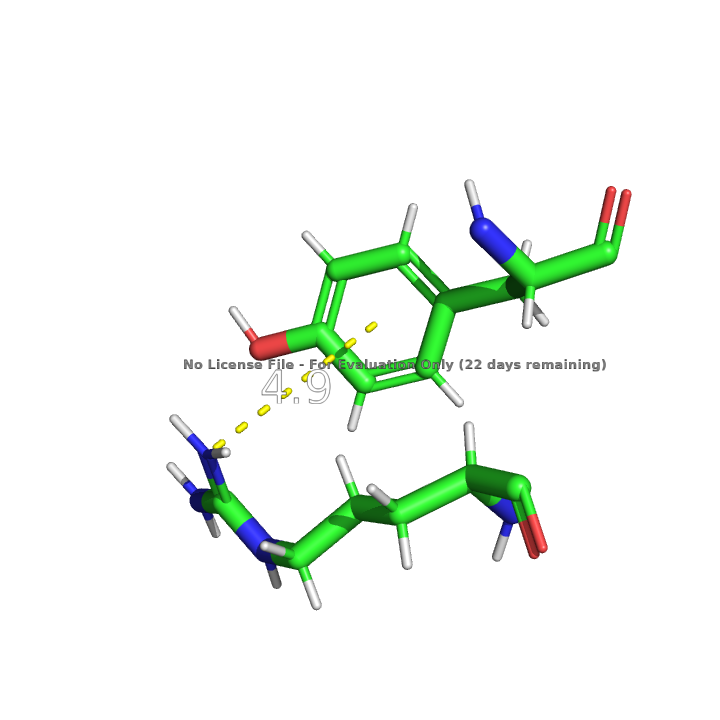
В белке представлено несколько солевых мостиков между разнозаряженными радикалами остатков аминокислот, один из таких мостиков показан на рисунке 10.
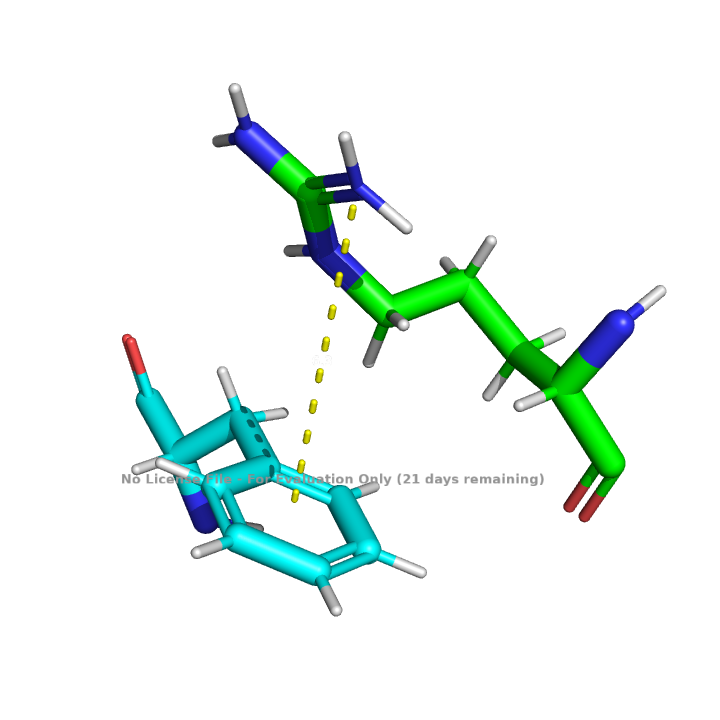
В белке нет пар близкорасположенных ароматических колец, но я обнаружил группы, между которыми, вероятно, наблюдается пи-катионный стекинг, причем одно из таких взаимодействий наблюдается между радикалами аминокислотных остатков двух белковых цепей. Предположу, что такие взаимодействие стабилизируют структуру тримера. Взаимодействия представлены на рисунках 11 и 12.