В данном практикуме мы продолжаем изучать особенности данных, полученных методом рентгеноструктурного анализа. Сейчас обратим внимание на то, что некоторые остатки могут принимать при кристаллизации альтернативные конформации, какие-то участки молекулы в принципе более подвижны, а также рассмотрим фрагмент кристаллической решётки.
Для работы мне был выдан PDB ID 6IXD.
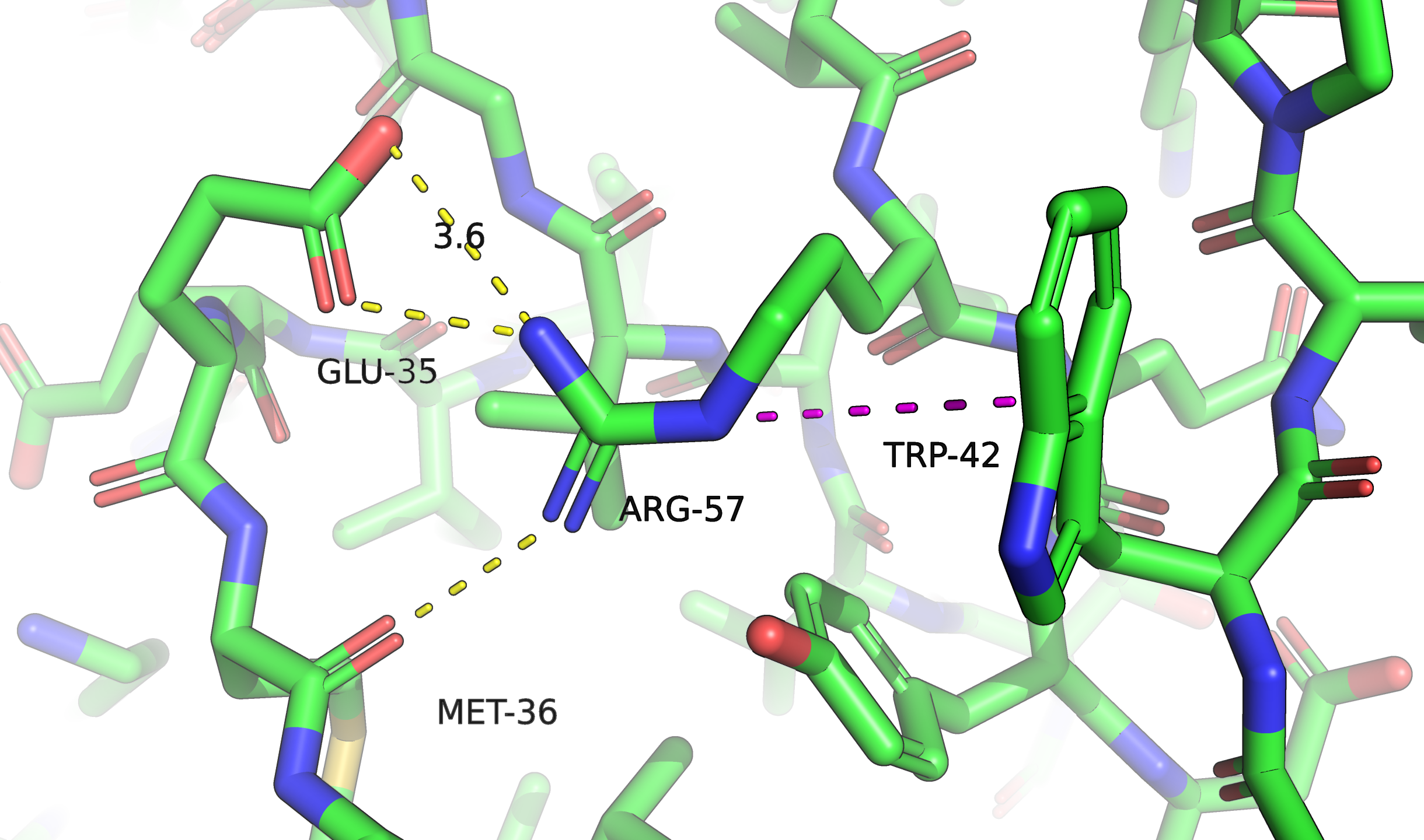
В данном задании мне нужно было исследовать остаток R57 из цепи A. У него два альтлока, A и B. Значения occupancy из файла PDB — $0{,}56$ и $0{,}44$ соответственно. Положения боковой цепи для этих альтлоков показаны на рис. 1.


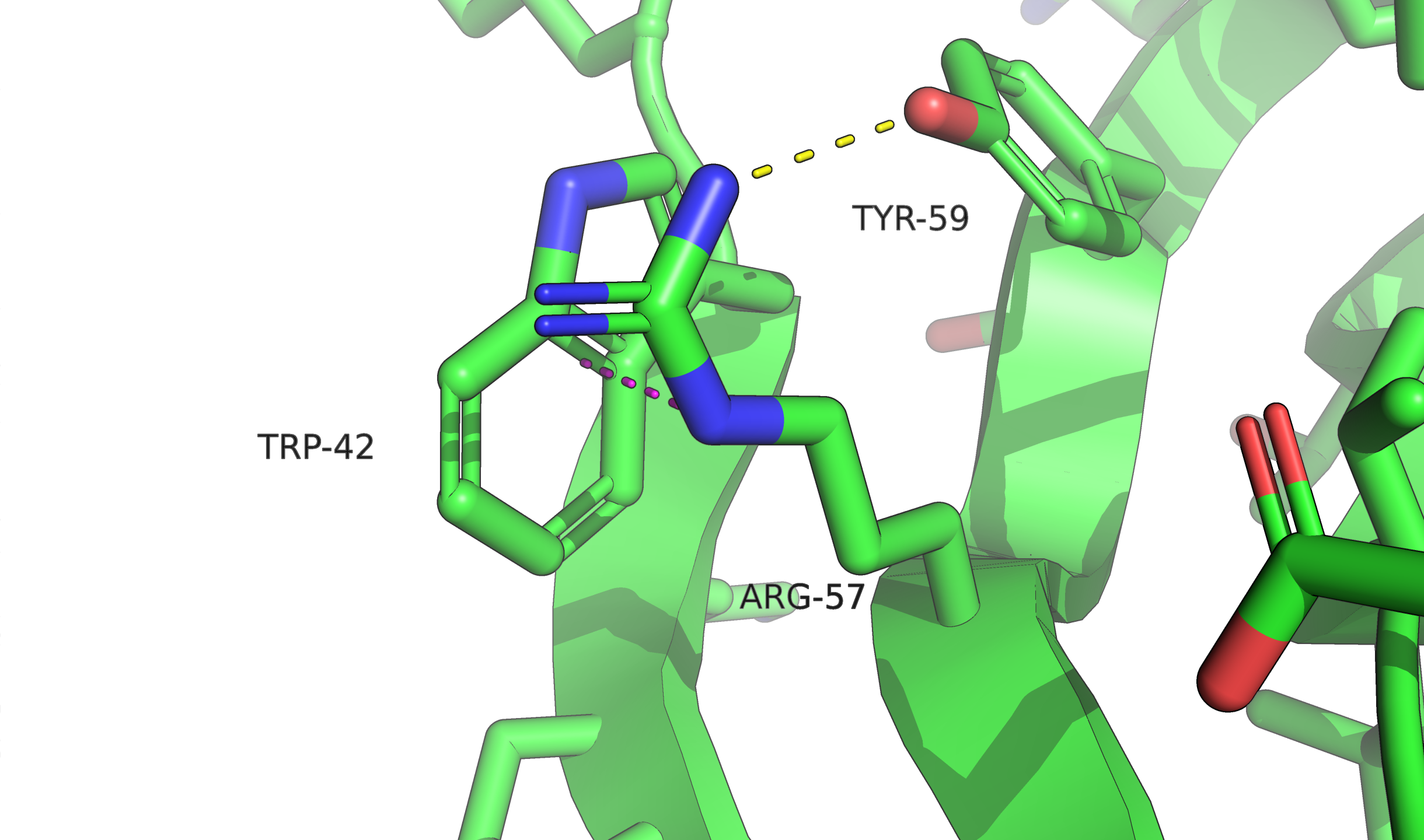
Альтлок A стабилизирован водородной связью с остовом, потенциальным T-стекингом, солевым мостиком с глутаматом (солевой мостик в комбинации с водородной связью с тем атомом кислорода, до которого меньше расстояние, а до другого атома расстояние $3{,}6$ Å и преобладает именно электростатическое взаимодействие). В случае B наблюдается только водородная связь с 59-м тирозином и параллельный стекинг.
По виду конформация слева стабилизирована лучше (больше водородных связей и есть солевой мостик). И действительно, параметр occupancy для неё слегка больше.
B-фактор характеризует подвижность конкретных атомов в структуре. В прошлом практикуме я предложил объяснение для факта, что по краям белковой глобулы электронная плотность ниже, через то, что там может быть повышена подвижность атомов. Можно взглянуть на структуру, раскрашенную по B-фактору, и проверить, согласуется ли это с моей гипотезой (см. рис. 2).
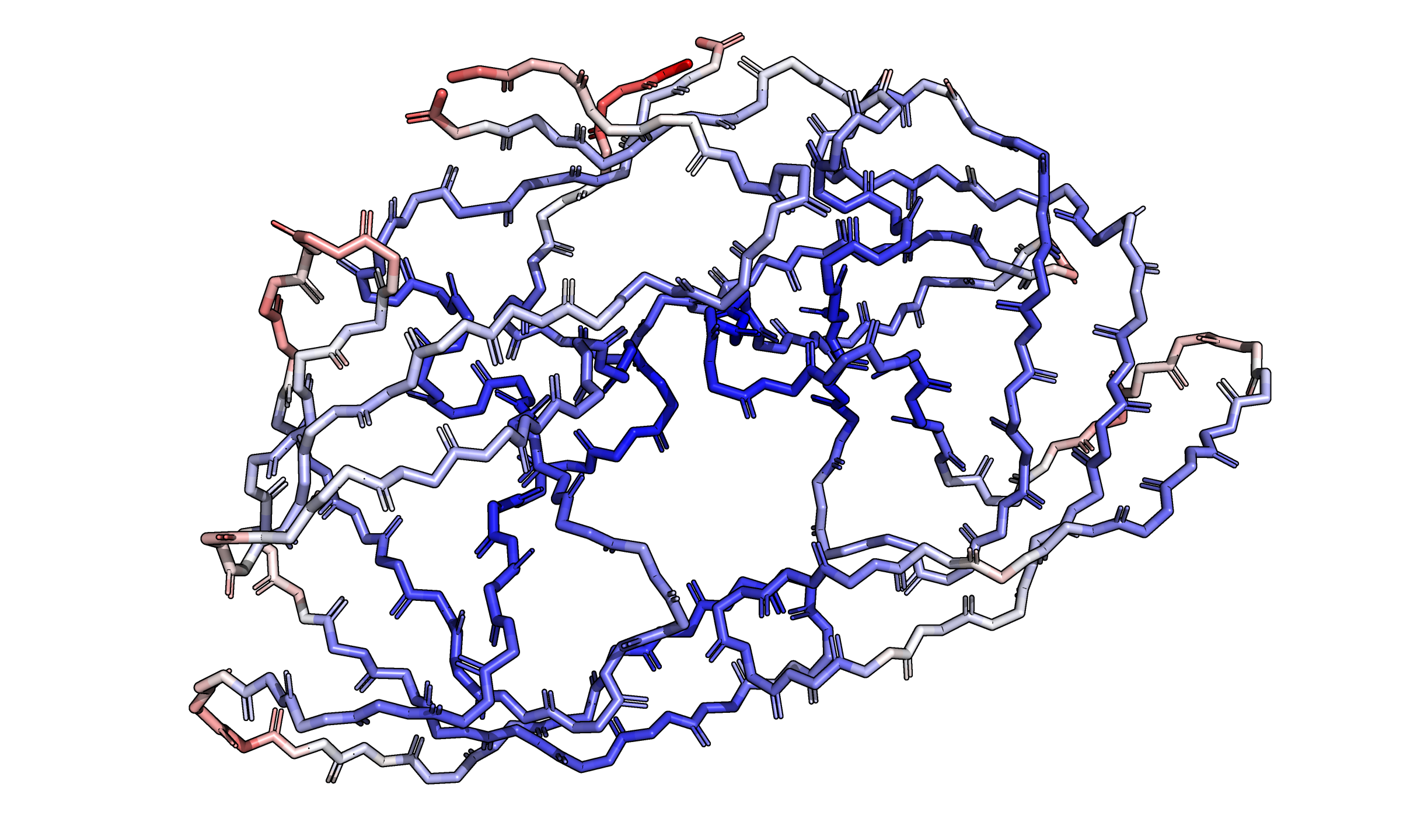
Всё так, как и предполагалось: к центру глобулы атомы раскрашены синим, подвижность минимальна, а ближе к краю цвета переходят в белый и красный.
Посмотрим не только на остов, но и на боковые цепи аминокислотных остатков. Среди них выделяется остаток R41 цепи A, ярко краснеющий с приближением к гуанидиновому концу. Этот остаток находится на краю глобулы, а его боковая цепь окружена растворителем, так что повышенная подвижность вполне объяснима. Изобразим его с электронной плотностью на уровнях подрезки $3$, $1{,}5$ и $0{,}5$ (см. рис. 3). Фрагмент настолько подвижен, что только на уровне $0{,}5$ можно увидеть электронную плотность у гуанидиновой группировки.
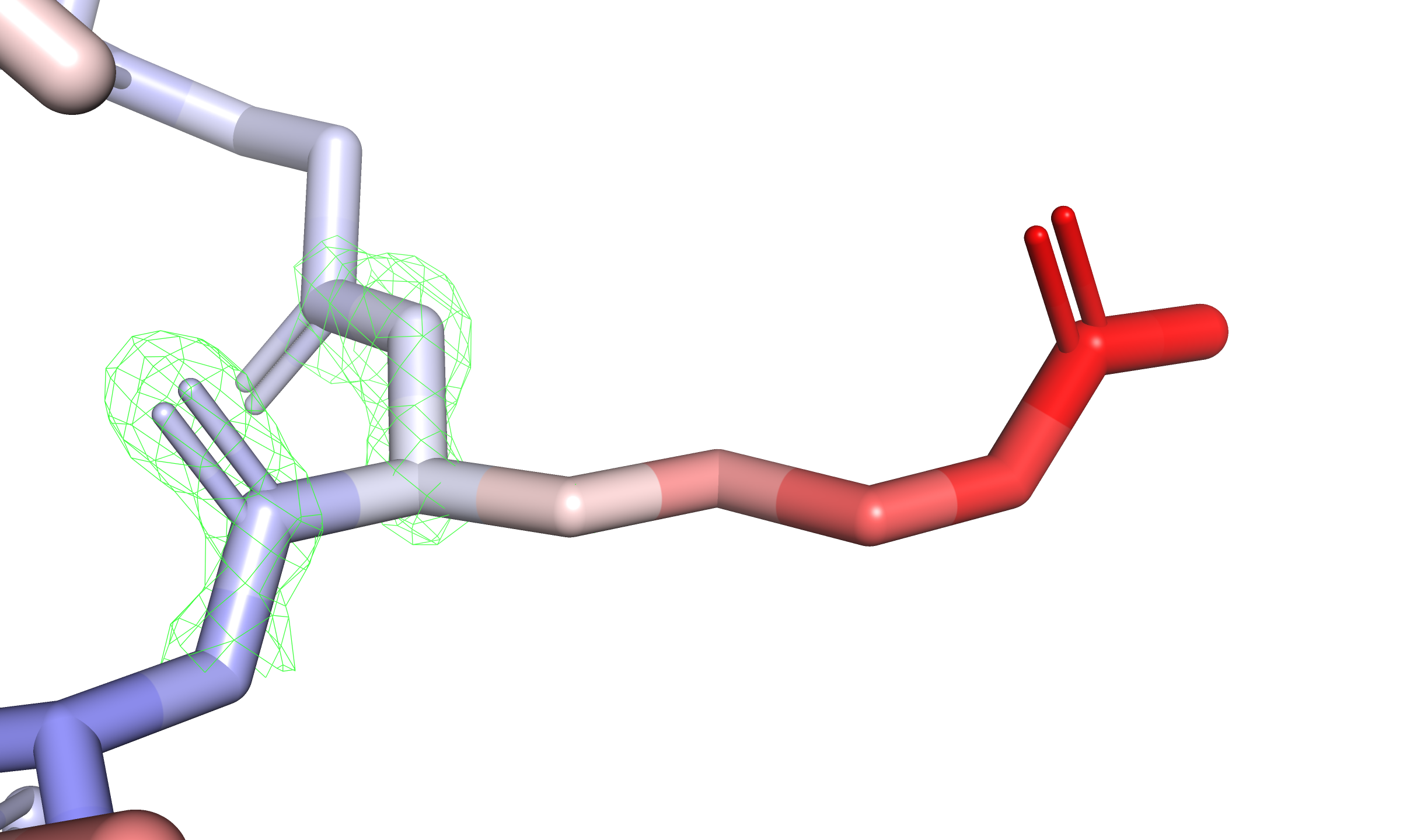
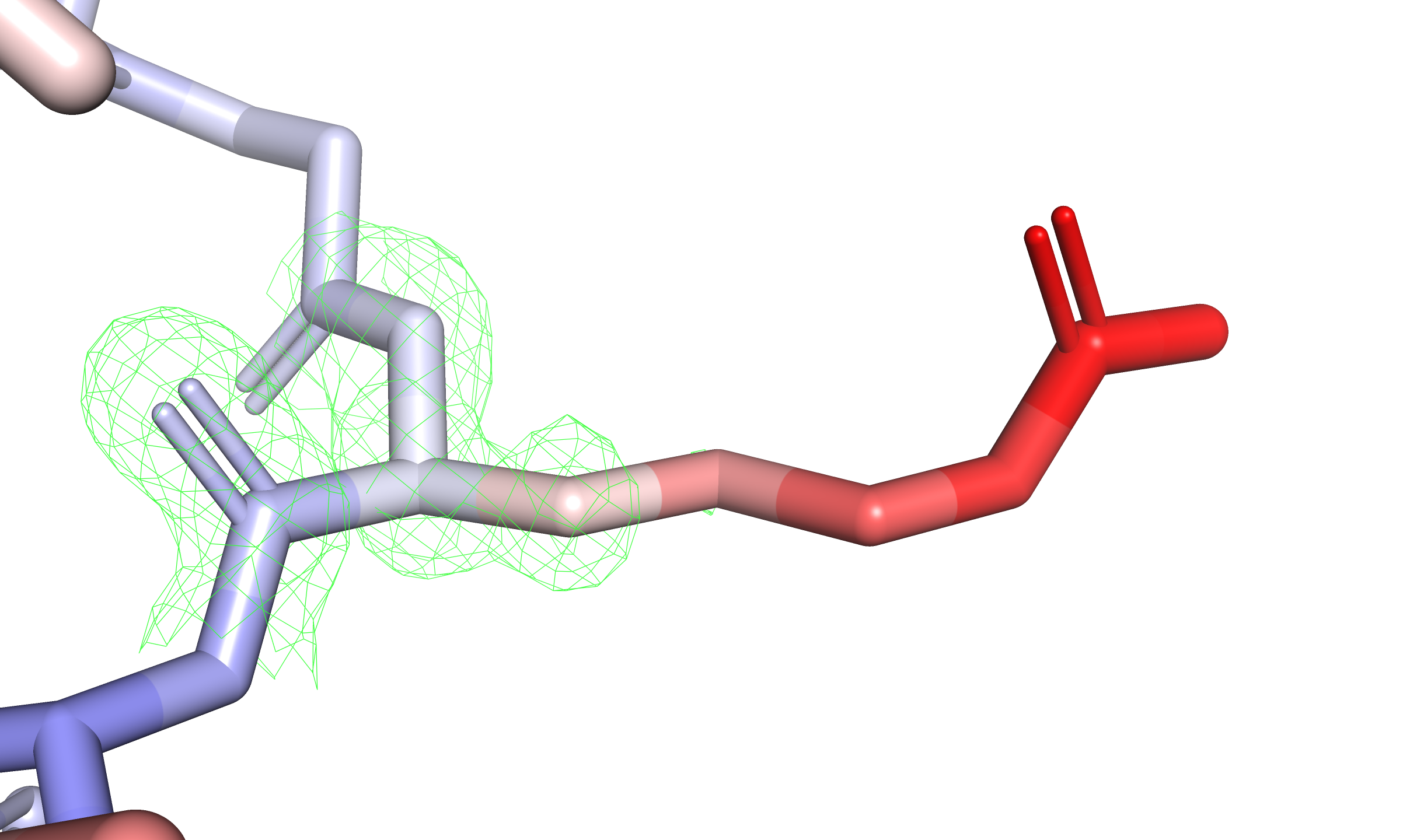
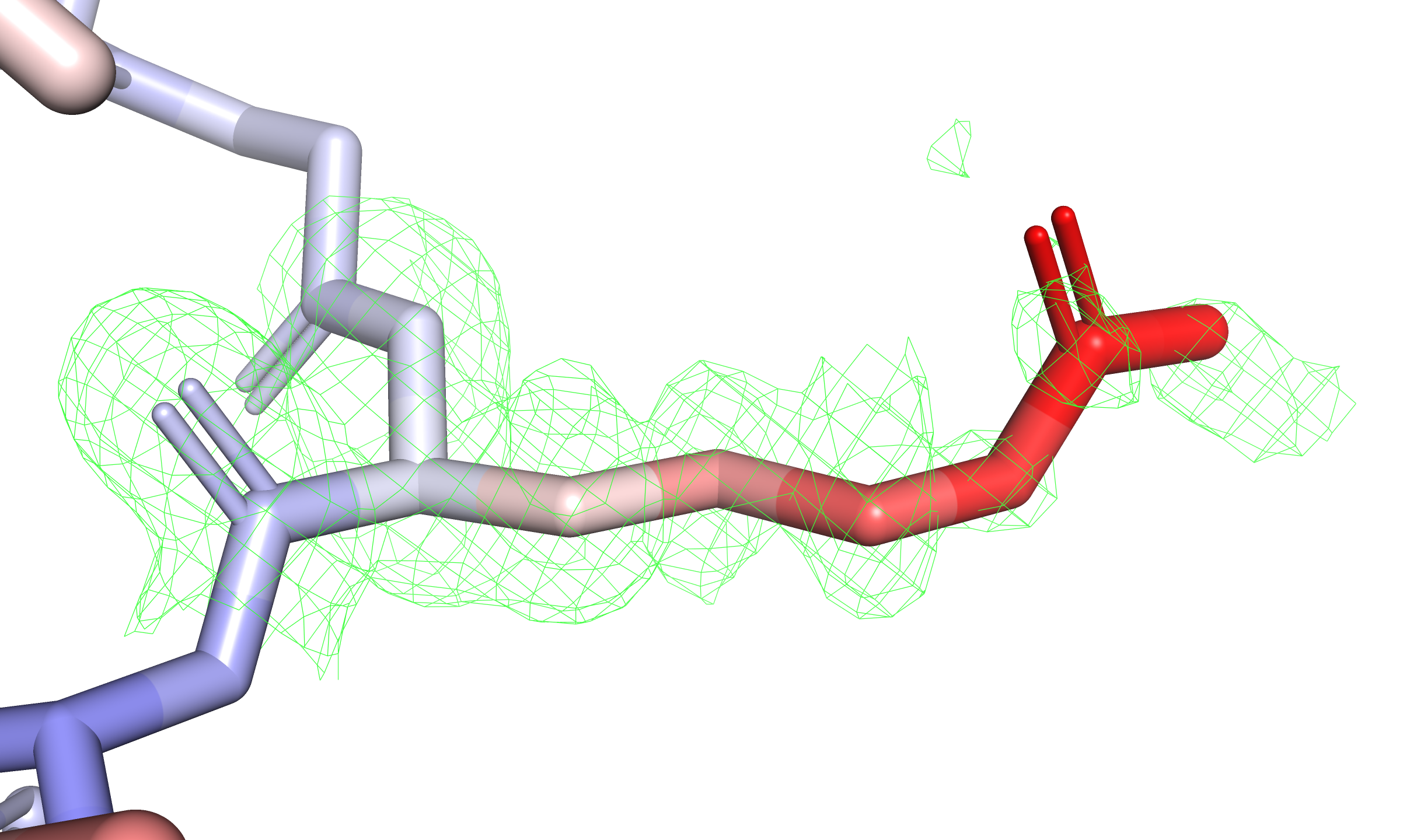
Получается, что B-фактор в отдельных случаях может быть настолько большим, что колокола электронной плотности соответствующих атомов будут едва ли отличимы от шума (плотность на уровне $0{,}5$ сильно зашумлена). В таких случаях затруднительно определить реальное положение фрагмента в кристалле — хоть одно из возможных.
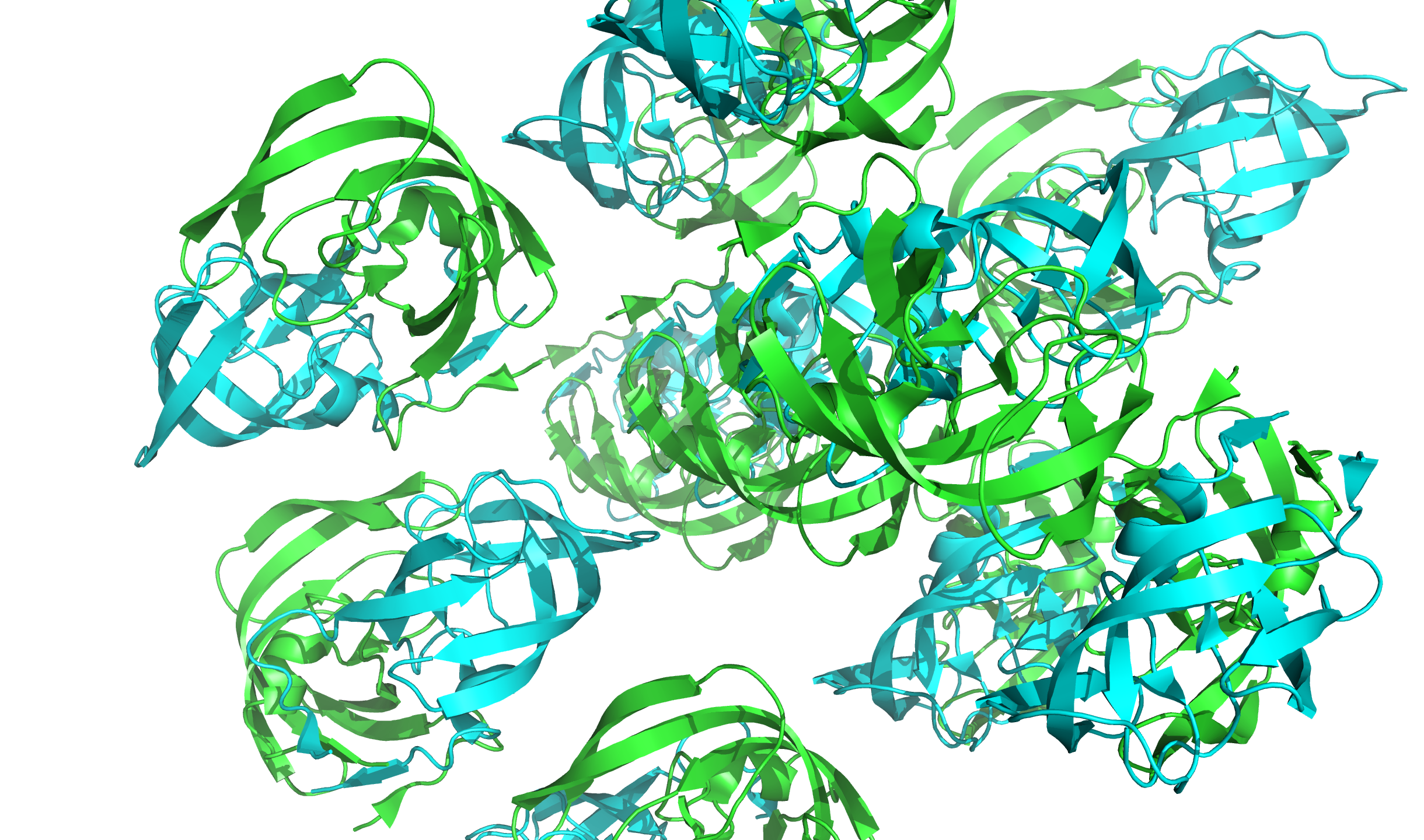
В файлах PDB также пишут тип симметрии кристалла, по которому получена структура белка. Это позволяет по одной ячейке рассчитать, как расположены в пространстве кристалла окружающие молекулы. Сгенерируем «соседей» нашей молекулы с уровнем отсечки $8$ Å и покажем, как они находятся в составе кристалла (рис. 4).
Изображать молекулы удобнее в виде cartoon, но хорошее отображение даёт и surface. Я использовал его, чтобы визуально определить, со сколькими «молекулами» соприкасается наша изначальная. Получил, что у неё $6$ ближайших соседей. Изобразил их снова как cartoon, раскрасив в разные цвета (рис. 5).
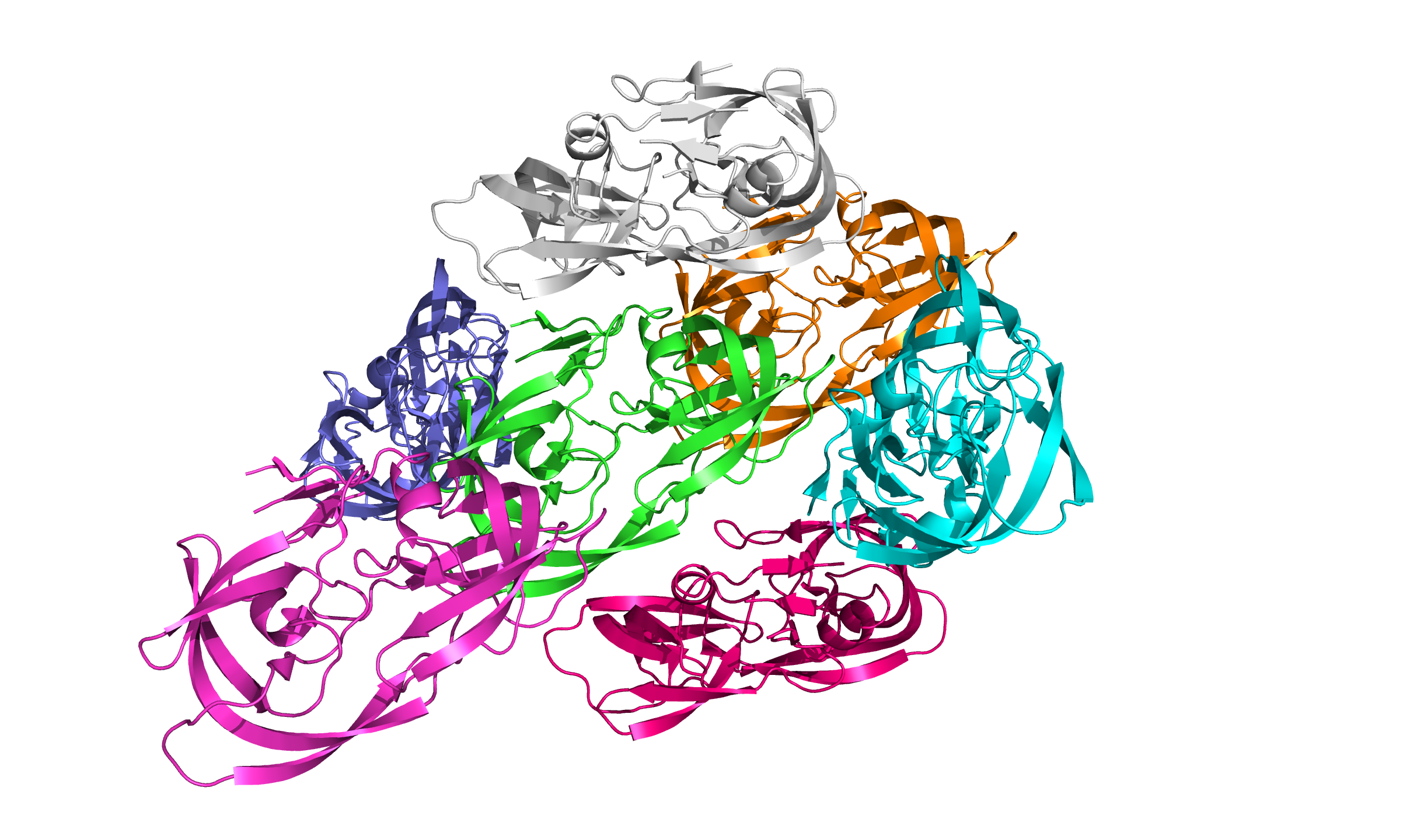
В этом практикуме мы увидели, что кристаллы белков состоят из очень похожих, но при этом в чём-то различающихся частиц. Некоторые остатки могут занимать какие-то определённые альтернативные положения (альтлоки), а какие-то участки белка движутся более свободно.