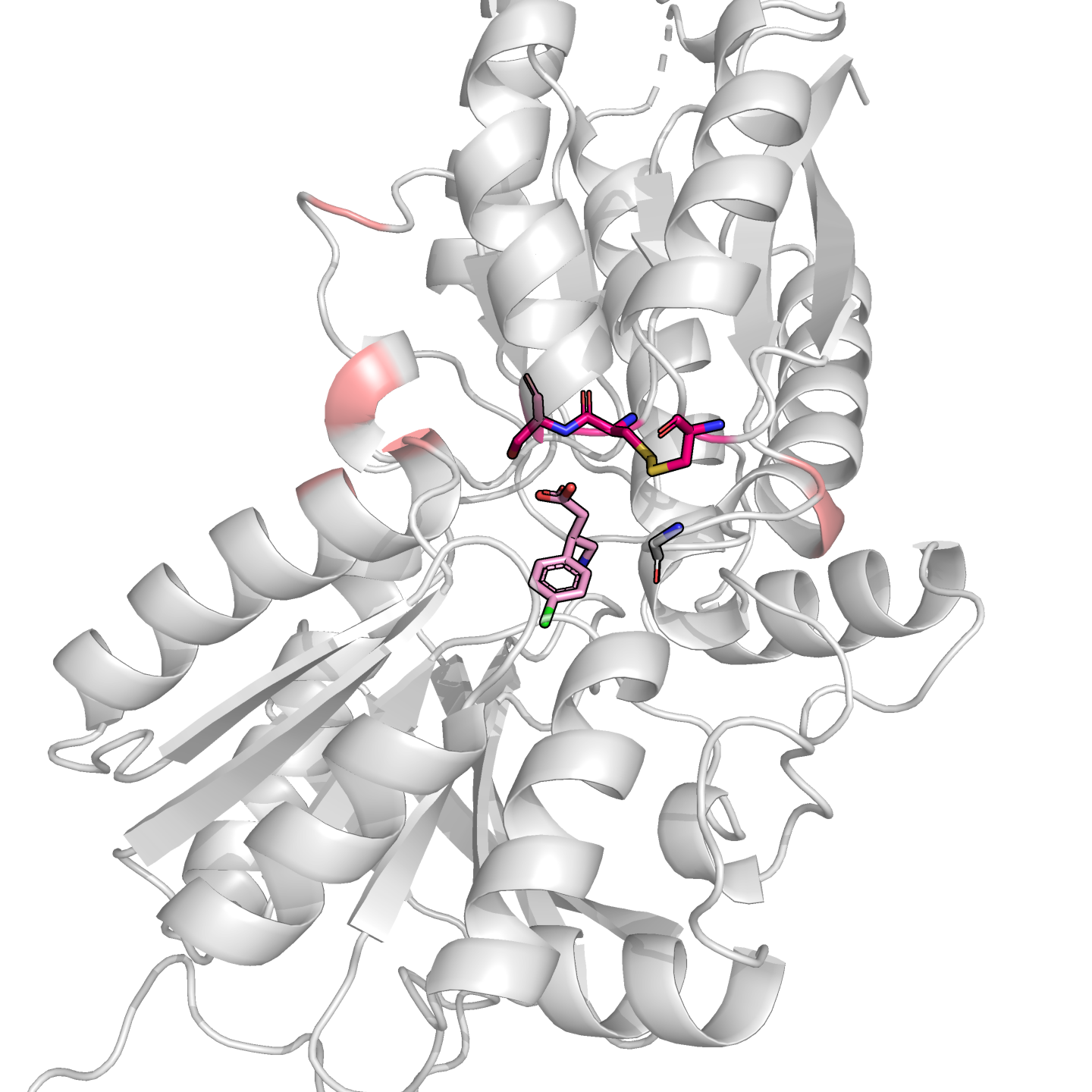
В данном практикуме мне даны две структуры одного и того же белка — в свободном виде и в комплексе с низкомолекулярным лигандом. Внимательно изучим две формы и посмотрим на изменения, которые произошли с карманом связывания. На рис. 1 сравниваются структуры свободного и связанного состояния. Так как у лиганда очень богатое окружение, некоторые остатки видны не целиком.

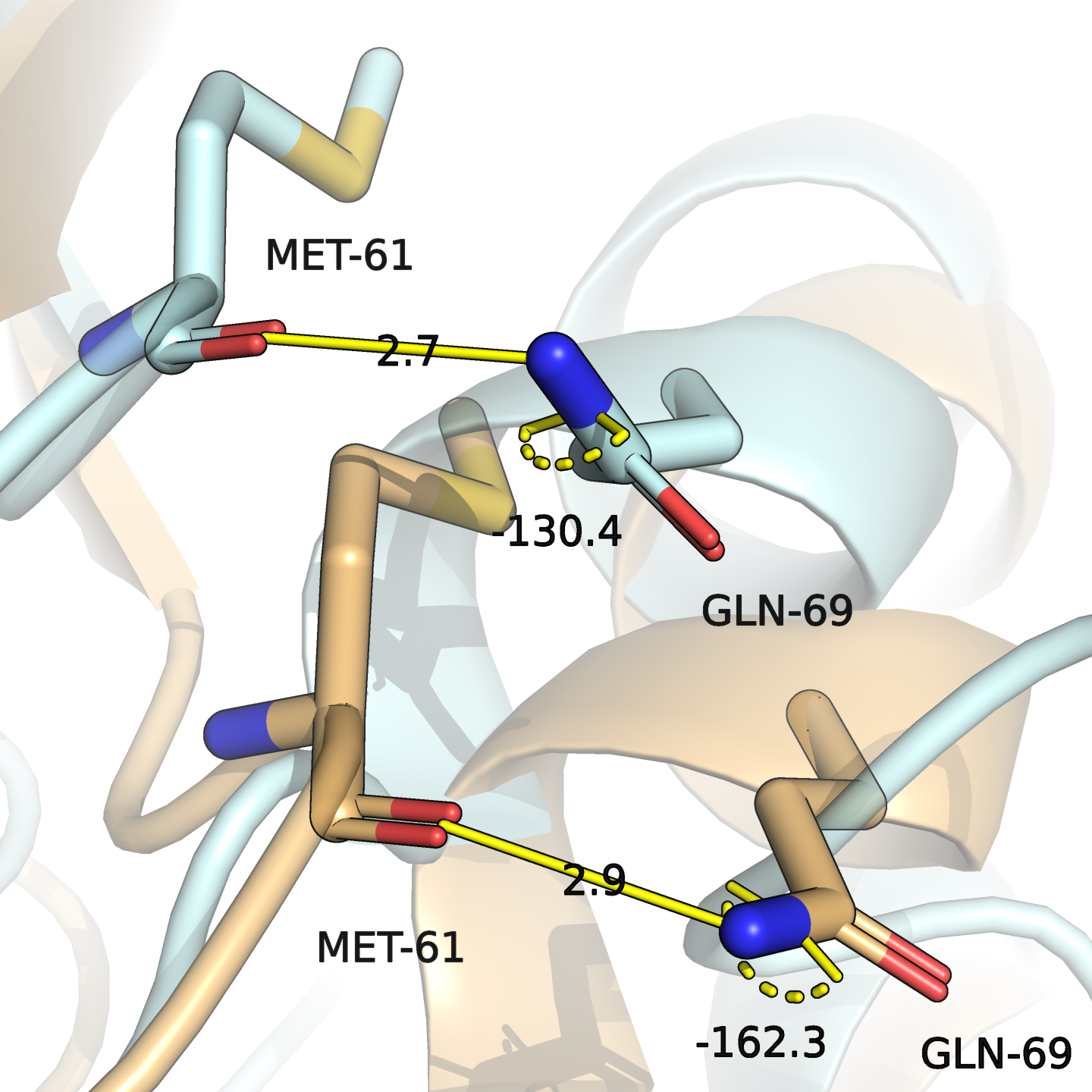
В основном остатки подвинулись на 2–3 Å, но некоторые сильнее, например W278 (боковой радикал переместился на целых 8 Å!). Какие-то спирали и петли сблизились, в результате чего возникли новые водородные связи (см. рис. 2).
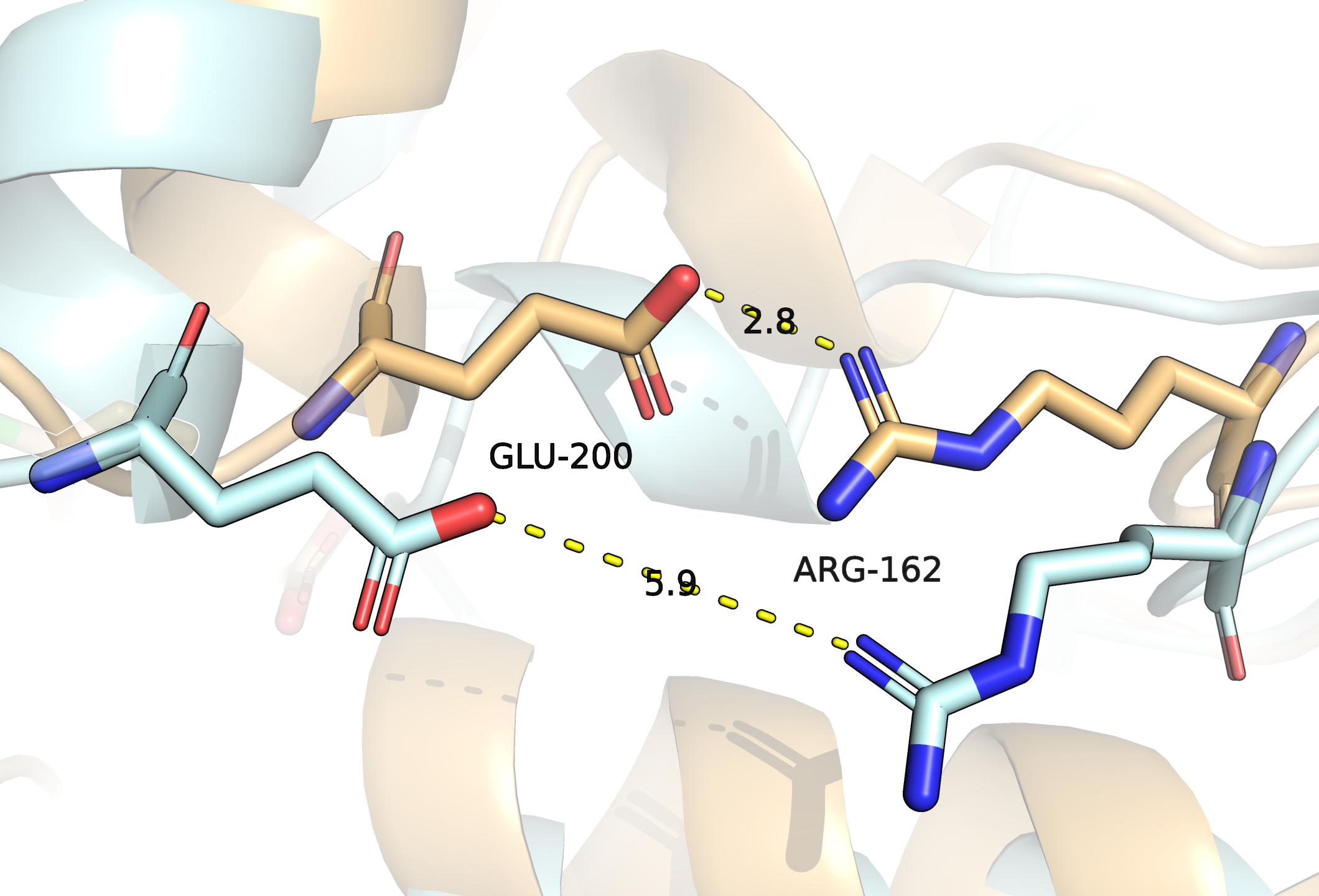
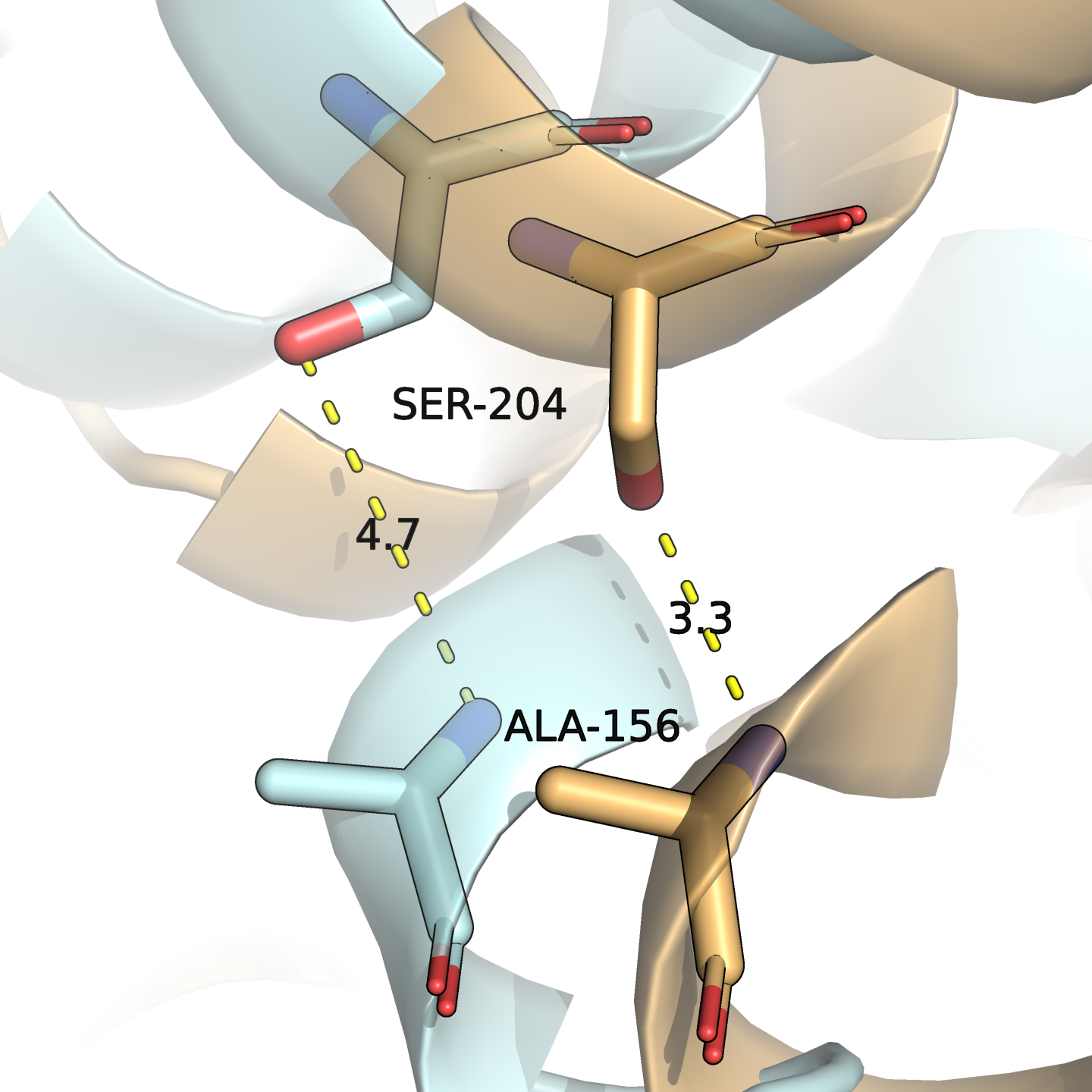
Иногда возникновение новых связей сопровождалось удалением остатков — при условии возникновения подходящего угла (пример показан на рис. 3).
В случае свободной формы о связи речи не идёт, так как направление на потенциальный акцептор отклоняется от плоскости NH2-группировки на целых 50 °, для связанной формы ситуация получше (18 °).
Изменения, способствующие появлению водородных связей, вероятно, передаются на далёкие от кармана связывания лиганда остатки по определённой сети взаимодействий. Так, пример появившейся в результате улучшения углов связи можно объяснить тем, что остаток S129 связал лиганд, подвинул C130, а тот уже связан дисульфидным мостиком с C103. 103-й цистеин входит в мотив, в котором появилась новая связь, он уже, наверное, довольно легко передал сигнал об изменении дальше вплоть до найденных связавшихся друг с другом остатков.
Посмотрим на общую конфигурацию карманов в структурах, загрузив их в POCASA. Результат приведён на рис. 5.
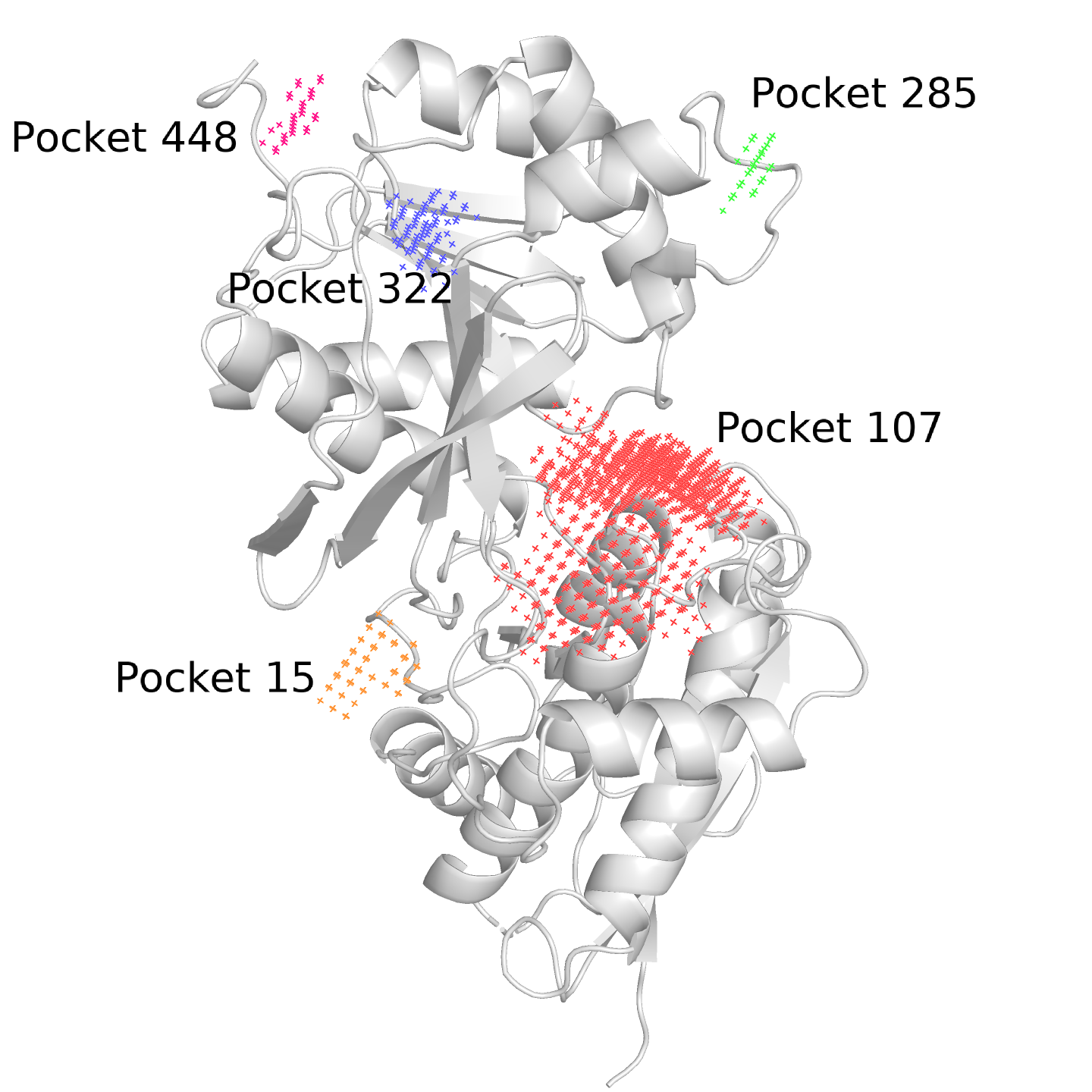
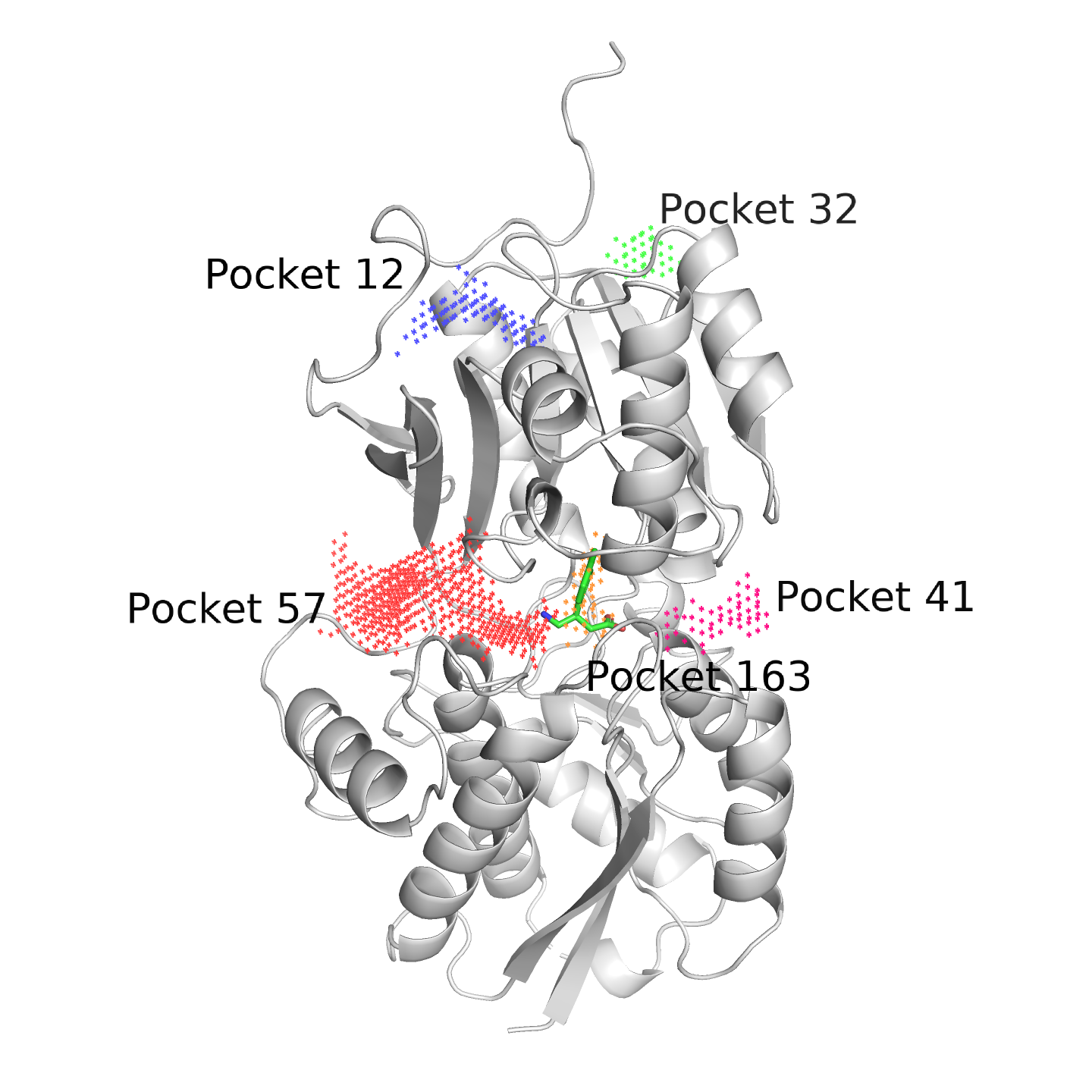
В целом программа неплохо нашла карманы, причём есть даже такие незначительные, как те, что отмечены зелёным. Наверняка в динамике белка маленькие карманы вроде 285-го появляются и исчезают, это в кристалле они фиксируются в одном положении.
В связанном состоянии белка лиганд занимает свою небольшую полость (объём 67 Å3), при этом в свободном состоянии эта область в структуре сообщается с самым большим карманом объёмом 1018 Å3 (в связанном состоянии его объём 471 Å3). Это значит, что с точки зрения пробы радиусом 2 Å данные области уже не сообщаются — в результате конформационных изменений лиганд оказывается «заперт». Я думаю, что это происходит во время связывания, потому что перестройка довольно значительная (ещё можно вспомнить сдвинувшиеся на разные расстояния остатки): некоторые участки начинают сдвигаться сразу, а те, для которых положения дальше всего, могут уже потом.
Для докинга понадобятся протонированные структуры белка и лиганда. У белка протонированную структуру получим при помощи сервиса PDB2PQR, для лиганда используем программу SPORES на kodomo.
Покажем, как выглядит структура лиганда до и после добавления водородов. (См. рис. 6).
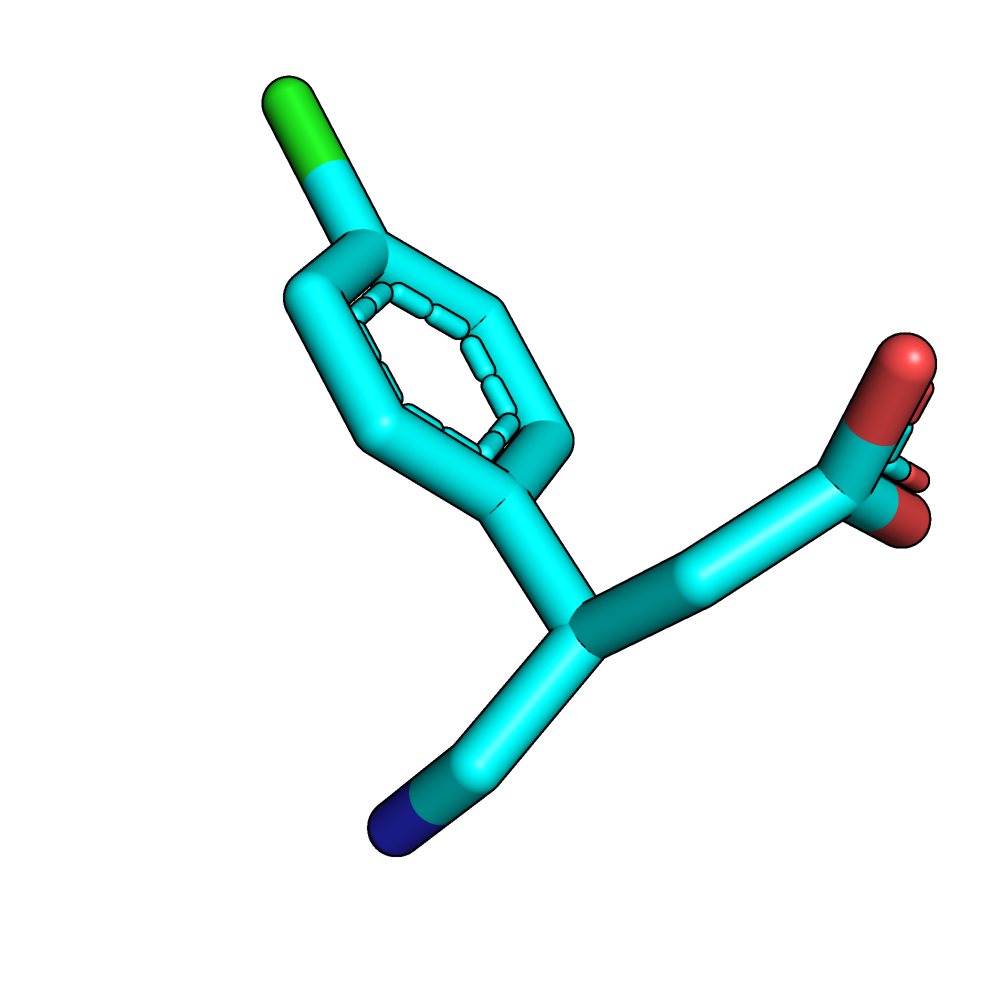
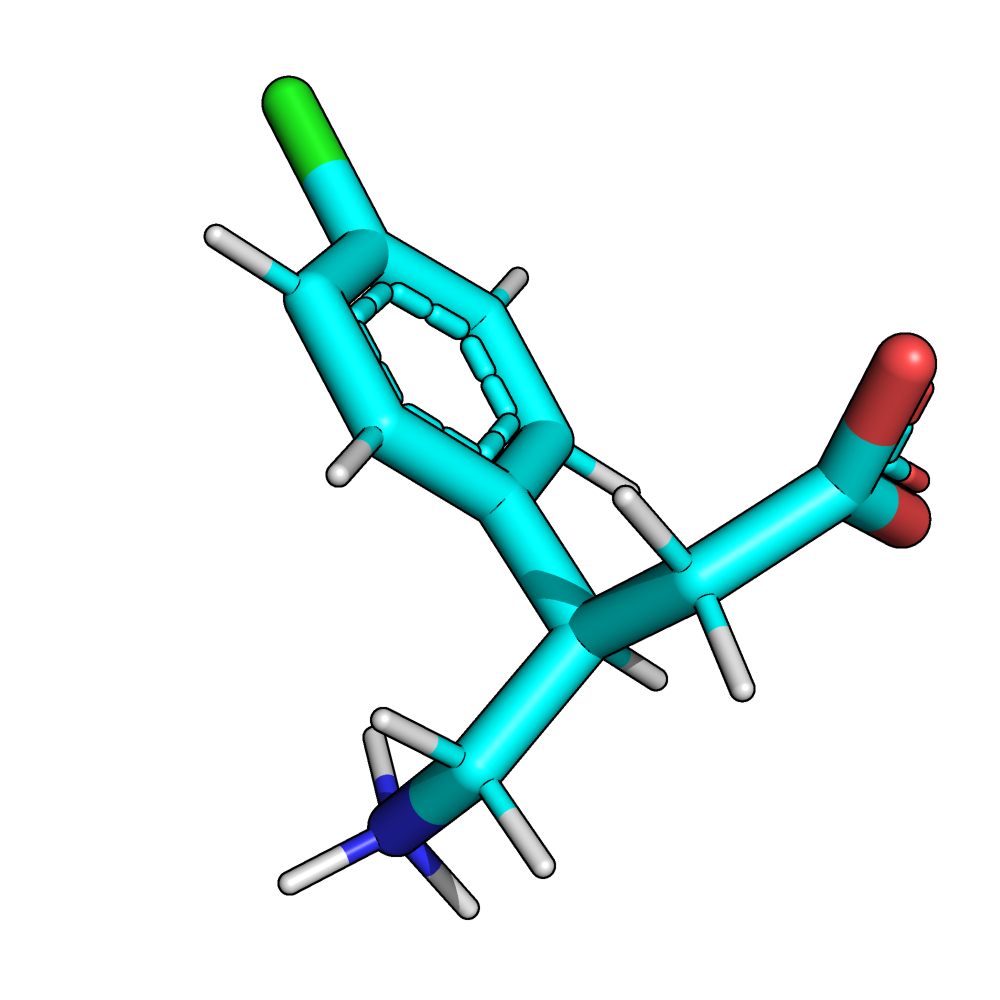
Здесь были бы возможны разные варианты протонирования аминогруппы и карбоксильной группы, если бы локальные условия сдвигали их pKA. Но данный вариант протонирования, как мы увидим ниже, при анализе взаимодействий, выглядит вполне правдоподобно.
Проведём моделирование начальных этапов связывания субстрата — докинг лиганда к свободной форме белка при помощи сервиса Webina. Загрузим результат и проверим, есть ли в выдаче конформации, похожие на наблюдаемую в связанной форме, файл с которой у нас есть. Ближайшая по ориентации и положению в структуре конформация оказалась первой в выдаче — покажем её вместе со связанной формой лиганда из известной структуры (рис. 7).
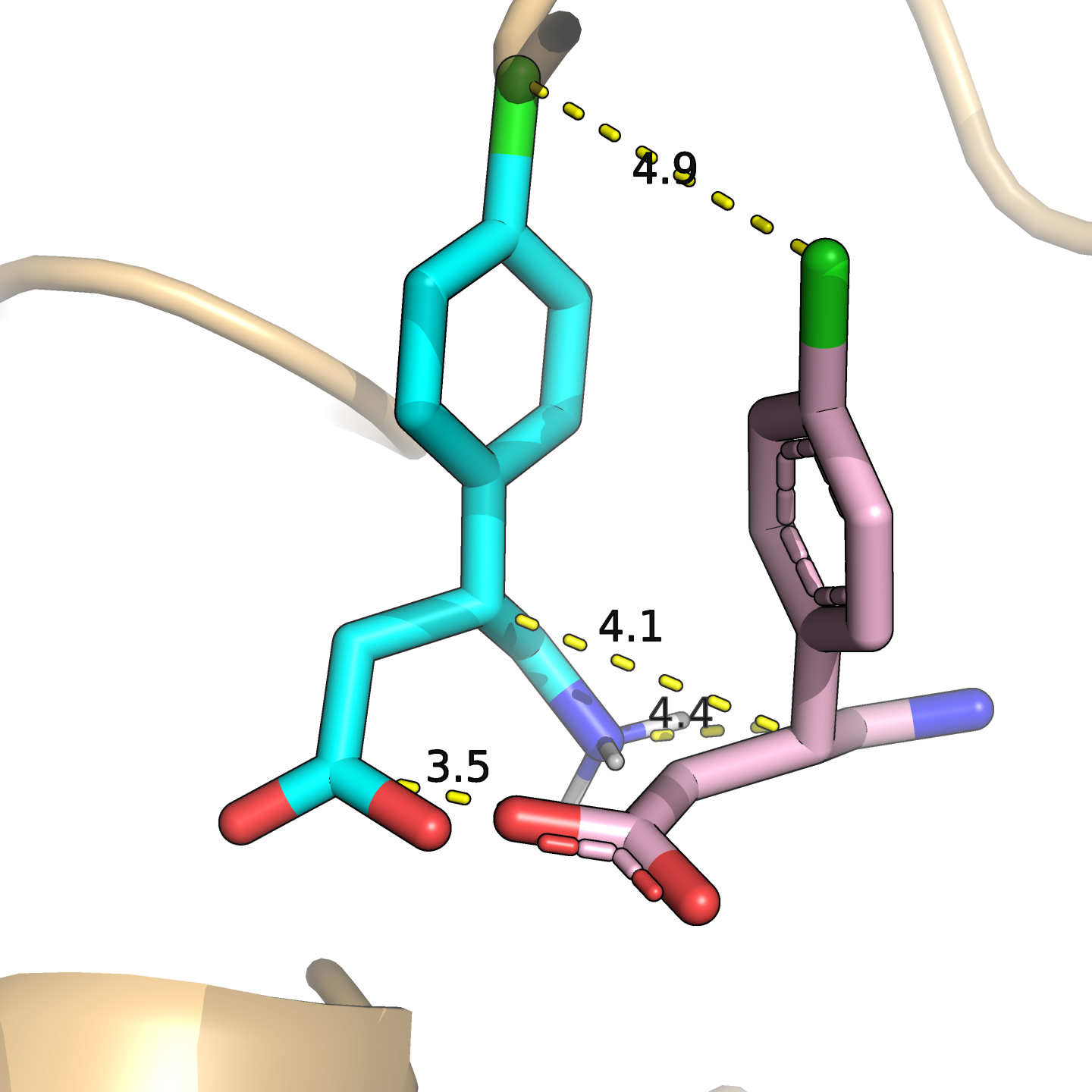
Видно, что различия довольно значительные. Это не только расстояние более 4 Å между центрами молекул, но и совершенно разные углы между связями. Видимо, это говорит нам об индуцированном соответствии. О том же говорит и то, что осмысленные взаимодействия получаются, если искать их в PoseView для выдачи докинга и именно свободной формы белка (а для связанной взаимодействий почти не будет —настолько отличаются положения лиганда). Разметка для взаимодействий с конформациями лиганда представлена на рис. 8.
Видны общие для двух случаев взаимодействия с S130 и S153, а также гидрофобный контакт с W278 (это тот самый остаток, который двигался на 8 Å! на картинке слева он участвует ещё и в пи-катионном стекинге). Получается, действительно, какие-то остатки могут сразу взаимодействовать с лигандом и быть первыми при узнавании и связывании, а другие (как W278) затем подстроятся и вместе с лигандом примут итоговую конформацию (индуцированное соответствие).
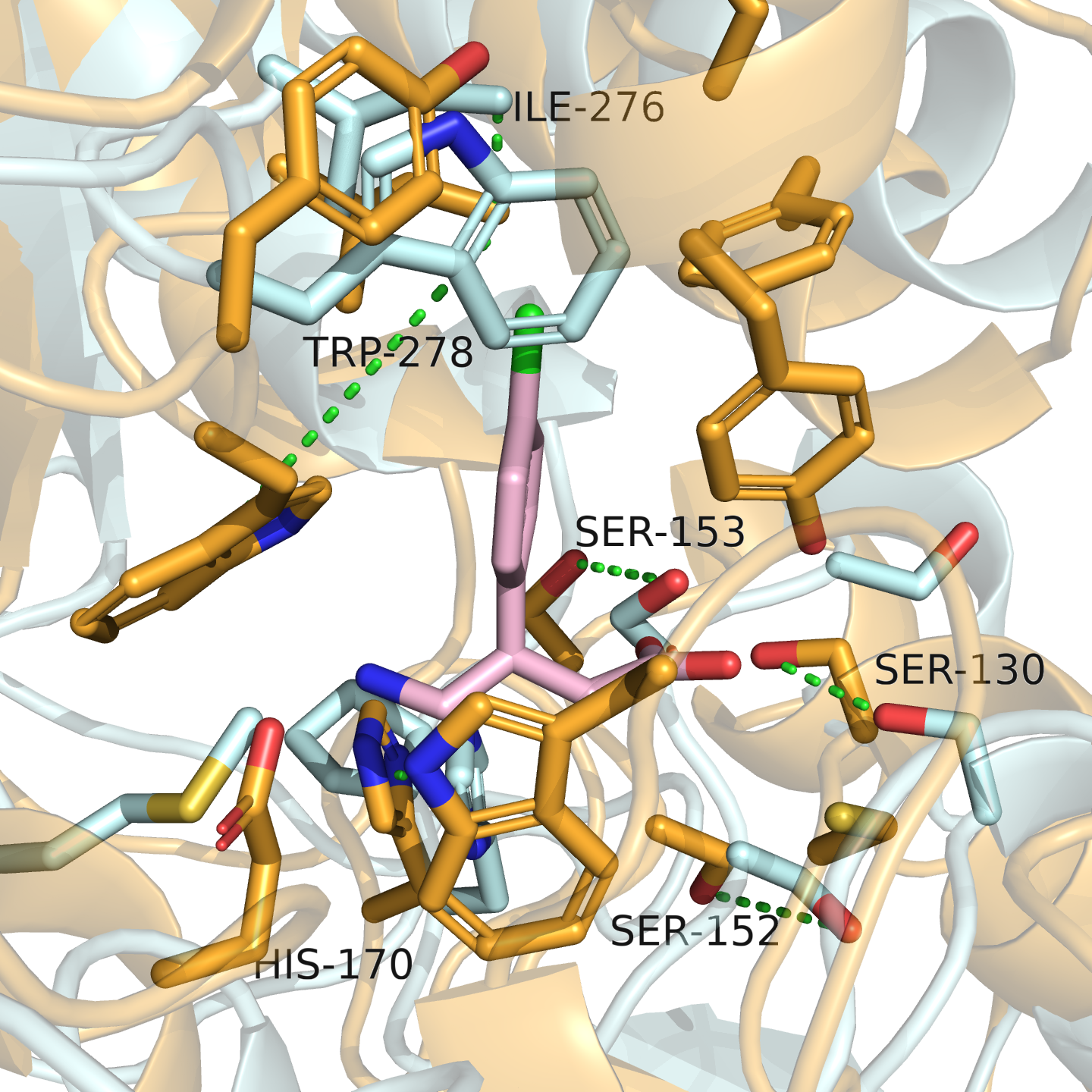
До того как запускать PoseView, я попробовал разметить взаимодействия для связанного состояния сам, и вот что у меня получилось (рис. 9).
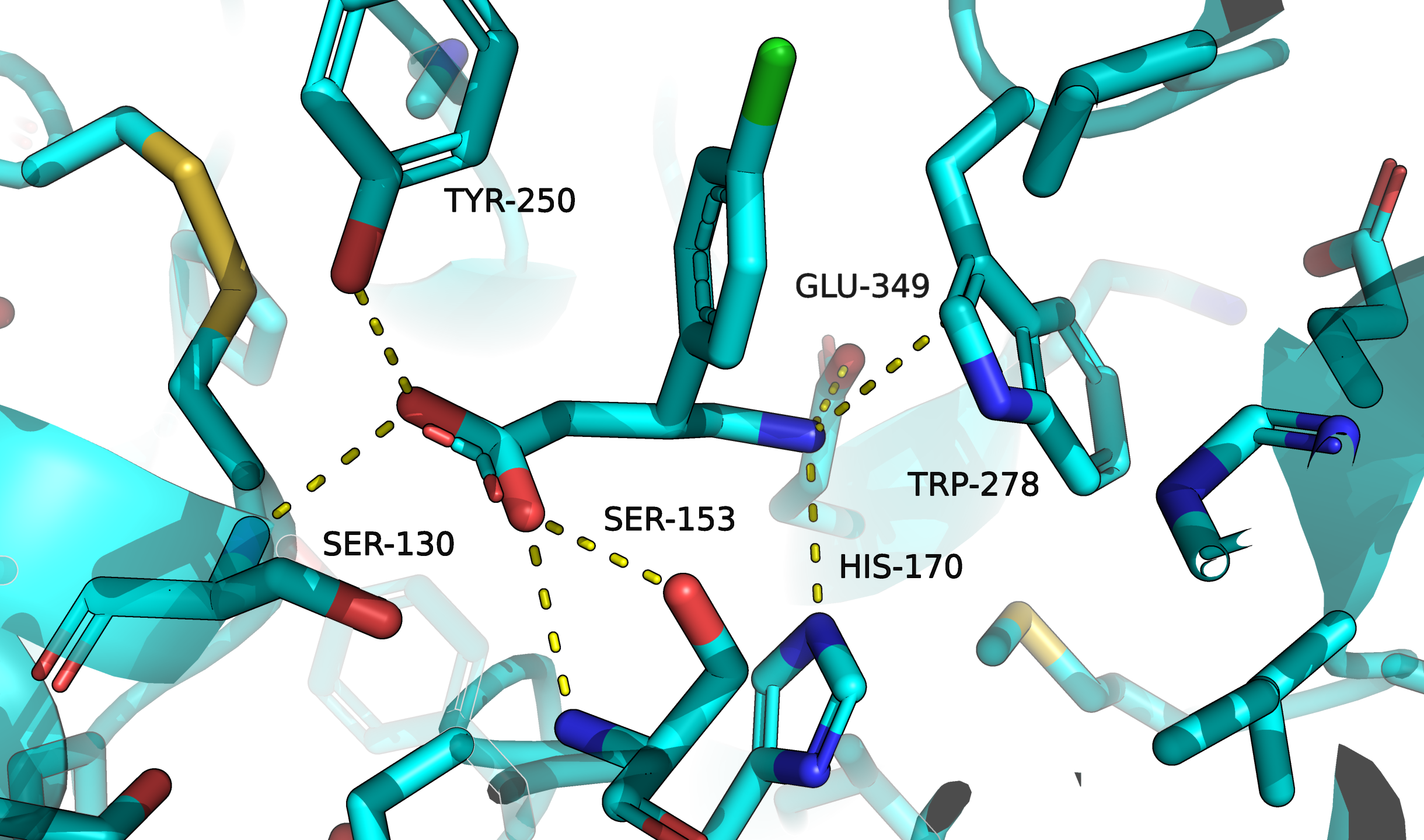
Здесь я бы сказал, что имеет место не только пи-катионный стекинг, но и пи-водородная связь с W278. Стекинг с Y250 мне неочевиден (угол между плоскостями колец не совсем прямой). Ещё я не отметил третью водородную связь у одного из карбоксильных кислородов, так как не думал о ней из-за того, что электрон показан делокализованным (но вообще она возможна, и тогда предпочтительный отрицательный заряд смещается на соответствующий атом кислорода). В любом случае наблюдённые взаимодействия подтверждают тот вариант протонирования, который поддержала программа SPORES.
В этом практикуме я посмотрел на карманы в структуре белка и провёл простой докинг. Я увидел, что какие-то аминокислотные остатки, скорее всего, склонны связываться с лигандом первыми, но при образовании конечного комплекса могут происходить дальнейшие перестройки в других областях.