В этом практикуме предлагается исследовать гипотетический эффект некоторых мутаций на структуру белка. Мне был выдан белок A0A3B4CPI2 из TrEMBL. Это предсказанная субъединица 1 ГАМК-B рецептора (GABBR1) из пираньи (Pygocentrus nattereri). Предложенные мутации: W468H, N633D, C293S.
Для того чтобы локализовать мутации, проведём BLAST с последовательностью из TrEMBL в качестве запроса по базе PDB. Результат с наибольшим процентом совпадений (81,7 %) — цепь А из структуры 6UO8. Это структура обеих субъединиц человеческого ГАМК-B рецептора без мутаций в комплексе с агонистом (аналогом ГАМК) и аллостерическим модулятором, полученная методом КриоЭМ. Более близких к пиранье организмов не находится. Если посмотреть оригинальную статью 6UO8, там исследуется как раз механизм активации рецептора человека. Аллостерический агент понадобился для стабилизации активированного состояния и повышения разрешения, иначе рецептор находился в равновесии между двумя конформациями и разрешался плохо. В результате удалось достигнуть разрешения 3,4 Å и разрешить боковые цепи большинства остатков.
Возьмём найденную структуру. Для локализации позиций воспользуемся нумерацией в выравнивании BLAST и в строке последовательности PyMol. Так, C293 соответствует C57 по BLAST и C220 в цепи A PDB. W468 станет W232$\rightarrow$W395. N633 в выравнивании соответствует уже, что интересно, D396 (в PDB $\rightarrow$ D559).
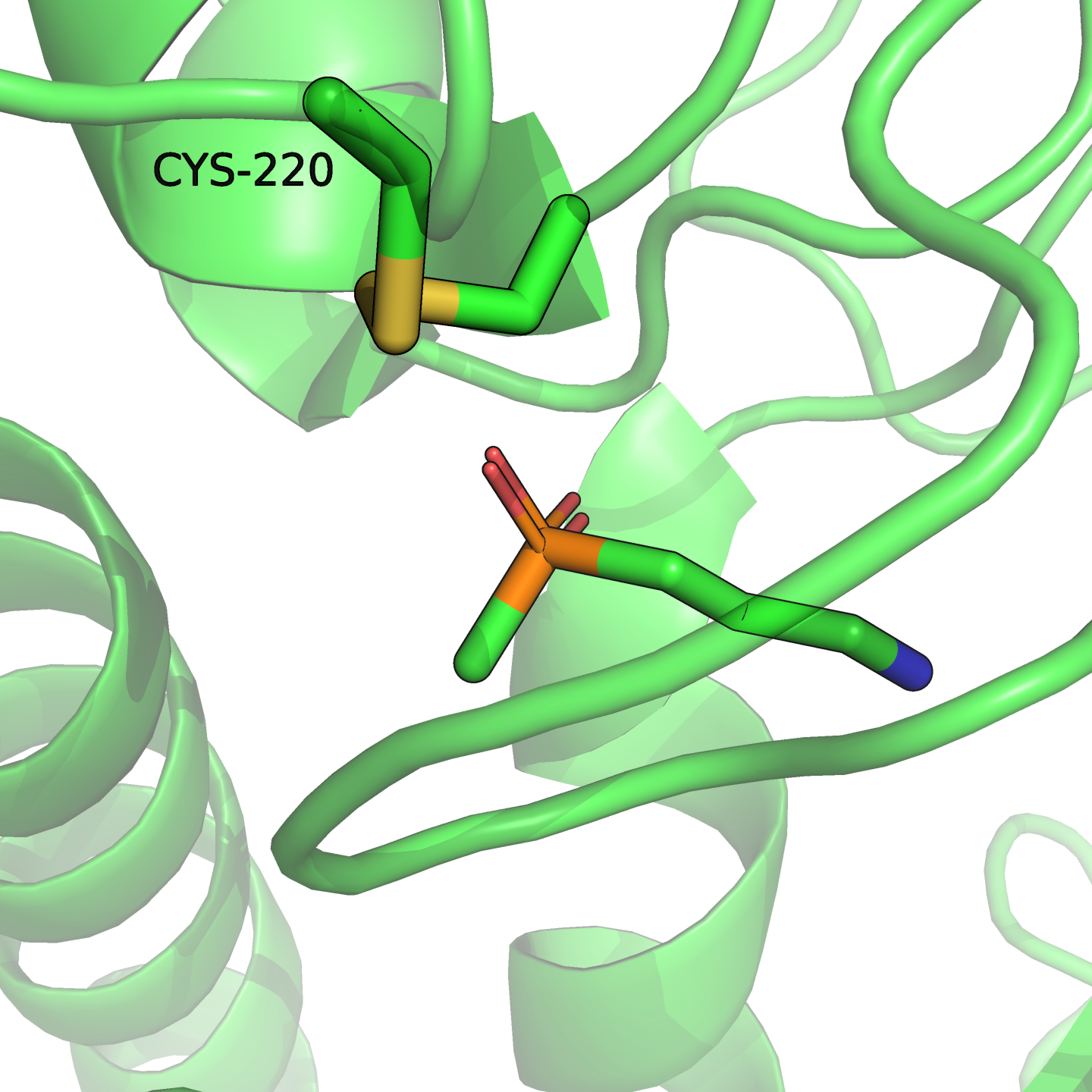
220-й цистеин в PDB участвует в образовании дисульфидного мостика. Этот мостик стабилизирует $\alpha/\beta$-структуру около кармана связывания (см. рис. 1).


Эта структура, вероятно, развалится или, по крайней мере, будет менее стабильна без мостика, а мостик исчезнет при замене цистеина на серин. Возможно, обмен лиганда будет происходить быстрее, если структура разойдётся, или воде будет проще вытеснить лиганд. В любом случае укладке и свойствам рецептора это навредит, связывание станет хуже.
Триптофан в позиции 395 вместе с ещё остатками триптофана и глутамата участвует в связывании аминогруппы лиганда, и гистидин в принципе тоже способен к стекингу (см. рис. 2).
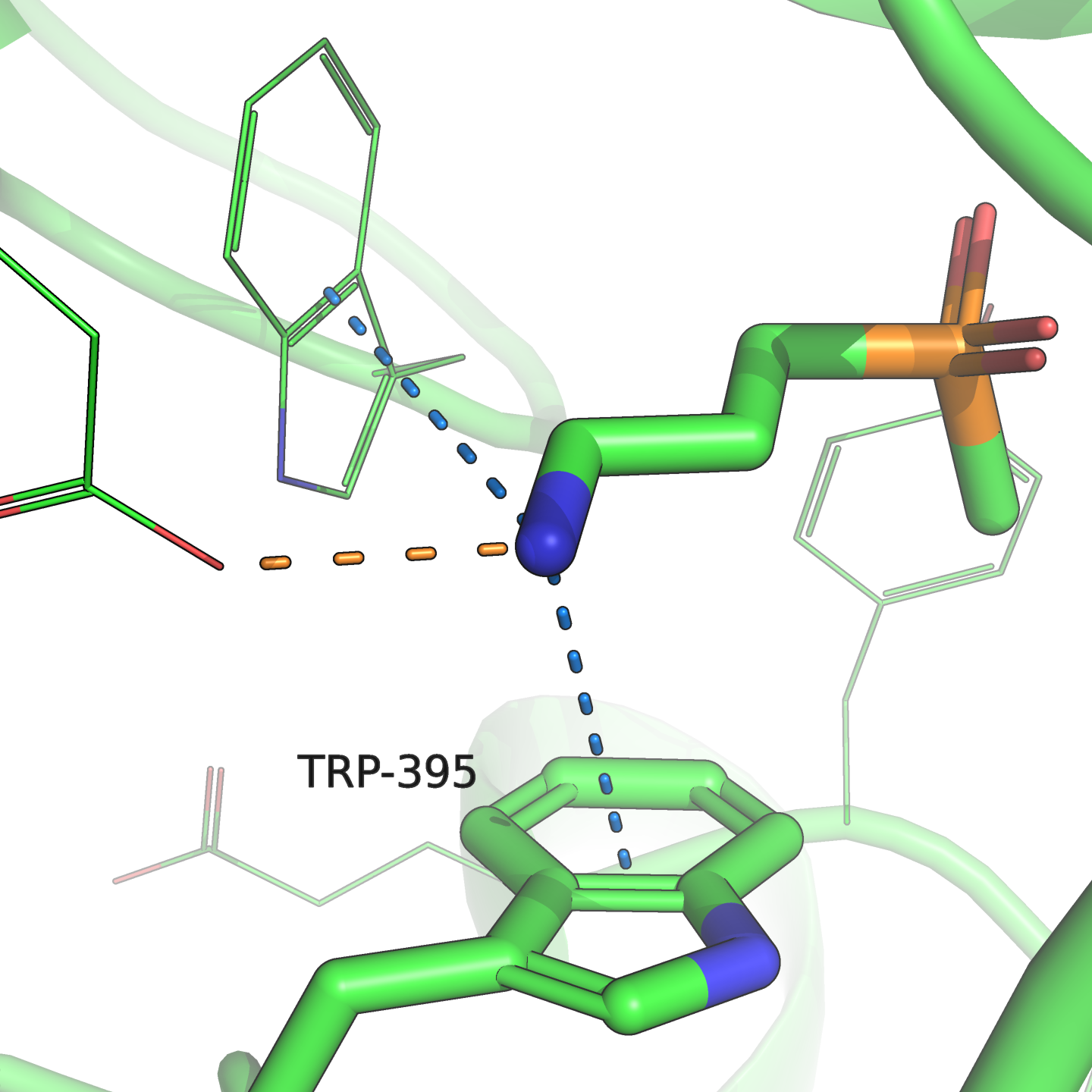
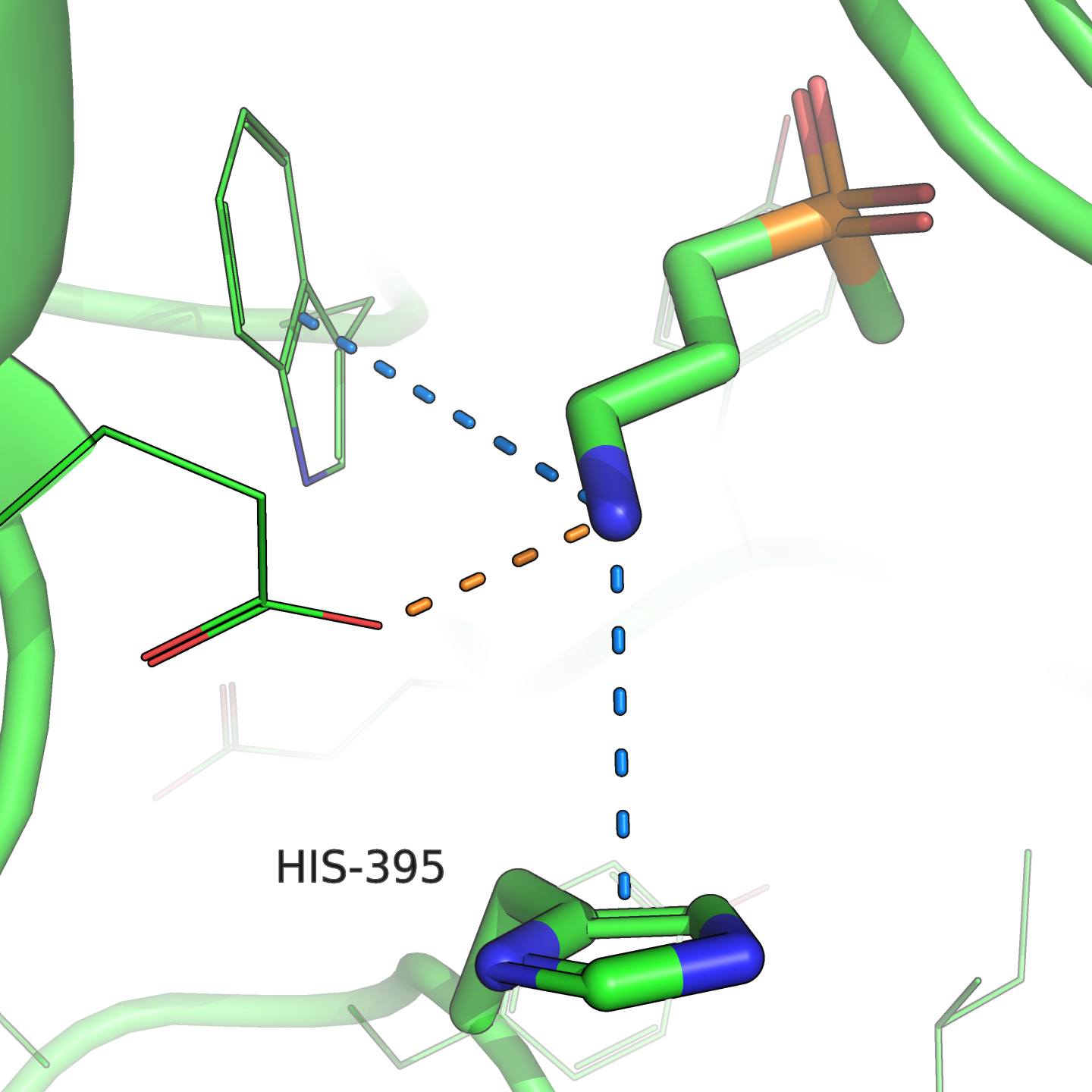
С этой заменой я вижу следующие проблемы: во-первых, гистидин может протонироваться и образовать солевой мостик с глутаматом, тогда положительно заряженный «хвост» лиганда будет связываться хуже. Также триптофан большим радикалом занимал какое-то место, которое теперь освободится и может привести к тому, что ферменту станет труднее ориентировать лиганд (он сможет занять лакуну), или к перестройке локального окружения.
Мой вывод — эта замена тоже ухудшит связывание.
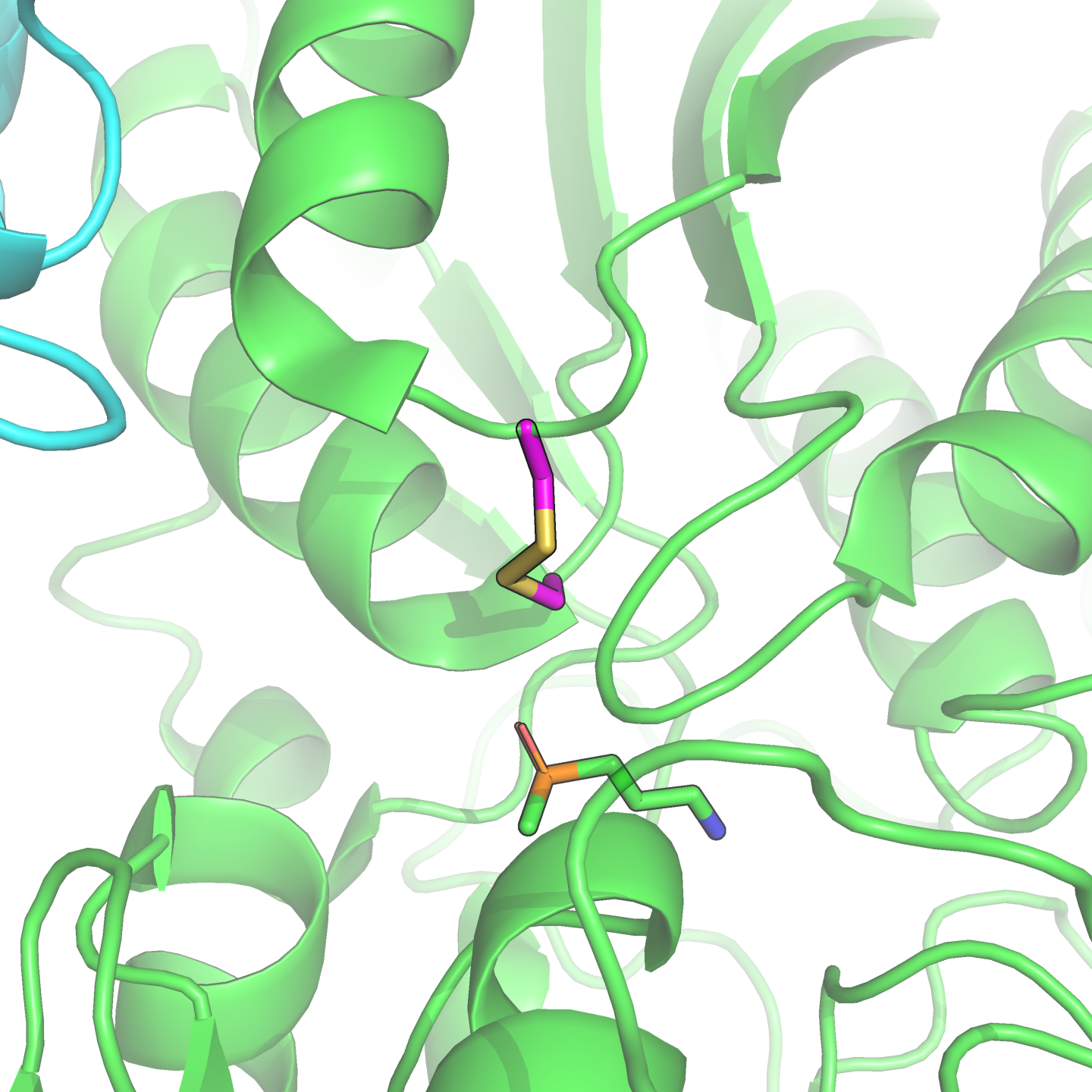
Аспартат-559 экспонирован в растворитель (см. рис. 3).
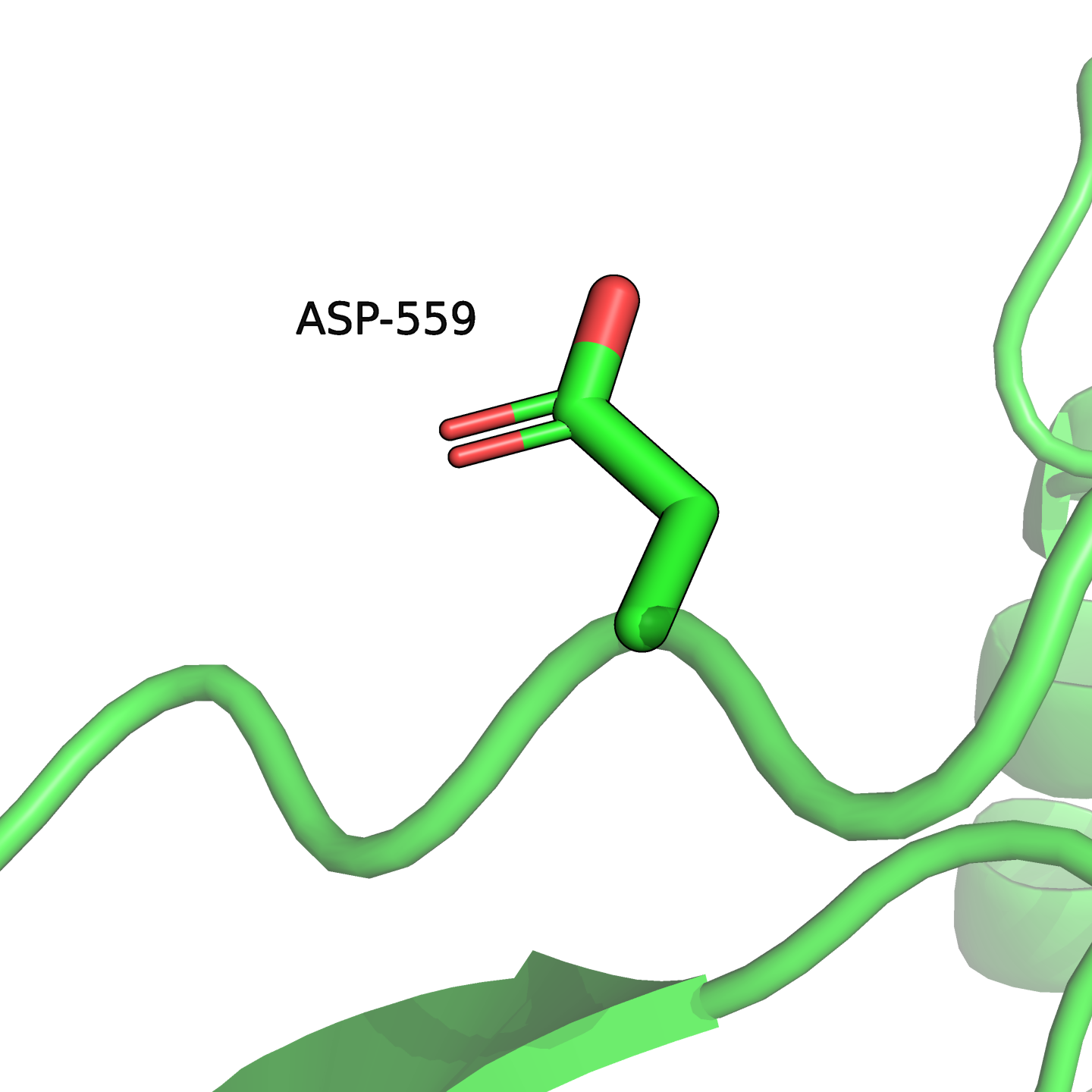
И аспарагин, и аспартат имеют гидрофильные боковые радикалы, поэтому обе аминокислоты должны быть хороши в данной позиции. Таким образом, замена не ухудшит свойства белка. Вероятно, поэтому она и произошла в действительности и наблюдается в человеческом белке. Более того, соседний, 558-й остаток у человека тоже аспартат, а выровнен он с глицином — рассматриваемый участок не высококонсервативен.
Итак, рассмотрено три мутации. Первая, скорее всего, нарушит укладку белка, вторая ухудшит связывание лиганда. Что касается третьей замены, она мало на что повлияет.