База данных KEGG. Исследование метаболического пути деградации изолейцина до ацетилкофермента А.





- Графические формулы и идентификаторы изолейцина и ацетилкоэнзима A в KEGG.
- Поиск метаболического пути.
- Исследование выбранного метаболического пути.
Будем считать, что мы работаем с метаболизмом белков, поэтому нас интересуют L-аминокислоты, в частности, L-изолейцин. Наша задача – определить, существует ли метаболический путь деградации L-изолейцина до ацетилкофермента A (ацетил-КоА). Найдем графические формулы и идентификаторы двух названных низкомолекулярных соединений в БД KEGG, для чего обратимся к суб-БД химических соединений и реакций (ссылка "LIGAND" на главной странице KEGG) и проведем поиск поочередно по названию каждого вещества. В списке, выдаваемом как результат поиска, рассматривались записи KEGG с идентификатором "cpd" – compound (компонент). Для изолейцина была выбрана запись с идентификатором "C00407", соответствующая его L-форме. Графическая формула выглядит так:
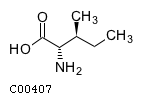
Для ацетилкоэнзима А поиск велся по распространенной аббревиатуре CoA; была выбрана запись c идентификатором "C00024"
KEGG позволяет не только рассматривать метаболические карты, но и окрашивать их элементы в нужные цвета. Для этого существует программа, ссылка на которую дается в таблице-оглавлении ("Table of contents") базы данных. Для задания этой программе объектов карты и цветов, в которые их нужно окрасить, необходимые данные вводятся в специальное поле. Мы использовали такую последовательность "команд", первые две из которых относятся к исследуемым веществам, а остальные – к ферментам*, катализирующим реакции метаболического пути деградации изолейцина до ацетил-КоA:
cpd:C00407 red cpd:C00024 red 2.6.1.42 yellow 1.2.1.25 yellow 1.3.99.2 yellow 1.3.99.12 yellow 4.2.1.17 yellow 1.1.1.35 yellow 1.1.1.178 yellow 2.3.1.16 yellowВ результате получили список метаболических карт, в которых участвуют указанные вещества и ферменты*. Из них выбрали первую – под названием "Деградация валина, лейцина и изолейцина". Ниже приведен фрагмент этой карты, на котором схематично изображена цепочка ферментативных реакций, приводящих к деградации L-изолейцина до ацетилкоэнзима A (названные вещества отмечены красным). Изображение не совсем соответствует фрагменту карты KEGG (многие не относящиеся к нашей реакции элементы убраны, некоторые стрелки для удобства укорочены).
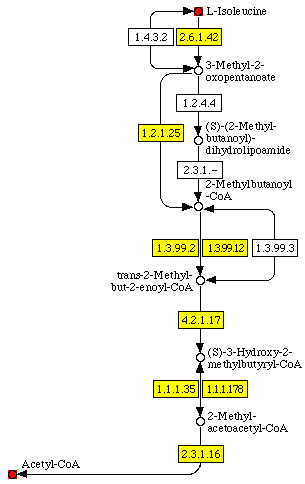
Желтым на карте покрашены ферменты*, катализирующие те или иные реакции, относящиеся к нашему метаболическому пути. Как видим, большинство из них являются оксидоредуктазами, отметим также, что некоторые реакции могут быть катализированы сразу двумя ферментами. Первая реакция (превращение L-изолейцина в 3-метил-2-оксопентаноат) может идти двумя путями – обратимым и необратимым – каждый из которых катализируется своим ферментом. Интересно, что эти ферменты относятся к разным классам (обратимую реакцию катализирует оксидоредуктаза, а необратимую – трансфераза). Для нашего метаболического пути в качестве первого этапа мы выбрали необратимую реакцию.
* Под "ферментом" здесь подразумевается не конкретный белок, а скорее функциональная активность!
Как выяснилось, метаболический путь деградации L-изолейцина до ацетил-КоA существует, и он описан в KEGG. Наикратчайший такой путь включает шесть стадий, которые катализируются в общем счете восемью ферментами. Ниже приведена таблица, в которой описаны первые три стадии деградации изолейцина. Данные получены с использованием записей KEGG о химических реакциях; к нужным записям переходили с метаболической карты в режиме "Reference pathway (Reaction)", щелкая по прямоугольникам с указанием кода фермента, катализирующего интересующую нас реакцию.
Таблица1: Первые три стадии возможного пути превращения L-изолейцина в ацетилкоэнзим A.
| Этап | Ферментативная реакция | Фермент |
|---|---|---|
| 1 | L-Isoleucine + 2-Oxoglutarate <=> 3-Methyl-2-oxopentanoate + L-Glutamate | EC 2.6.1.42 |
| 2 | 3-Methyl-2-oxopentanoate + CoA + NAD+ <=> 2-Methylbutanoyl-CoA + CO2 + NADH | EC 1.2.1.25 |
| 3 | 2-Methylbutanoyl-CoA + Oxygen <=> 2-Methylbut-2-enoyl-CoA + 2 H2O 2-Methylbutanoyl-CoA + FAD <=> 2-Methylbut-2-enoyl-CoA + FADH2 |
EC 1.3.99.2 EC 1.3.99.12, EC 1.3.99.3 |
Заметим, что один из продуктов предыдущего этапа всегда участвует в следующем, то есть реакции образуют цепочку. Особо интересным показался третий этап деградации изолейцина. На карте указано, что реакцию превращения 2-метилбутаноил-КоA в 2-метилбут-2-еноил-КоA могут катализировать два фермента. После перехода к записи KEGG, соответствующей этой реакции, замечаем, что реакции, катализируемые этими ферментами, на самом деле не идентичны. В одном из случае указанное превращение требует наличия кислорода (как акцептора электронов в окислительно-восстановительной реакции), в другом реакция протекает и в анаэробных условиях, но необходим кофермент FAD. Еще более интересно, что вторая реакция (FAD-зависимая) может, в свою очередь, катализироваться не только тем ферментом, что указан на карте (EC 1.3.99.12), но и еще одним (EC 1.3.99.3), который на метаболической карте не указан. Мы проверили, что под этими кодами имеются в виду разные ферменты (в IUBMB Enzyme Nomenclature для 1.3.99.12 указано "Not identical with EC 1.3.99.3"). Значит, третий этап деградации изолейцина может катализироваться не двумя, а тремя ферментами, при этом один из них не упоминается на метаболической карте, описывающей соответствующий путь.
Таблица 2: Деградация L-изолейцина до ацетил-КоA у различных организмов.
Организм |
Возможно ли превращение изолейцина в ацетил-КоA по данным KEGG? |
Краткое обоснование |
|---|---|---|
| Homo sapiens | Нет | Неизвестен ген фермента, катализирующего вторую стадию (ЕС 1.2.1.25) Однако более длинная (на один этап на уровне второй стадии, см. изображение метаболического пути выше) цепочка вполне осуществима, то есть в принципе деградация изолейцина до A-CoA в человеческом организме возможна |
| Escherichia coli K-12 MG1655 | Нет | Неизвестны гены ферментов, катализирующих вторую (ЕС 1.2.1.25) и третью
(EC 1.3.99.2, EC 1.3.99.12) стадии. Даже более длинный путь превращения (см. выше) невозможен (неизвестен ген фермента 1.2.4.4) |
| Pseudomonas aeruginosa PAO1 | Нет | Неизвестен ген фермента, катализирующего вторую стадию (ЕС 1.2.1.25) Даже более длинный путь превращения (см. выше) невозможен (неизвестен ген фермента 2.3.1.-) |
| Methanococcus maripaludis* | Нет | Неизвестны гены ферментов, катализирующих все реакции пути, кроме первой и последней |
*В задании было указано исследовать метаболическую карту для Methanococcus janaschii, но такой вид в KEGG не описан, из рода Methanococcus есть только вид M.maripaludis (см. здесь).
Как видно из таблицы, у человека, кишечной палочки, псевдомонады и метанококка деградация изолейцина до ацетил-КоA по изучаемому (наиболее короткому) пути по данным KEGG невозможна. Это означает, что указанные желтым на схеме ферментативные активности у этих организмов "не привязаны" к определенным белкам. То есть, либо вообще не существует ферментов, катализирующих ту или иную реакцию (то есть организм не способен превращать изолейцин в ацетил-коA по прямому пути), либо такие белки есть, но они еще не аннотированы должным образом. Только у самого изученного организма из четырех названных – человека – может осуществляться более длинный путь (с одной дополнительной стадией, точней, с заменой одной стадии двумя) деградации, у остальных деградация изолейцина до ацетил-KoA не представляется возможной на данном уровне исследования метаболических путей и ферментов.
Во всех четырех случаях неизвестен фермент, катализирующий вторую стадию деградации (ЕС 1.2.1.25). Рассмотрев запись KEGG о этом ферменте, узнали, что нет ссылок на другие БД (ни на Brenda, ни на какую-либо еще базау данных) а также вообще нет информации о генах, кодирующих белок с такой ферментативной активностью ни для одного организма. Поэтому можно ожидать, что какой бы мы организм из описанных в KEGG ни выбрали, деградация изолейцина до ацетил-KoA по изучаемому пути у него будет невозможна.
©Ганчарова Ольга