Внутренности белка с идентификатором YP_184698.1 (PDB ID:3W4S) и макромолекулярного комплекса PDB ID:4ZQ9
В окне справа вы видите модель молекулы белка
с идентификатором YP_184698.1[1].
Для того, чтобы увидеть разные изображения молекулы, запустите
скрипт 1 раз, а затем используйте кнопку "Resume".
Ниже вы можете прочитать некоторые пояснения к скриптам (указаны в скобках).
| Текст скрипта | |
| Текст скрипта | |
| Текст скрипта | |
| Текст скрипта | |
Гидрофобные ядра ("Cores")
В данном белке две субъединицы, будет рассмотрена
цепь А (цепь В показана в виде wireframe). В цепи А
всего 6 гидрофобных ядер[2]
(характеристики ядер можно посмотреть
здесь). Мы будем рассматривать
только два самых крупных ядра, так как остальные
относительно невелики. Таким образом, белок является
многодоменным.
Гибкая молекула белка в воде сворачивается в глобулу
(поскольку полярные аминокислотные остатки стремятся к
максимальному контакту с водным окружением, а неполярные
— к минимальному контакту). Минимальной поверхностью
при заданном объеме обладает шар. Стремление неполярных
остатков образовать внутри белковой части некое подобие
шарообразной капли, а полярных — сосредоточиться на ее
поверхности, и приводит к образованию компактного тела
— глобулы с гидрофобным ядром и гидрофильной
поверхностью[3].
На втором изображении видно, что гидрофобные ядра не
полностью покрываются гидрофильными аминокислотными
остатками. Образуется немного мозаичная поверхность:
на ней видны небольшие гидрофобные области. Это часто
свойственно белкам, образующим четвертичную структуру[4],
так как гидрофобные связи участвуют в соединении
двух субъединиц. Также такое строение может быть
связано с функцией карбогидрат-киназы (к примеру,
обеспечивает связь с другими гидрофобными молекулами).
В таблице 1 приведены различные характеристики
гидрофобных ядер (названия даны в соответствии с
характеристикой, приведенной выше). Согласно этим
данным два исследуемых гидрофобных ядра содержат
25,49% от общего числа атомов субъединицы (ср. 26,31% для всех 6 ядер,
т.е. на остальные 4 "маленьких" ядра приходится всего 0,82%).
Несмотря на такой маленький процент, полярные
аминокислотные остатки все равно не могут полностью
покрыть ядра.
| Ядро | Количество атомов | Процент от общего числа атомов |
| core1 | 341 | 13,89% |
| core2 | 285 | 11,6% |
| Всего атомов в двух ядрах: | 626 | 25,49% |
| Всего атомов во всех шести ядрах: | 646 | 26,31% |
| Общее количество атомов в цепи А: | 2455 | |
Плотность упаковки атомов в гидрофобном ядре ("Surroundings")
На визуализации видно, что атомы, находящиеся на расстоянии
не более 4 Å, уже довольно сильно скрывают за собой остаток.
С увеличением минимального расстояния остаток виден все
слабее. Тем не менее, полностью его не покрывают даже атомы,
находящиеся на расстоянии не более 7 Å.
Так как на расстоянии 4 Å количество атомов резко
увеличивается, можно предположить, что это и есть
характерное расстояние между соседними не связанными
ковалентно атомами в белке.
Может ли между соседними атомами поместиться молекула воды?
Среднее расстояние = 4 Å. Ван-дер-ваальсов радиус
кислорода 0,14 нм = 1,4 Å[5].
Тогда диаметр атома = 2,8 Å. Получается, что в запасе
остается 1,2 Å. Но так как контактирующие атомы обладают
уже заполненными за счет других связей (с азотом,
кислородом или водородом) электронными оболочками, то
за вычетом их ван-дер-ваальсовых радиусов для воды места
не останется.
Комплексы ДНК и белка ("DNA + protein")
ДНК представляет собой полимер, находящийся в ядрах клеток.
ДНК взаимодействует с многочисленными белками, которые
выполняют свои функции в сочетании с ДНК. Белки,
вступающие в контакт с ДНК, могут быть как модифицирующими
ДНК ферментами, так и связывающими белками.
К ферментам относятся метилазы, полимеразы, нуклеазы, липазы,
киназы и фосфатазы. ДНК метилируется, чтобы уменьшить
вероятность нарушения структуры и действие соответствующих
рестриктаз. Полимеразы добавляют нуклеотиды к 3'-концу
и учавствуют в синтезе ДНК. Нуклеазы гидролизуют
фосфодиэфирную связь между субъединицами нуклеиновых кислот.
Лигазы катализируют образование фосфодиэфирной связи между
5'- и 3'-концами. Полинуклеотид-киназы катализируют
перенос фосфатной группы от молекулы АТФ на 5'- и 3'-концы.
Связывающие белки контактируют со специфическими областями ДНК,
регулируя экспрессию. Некоторые из них запускают активаторы
транскрипции, которые связываются со специфическими
последовательностями промотора и формируют
модифицирующие хроматин комплексы, которые инициируют
синтез РНК[6].
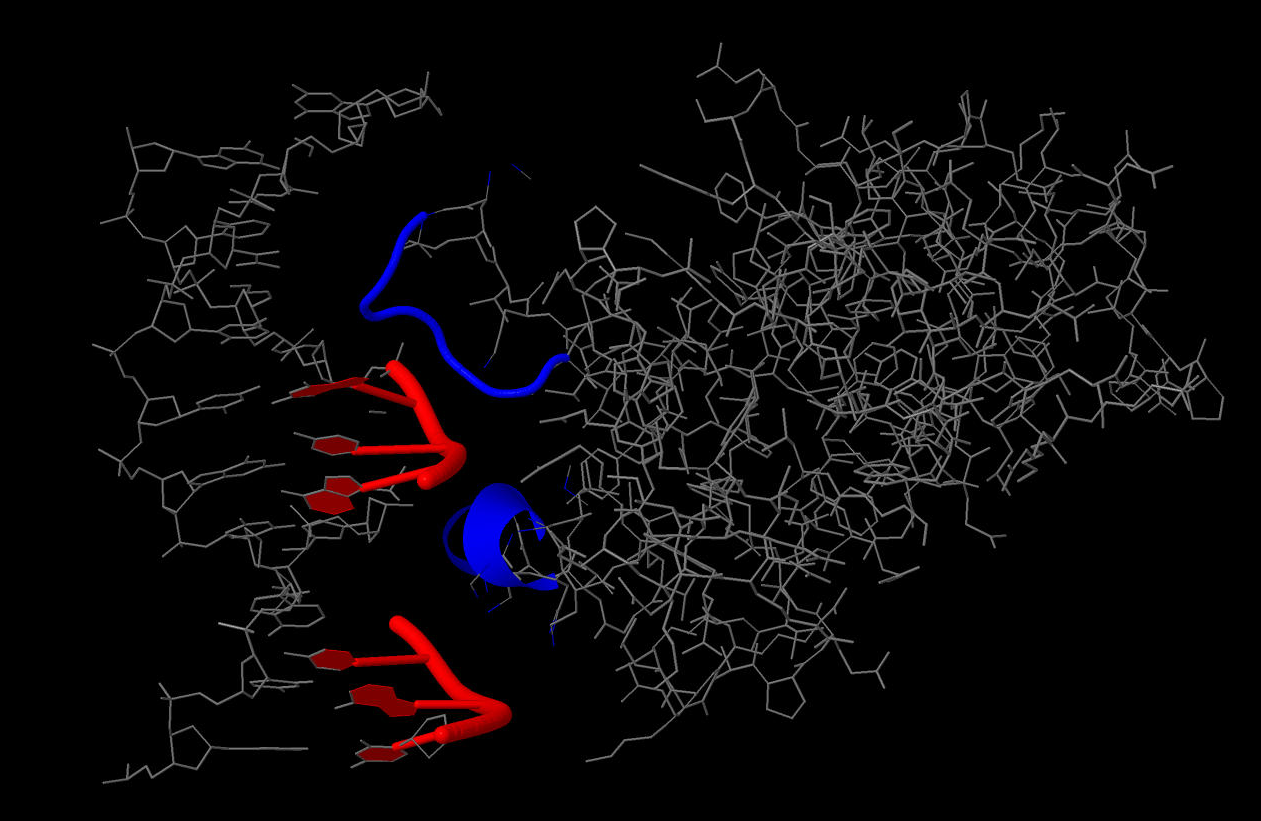
Части ДНК, контактирующие с белком ("DNA parts")
 |
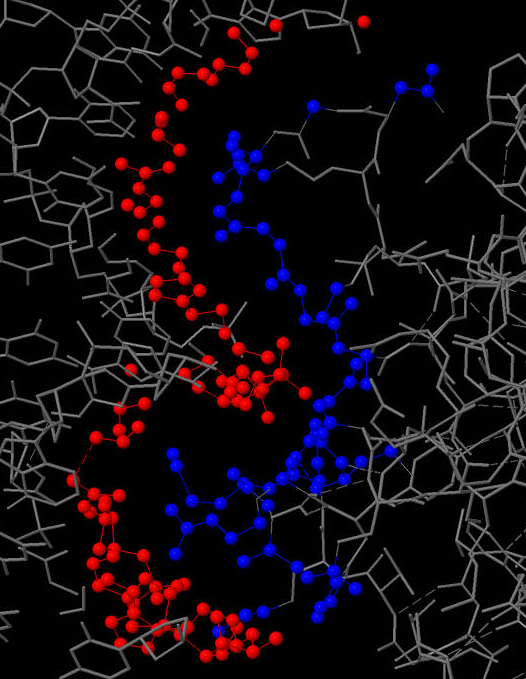 |
На рис.1 красным показаны участки ДНК, контактирующие с белком,
синим — участки белка, контактирующие с ДНК.
Критерий контакта — расстояние менее 5 Å.
Видно, что белок контактирует с малой бороздкой ДНК и сахаро-фосфатным
остовом. Это кажется мне необычным, так как белки, которые
присоединяются к определённым последовательностям в
двухцепочечной ДНК, обычно взаимодействуют с краями
оснований в большой бороздке, где те более доступны[7].
Мне не удалось найти водородные связи
между белком и ДНК в JMol. На рис.2 видно, что
никаких связей не найдено, несмотря на близкое расстояние.
То же самое видно и на визуализации (изображения 3 и 4).
5.(*)[8]
На видео представлена реакция фосфорилирования
тирозина некоего белка (скорее всего, фермента)
диэтил-n-нитрофенилфосфатом (он же параоксон этил)[9]
с выделением пара-нитрофенола, который сам токсичен.
Как мне кажется, это схема реакции неконкурентного
ингибирования. Оно вызывается веществами, не имеющими
структурного сходства с субстратами и часто связывающимися
не с активным центром, а в другом месте молекулы фермента.
Степень торможения во многих случаях определяется
продолжительностью действия ингибитора на фермент.
При данном типе ингибирования благодаря образованию
стабильной ковалентной связи фермент часто подвергается
полной инактивации, и тогда торможение становится
необратимым. В результате фермент может терять
возможность выполнять свою функцию. Это происходит из-за
связывания и выключения функциональных групп в молекуле
белка фермента[10]
(в данном случае при связывании с тирозином).
Примечания и источники:
[1] Белок археи Thermococcus kodakarensis. Информацию об
архее и белке можно прочитать
здесь.
[2] Данные получены при помощи
сервиса CluD.
[3] См. раздел "Гидрофобные взаимодействия и структуры белков" //
bio-phys.narod.ru.
[4] См. раздел "Четвертичная структура белков" //
biochemistry.ru.
[5] Радиус Ван-дер-Ваальса //
Wikipedia.
[6] DNA Interactions with Proteins, Dr Ananya Mandal, MD //
News Medical.
[7] Дезоксирибонуклеиновая кислота //
Wikipedia.
[8] Писала об этом задании Залевскому Артуру на почту, дублирую сюда с дополнениями.
[9] Диэтил-п-нитрофенилфосфат //
ФизЛабПрибор.
[10] Активирование и ингибирование ферментов //
химик.ру.