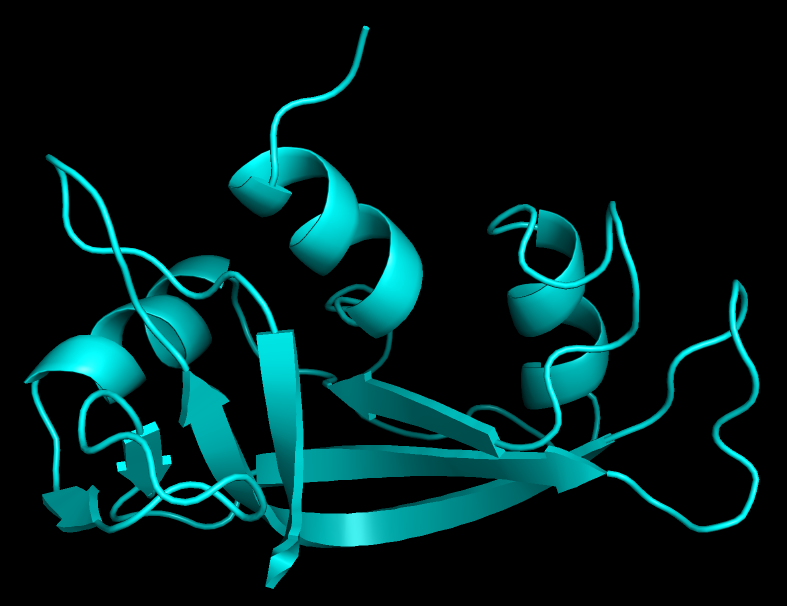
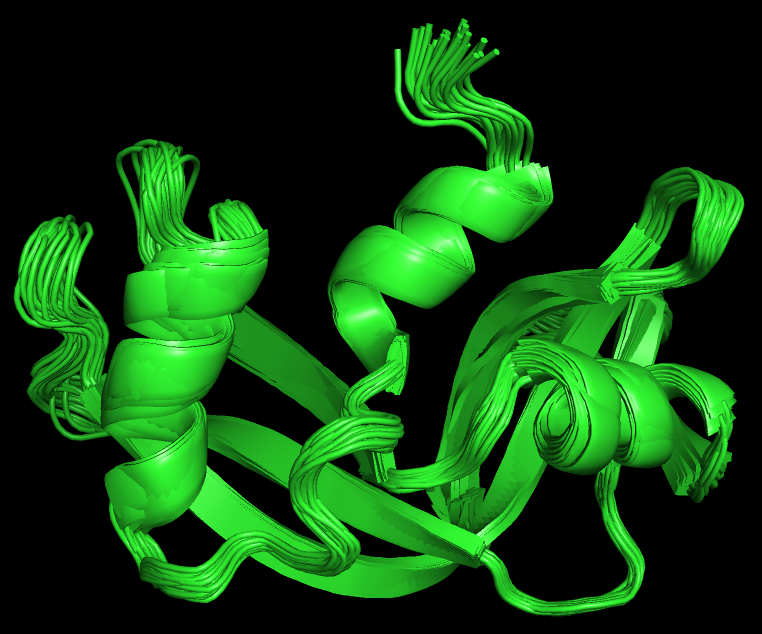
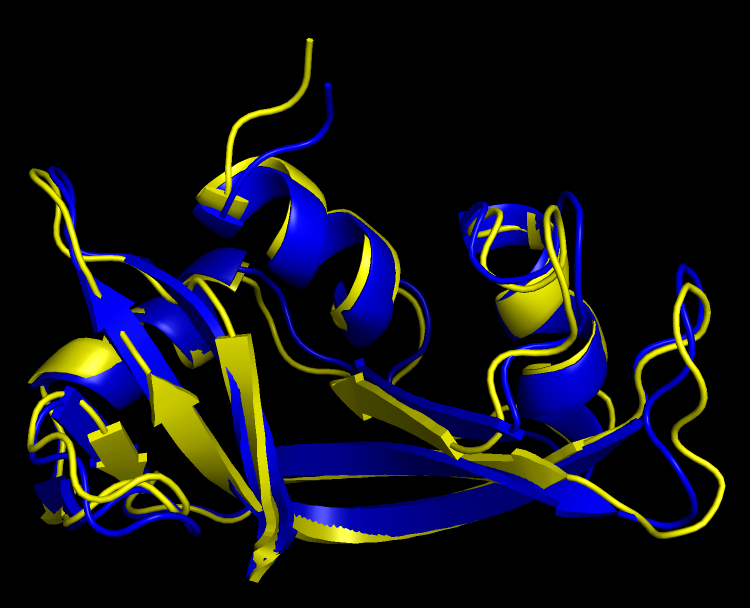
Для выполнения задания я выбрал бычью рибонуклеазу А: её РСА структура 1AFU обладает разрешением 2 ангстрема, а ЯМР структура 2AAS имеет 32 модели. Использовав PyMol для совмещения моделей, я увидел, что основные элементы вторичной структуры очень хорошо совмещены друг с другом, а основные разногласия моделей в петлях(рис. 1).
РСА
 |
ЯМР
 |
Таблица 1. Визуальное сравнение моделей.
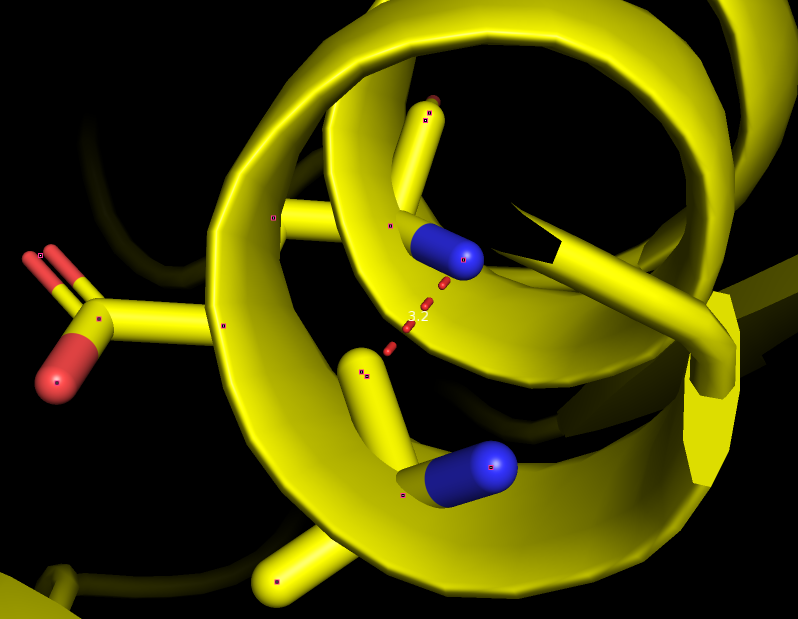
Выбранные водородные связи и их параметры представлены в таблице 2. Связи как в остове вторичных структур, так и внутри белка сохраняются в ЯМР модели, а остатки, вовлеченные в связь на поверхности, могут образовывать связи с другими экспонированными остатками(пример - модель 8 ЯМР).
| Номера и типы остатков [РСА], [ЯМР] | Атомы, между которыми водородная связь | Где располагаются остатки | Расстояние в РСА, Å | Расстояние в ЯМР [мин., мед., макс.], Å + процент структур со связью |
| Ala 5, His 9 | O и N основной цепи | Альфа-спираль | 3.2 | [2.0, 2.0, 2.0] 100% |
РСА
 ЯМР 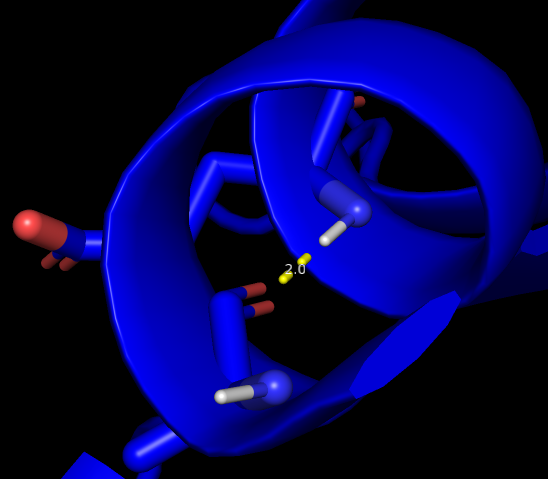 | ||||
| His 48, Thr 82 | N и O боковых цепей | Петля и бета-лист | 2.6 | [1.7, 1.9, 2.2] 100% |
РСА
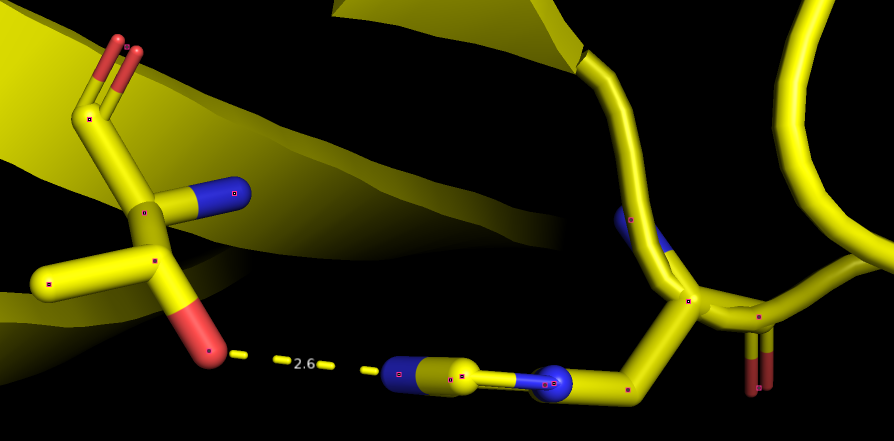 ЯМР 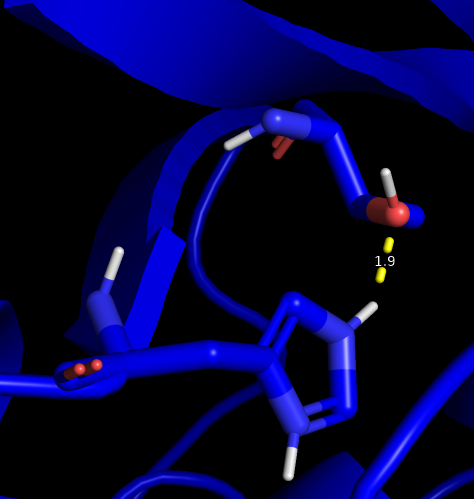 | ||||
| Ser 80, Gln 101 | O серина и глутамина в боковых цепях | Два бета-листа | 2.7 | [1.9, 2.5, 4.6] 75% |
РСА
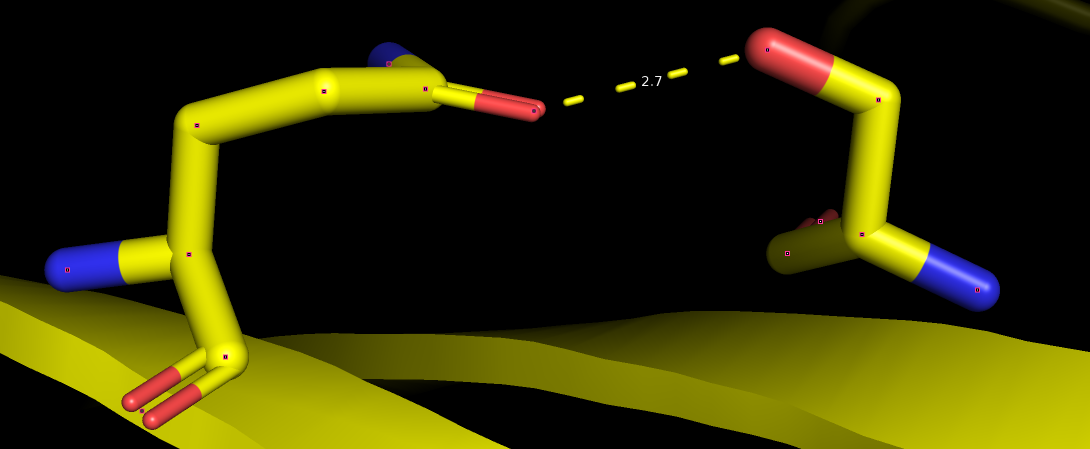 ЯМР 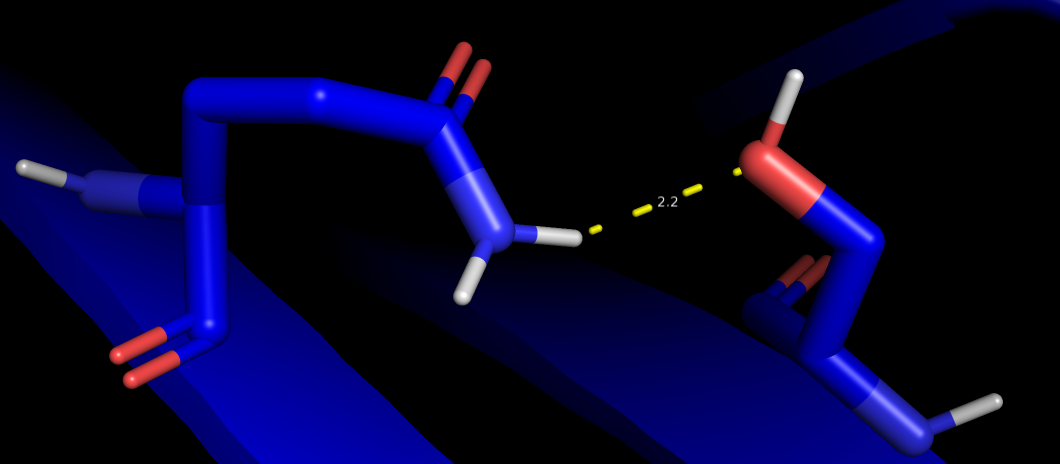 | ||||
Таблица 2. Выбранные для сравнения водородные связи.
В итоге можно сказать, что в каких-то простых случаях вроде альфа-спиралей обе модели хорошо согласуются, и водородные связи определяются верно как в РСА, так и в ЯМР эксперимнте. В более сложном случае появляется вариативность в ЯМР. Вообще ЯМР модель вызывает больше доверия, так как в этом случае видны атомы водорода и снят риск перепутать ориентацию аспарагин, глутамина и гистидина. К тому же ЯМР эксперимент дает возможность делать выводы о динамике и значимости связей и конформаций молекулы. Расшифровка РСА способна привести исследователя к переоптимизации структуры за счет добавления дополнительных водородных связей и пренебрежения подвижностью остатков. Также я хочу отметить, что длина связи в ЯМР ниже из-за того, что она считается от атома водорода.