Отчет по практикуму 11
Выбор и описание семейства доменов
Для анализа я выбрал семейство доменов NO-синтазы (ID: NO_synthase, AC: PF02898). Эти домены играют ключевую роль в работе ферментов, катализирующих реакцию окисления аргинина кислородом с образованием цитруллина и оксида азота II. Хотя ферменты, синтезирующие оксид азота II найдены у многих групп животных, а также растений и бактерий, лучше всего изучена его роль в организме млекопитающих, где он отвечает за регуляцию тонуса сосудов, а также выступает в роли нейромедиатора центральной нервной системы.
Большая часть белков, содержащих домен из данного семейства, принадлежит эукариотам (1564 последовательности), почти в 3 раза меньше - бактериям (666 последовательностей), несколько обнаружено и у архей (10 последовательностей). Для 9 белков обсуждаемого семейства известна 3D-структура. Всего семейство содержит 2340 последовательностей (full), 66 последовательностей входит в выравнивание seed. Обнаружено 52 доменных архитектуры, содержащих этот домен. Наиболее представлены архитектуры NO_synthase, Flavodoxin_1, FAD_binding_1, NAD_binding_1 (807 последовательностей) и NO_synthase (737 последовательностей). Их я выбрал для дальнейшего анализа.
HMM профиль выравнивания был создан 9 октября 2021 года и содержит 362 позиции.
Карта локального сходства белков с разной доменной архитектурой
Для локального выравнивания с помощью программы BLASTp на сайте NCBI я использовал последовательность белка W1SLT7_9BACI с доменной архитектурой NO_synthase (на рис. 1-3 по вертикали) и белка A0A401T1T4_CHIPU с доменной структурой NO_synthase, Flavodoxin_1, FAD_binding_1, NAD_binding_1 (на рис. 1-3 по горизонтали). На рис. 1-3 представлены карты локального сходства для выравниваний этих белков при разных значениях E-value.
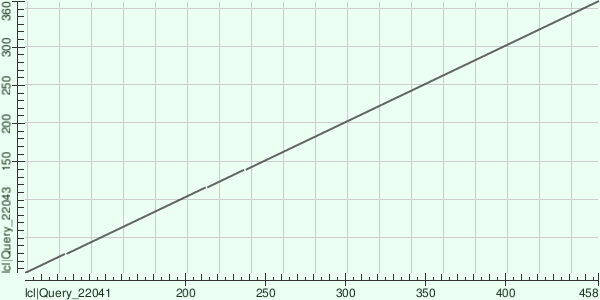
Рис. 1. Карта локального сходства выравнивания с E-value = 0.05
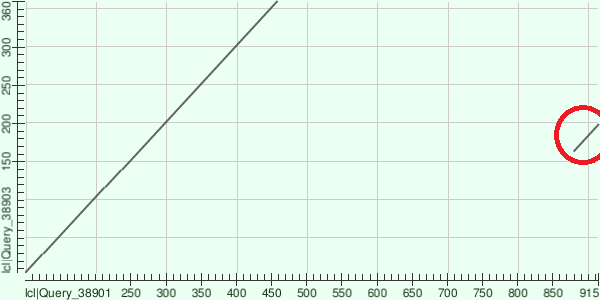
Рис. 2. Карта локального сходства выравнивания с E-value = 5
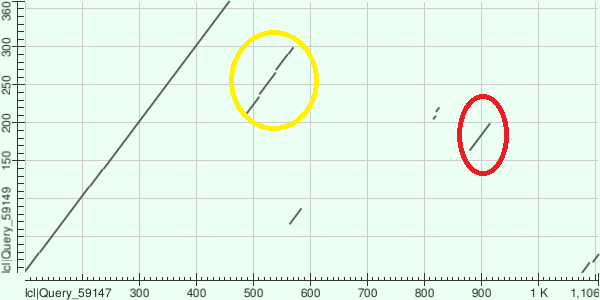
Рис. 3. Карта локального сходства выравнивания с E-value = 25
При E -value = 0.05 можно обнаружить высокое сходство последовательностей белков на участке, соответсвующем NO-синтазному домену, присутствуют лишь очень короткие индели (см. рис. 1). При E-value = 5 обнаруживается еще один участок сходства (на рис. 2 и 3 обведен красным) между участком NO-синтазного домена белка W1SLT7_9BACI и участком ФАД-связывающего домена первого типа (FAD_binding_1) белка A0A401T1T4_CHIPU размером около 50 аминокислот. При E-value = 25 становится заметен участок сходства между NO-синтазным доменом белка W1SLT7_9BACI и флаводоксиновым доменом (Flavodoxin) белка 0A401T1T4_CHIPU длиной около 100 аминокислот (на рис. 3 обведен желтым). Можно предположить, что общий предок двух белков имел доменную архтектуру, подобную NO_synthase, а в линии, давшей начало A0A401T1T4_CHIPU произошла дубликация. Затем, в результате точечных мутаций и инсерций, появившийся участок специализировался для выполнения новой функции и даже разделился на два новых домена. Тем не менее, поскольку сходство проявляется на довольно коротких участках при высоких значениях E-value сделать выводов о наличии гомологии нельзя.
Выделение подгрупп доменов семейства доменов NO-синтазы
Для выделения подгрупп в выбранном семействе доменов, я скачал выравнивание full, содержащее 2340 последовательностей и открыл его в Jalview. Чтобы уменьшить количество строк в выравнивании, я убрал избыточные последовательности (совпадающие на 87 и более процентов), в полученном выравнивании осталось 126 последовательностей. Я заметил, что почти во всех последовательностях на 169 позиции в выравнивании стоит глицин, а на 173-176 позициях последовательность аланин-триптофан-аргинин-аспарагин, поэтому три позиции между этими консервативными участками были выбраны для выделения групп. Наиболее представленными оказались 5 групп, остальные содержат менее 10 последовательностей. Для всех пяти групп характерно наличие на первой позиции аланина. Первая, третья и четвертая содержат на второй позиции лизин, в то время как вторая и пятая - аргинин. На третьей позиции первая и пятая группы содержат лейцин, вторая и четвертая - валин, а третья - метионин. Выравнивание доступно по ссылке.
Таблица белков из Uniprot с доменами семейства NO-синтазы
Чтобы найти в UniProt все белки с доменами анализируемого семейства, я использовал запрос: database:(type:pfam pf02898). Таксономические группы, имеющие такие белки, различаются уже на уровне доменов (superkingdom). Excel-таблица доступна по ссылке.
Описание эксперимента группы Р. Ленски
В 1988 году команда Р. Ленски начала долговременный эксперимент по изучению эволюции, который, как я понимаю, продолжается и сейчас. В качестве модельного объекта была выбрана E. coli (штамм Bc251). Было использовано 12 популяций, 6 из которых были способны усваивать арабинозу (A+1, ... , A+6), а остальные 6 - не способны (A-1, ... , A-6). Каждая популяция была помещена на искусственную среду DM25, на которой скорость размножения бактерий ограничена количеством глюкозы. Каждый день 0,1 мл жидкости из истощенной среды с бактериями пересевалось на свежую среду, богатую глюкозой и другими необходимыми веществами, для продолжения размножения. Каждые 500 поколений дополнительный образец бактерий каждой популяции замораживался и сохранялся в глицерине, чтобы ученые имели возможность повторить эксперимент с определенной точки. Кроме того, геномы многих рубежных поколений были секвенированы. Бактерии из разных популяций не соприкасались между собой, поэтому каждая популяция эволюционировала независимо. Для данного штамма характерно отсутствие полового процесса, так что единственным источником генетического разнообразия являлись мутации [1].