Восстановление кристалла, pr2
Last updated: 13-01-2020.
Для выполнения этого практикума была выбрана интеграза ВИЧ (PDB ID 3LPU). Разрешение структуры – 1.95Å.
Задание 1: Взаимодействие белка с соседними субъединицами
Восстановление кристалла
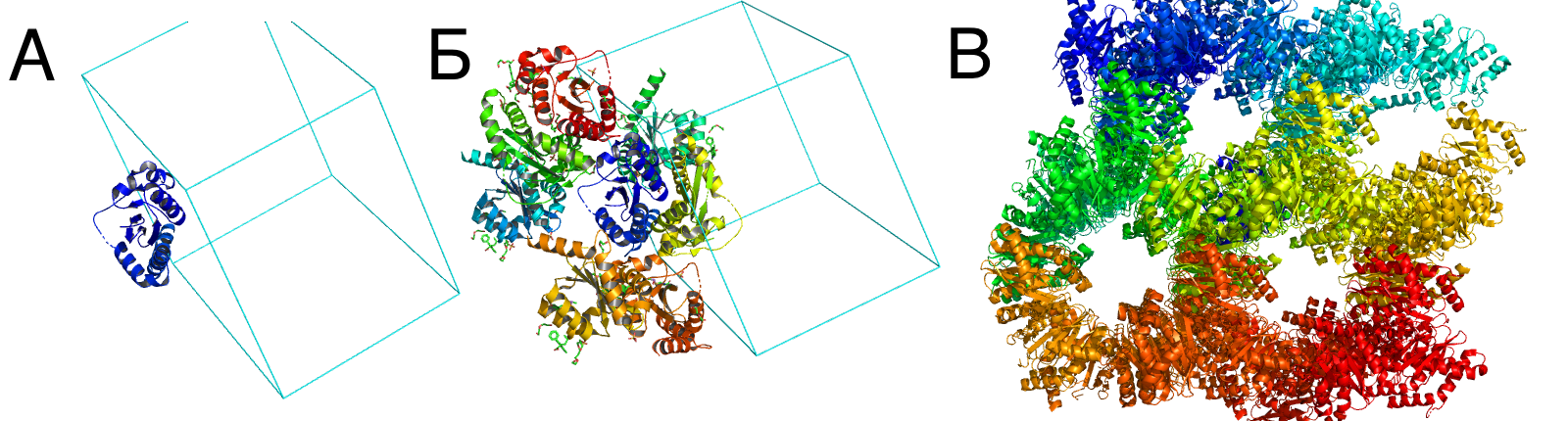
Кристалл был восстановлен с помощью команды "symexp" на расстоянии 5Å и 60Å (рис. 1Б и 1В). Давайте чуть внимательнее посмотрим на соседей нашей структуры, которые восстановились на расстоянии 3Å. Различные типы контактов будут подробно рассмотрены в следующем задании, а в этом задании пусть критерием взаимодействия/не взаимодействия соседей будет наличие полярных контактов. Полярные контакты рассматривались с помощью интересного плагина show_contacts. Интересен он тем, что не просто отображает полярные взаимодействия, а ещё может окрашивать электростатические перекрывания don-don/acc-acc (нормальные контакты жёлтые, электростатические перекрывания красные). Конечно, такое можно сделать и ручками, но плагином приятнее. И так, после symexp'а на расстоянии 3Å, мы увидели 7 соседей нашего белка (Рис. 2А, основной белок синего цвета). Со всеми из этих соседей белок образует полярные контакты, однако в некоторых местах во взаимодействие вступают всего лишь до трёх аминокислот. Если выкинуть таких "лузеров", то останется 3 соседа, с которыми белок образует 3 зоны контакта (Рис. 2Б). Рэйтрейсинг занимает вечность, при этом рисунки отображают контакты не так хорошо, как хотелось бы, поэтому на всякий случай [прикладываю .pse файл], который при желании можно скачать. Далее предлагаю перейти к детальному рассмотрению одной выбранной зоны контакта.
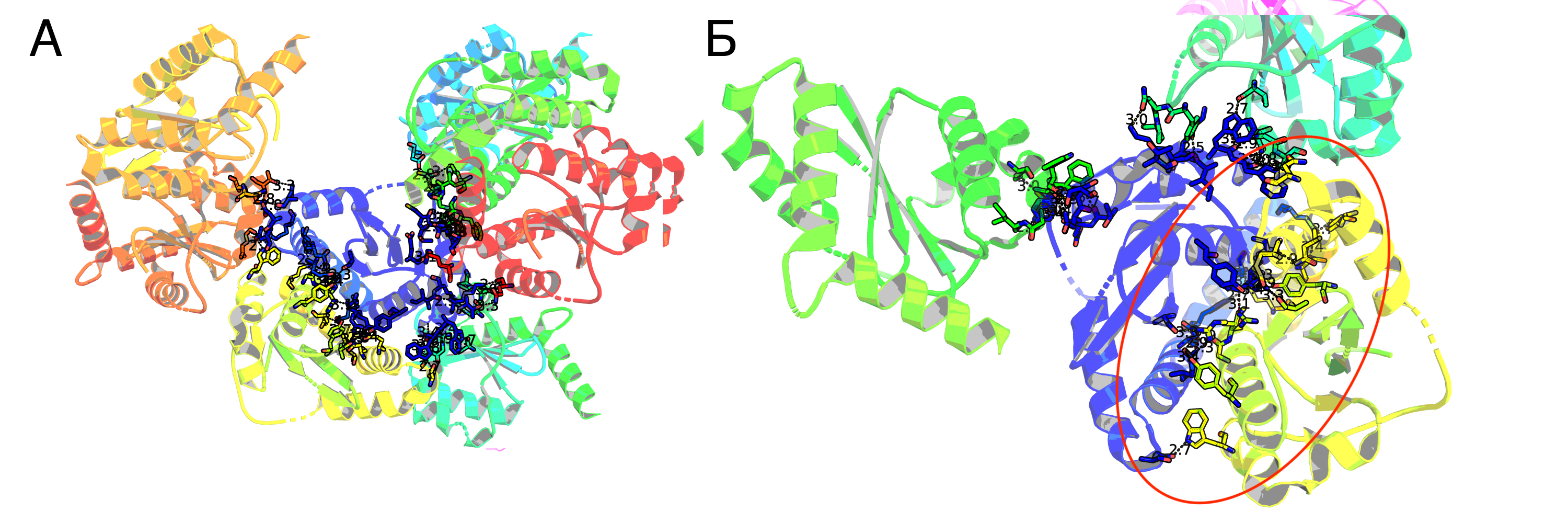
Детальный разбор одной зоны контакта
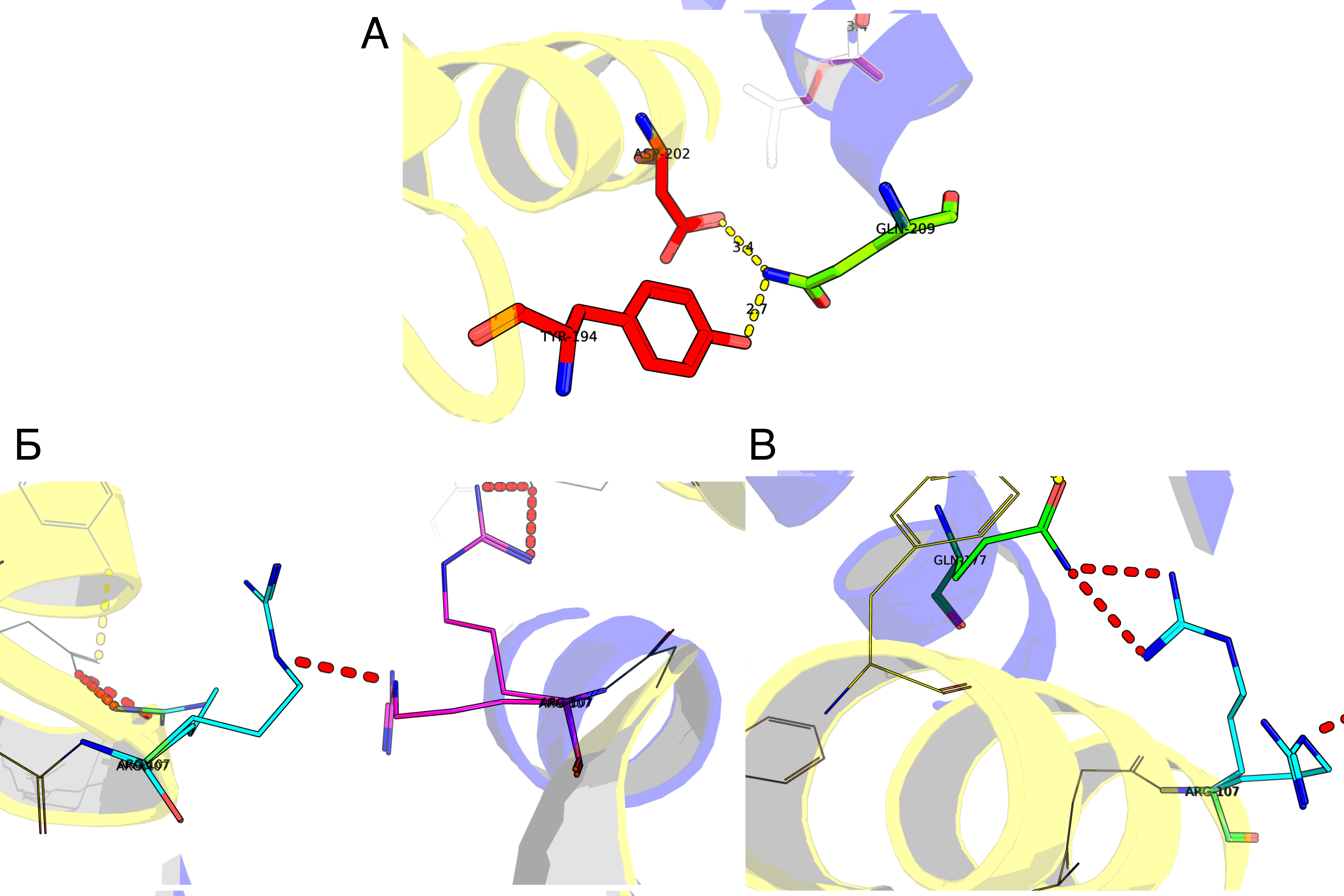
Для выполнения этого задания было выбрано взаимодействие, обведённое красным эллипсом на рисунке 2Б. Почему именно оно? 1) эти два белка образуют наибольшее количество контактов 2) такое взаимодействие включается в biological assembly.
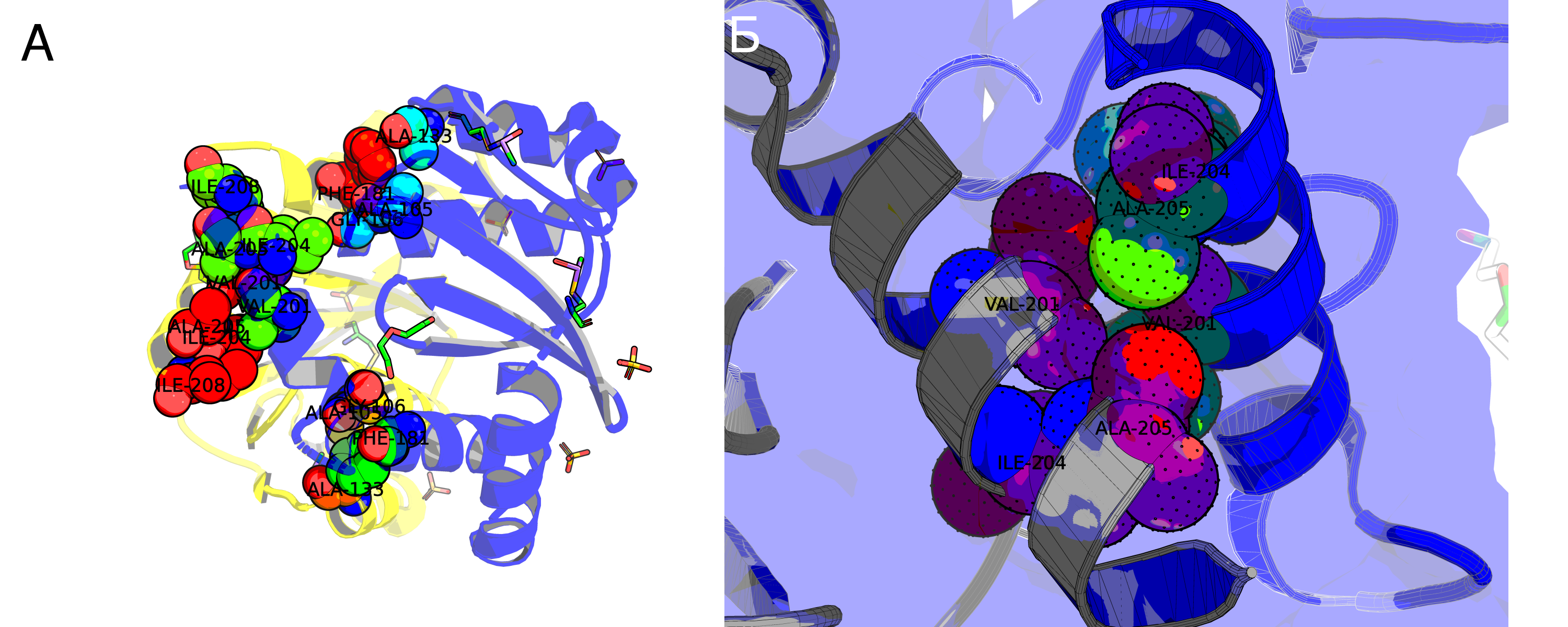
На рисунке 3 приведено взаимодействие двух белков. Wire'ами отображены аминокислоты, образующие полярные контакты. Но "полярные контакты" – весьма расплывчатая формулировка. Белковые контакты образуются за счёт следующих основных взаимодействий: водородные связи (водяные мостики – частный случай), солевые мостики, гидрофобные взаимодействия. Давайте попробуем поискать примеры каждого из этих контактов между нашими структурами. На рисунке 4А приведён пример образования водородной связи между GLN209 3lpu и двумя аминокислотами восстановленной структуры: ASP202 и TYR194. Теперь к солевым мостикам. В физиологических условиях солевые мостики стоит искать между глутаматом/аспартатом и лизином/аргинином. Мостиков не нашлось, однако нашлась другая странность: два очень близко лежащих ARG107 (Рис. 4Б). При ближайшем рассмотрении становится заметно, что авторы структуры предлагают два альтернативных расположения этих аргининов. Видимо, они проявляют подвижность, смотря в раствор при мономерном состоянии интегразы и "отодвигаясь" при димеризации за счёт стабилизации 177 глутамином второй субъединицы (Рис. 4В. На рисунке связи справедливо отмечены красным, но можно предположить, что глутамин "разворачивается"). Погуглив я понял, что Америку не открыл: хоть в явном виде такой механизм никто (вроде) не описывал, роль ARG107 и GLN177 в димеризации была известна давно. И даже были найдены ингибиторы димеризации интегразы, взаимодействующие с этими аминокислотами (ссылка). Для поиска гидрофобных взаимодействий я сделал следующее: выбрал гидрофобные остатки каждой субъединицы и отобразил те, что находились на расстоянии меньше 4Å друг от друга (при пороге 3.5Å ничего не нашлось). Результат представлен на Рис.5А. На рисунке 5Б показан один из контактов поближе. Видно, что в целом он недоступен растворителю.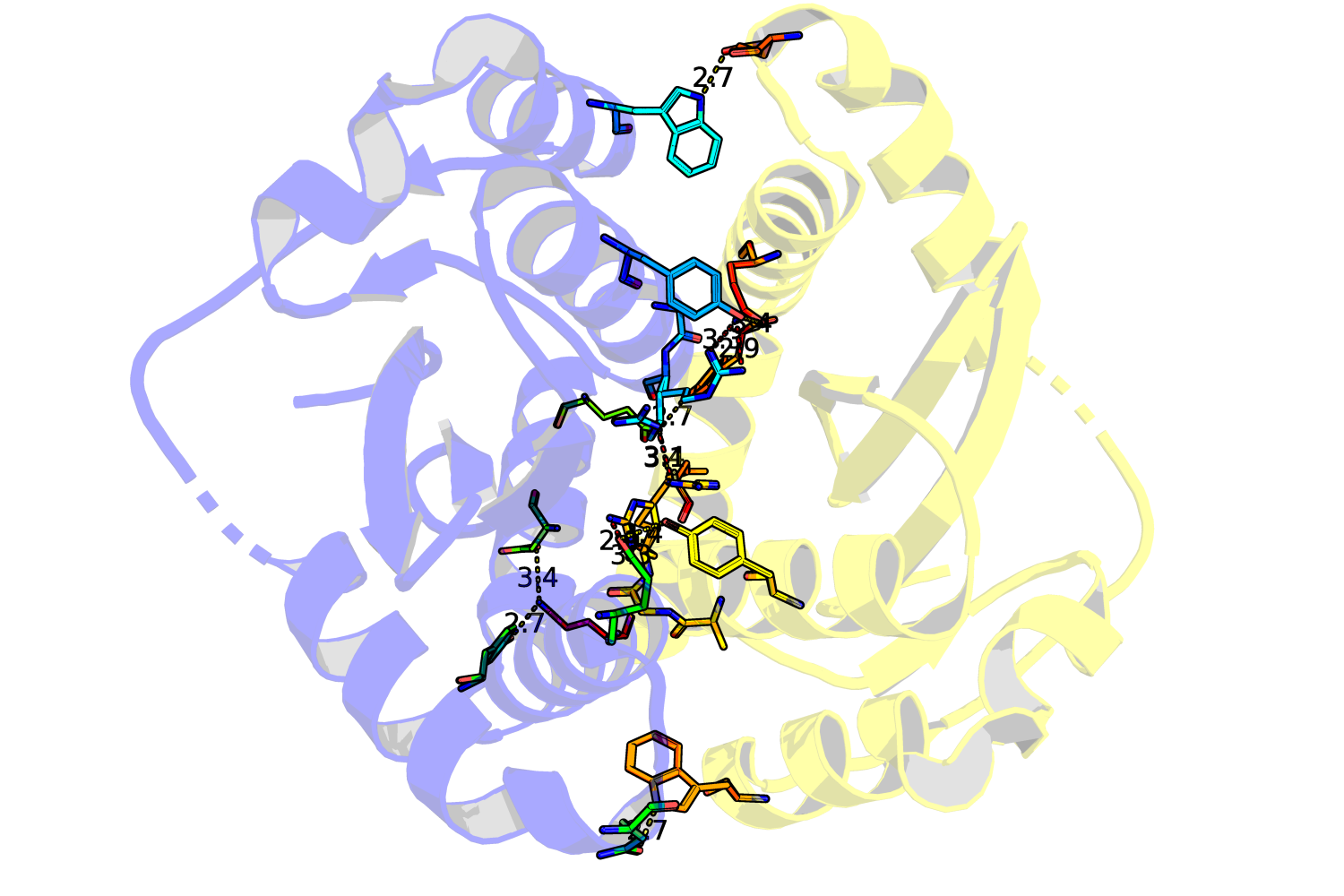
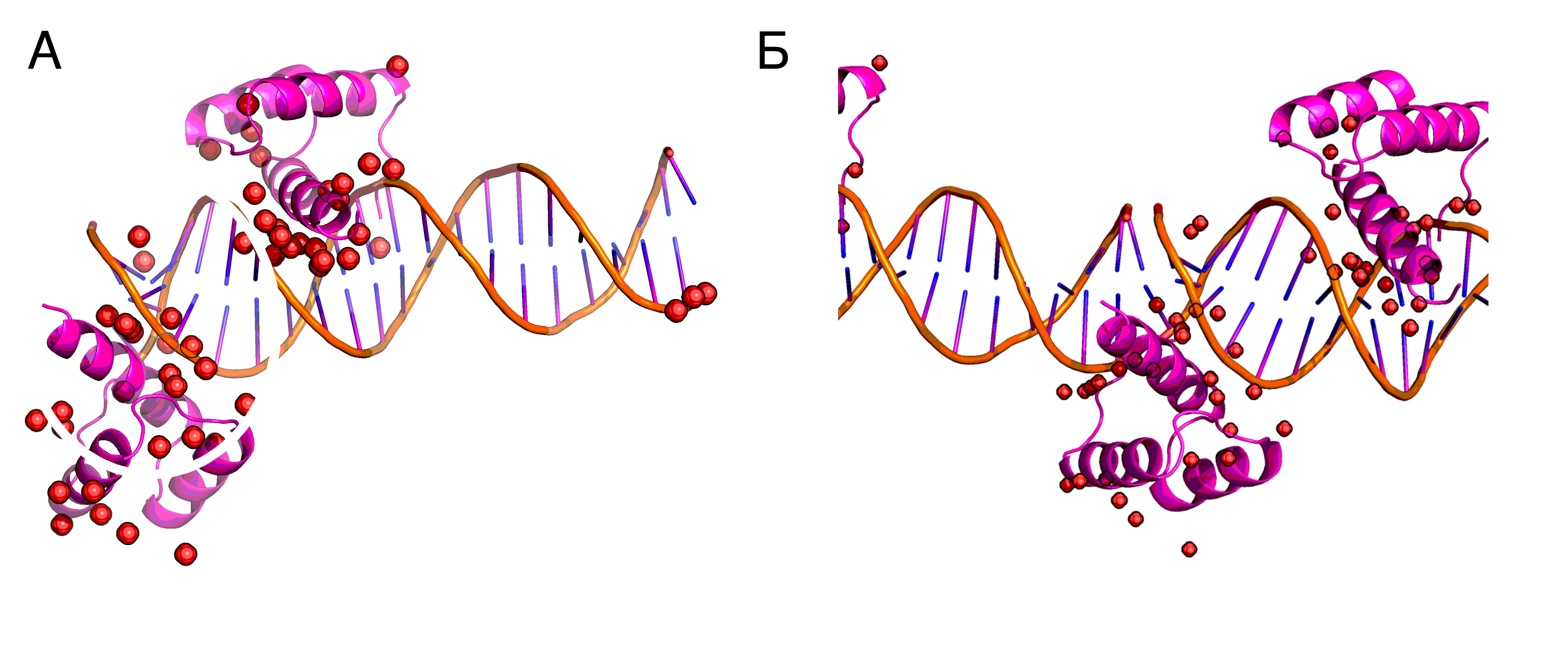
Задание 2: Cтранности ДНК-белкового комплекса 3hdd.
На первый взгляд, кажется, что со структурой что-то не так. Альфа-спираль одного белка лежит как надо в бороздке ДНК, а вот альфа спираль второго, с таким же фолдом, связывается с концом ДНК (рис. 3А). Парадокс разрешается при построении соседних асимметрических единиц: появляется "продолжение" ДНК, и второй белок также связывает бороздку ДНК (рис. 3Б).