В данном задании было дано 2 PDB_ID, один из которых соответствует открытой форме белка, второй - закрытой. Нужно было определить визуальные отличия между данными структурами. Затем для обеих форм нужно было посчитать площадь молекулярной поверхности (MS) и площадь поверхности, доступной растворителю (SAS).
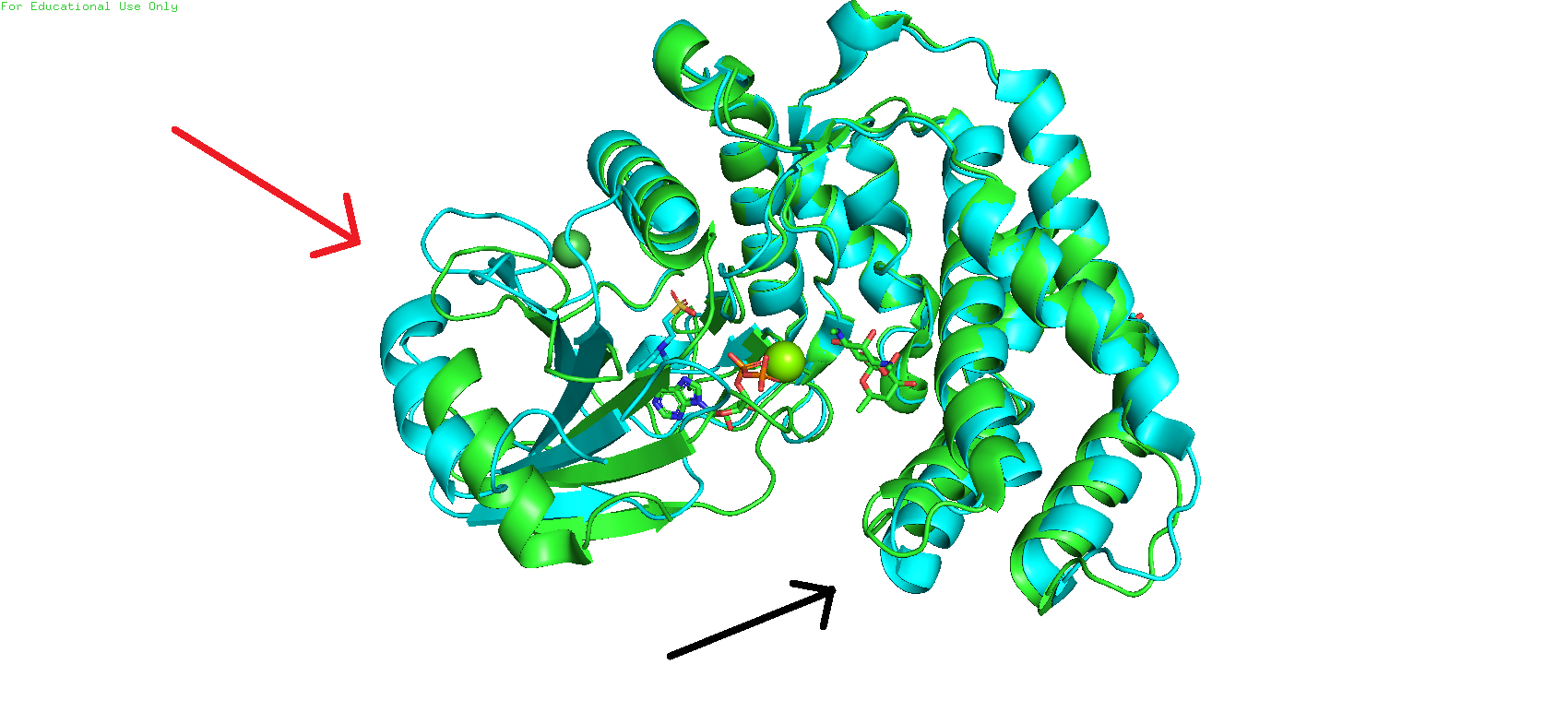
Были скачаны биологические сборки данных моделей и для более эффективного анализа наложены друг на другап при помощи команды super. На Рис 1 изобрадён результат наложения; зелёным цветом обозначена структура модели с PDB_ID 3I0O, голубым цветом - с PDB_ID 3I1A. При загрузке моделей и х наложении сразу бросилась в глаза одна деталь - в левой части глобулы (указано красной стрелкой на Рис 1) цепи двух моделей не очень хорошо накладываются друг на друга. Также с правой стороны две петли немного смещены друг относительно друга (чёрная стрелка на Рис 1). То есть у нас здесь зелёный белок соответствует закрытой конформации, а голубой - открытой. Также ещё стоит отметить, что зелёная структура находится в комплексе с АДФ и спектиномицином, чего нет у голубой структуры (однако у неё есть другой лиганд - MES (2-(N-MORPHOLINO)-ETHANESULFONIC ACID)).

Рис. 1. Результат наложения друг на друга двух моделей с PDB_ID 3I0O и 3I1A
При более детальном рассмотрении структур открылись ещё некотрые моменты. В одном месте (Рис 2) участок цепи с 249 по 253 остатки у зелёной модели отображён в виде витка альфа-спирали, в то время как этот же участок у голубого белка имеет вид петли.
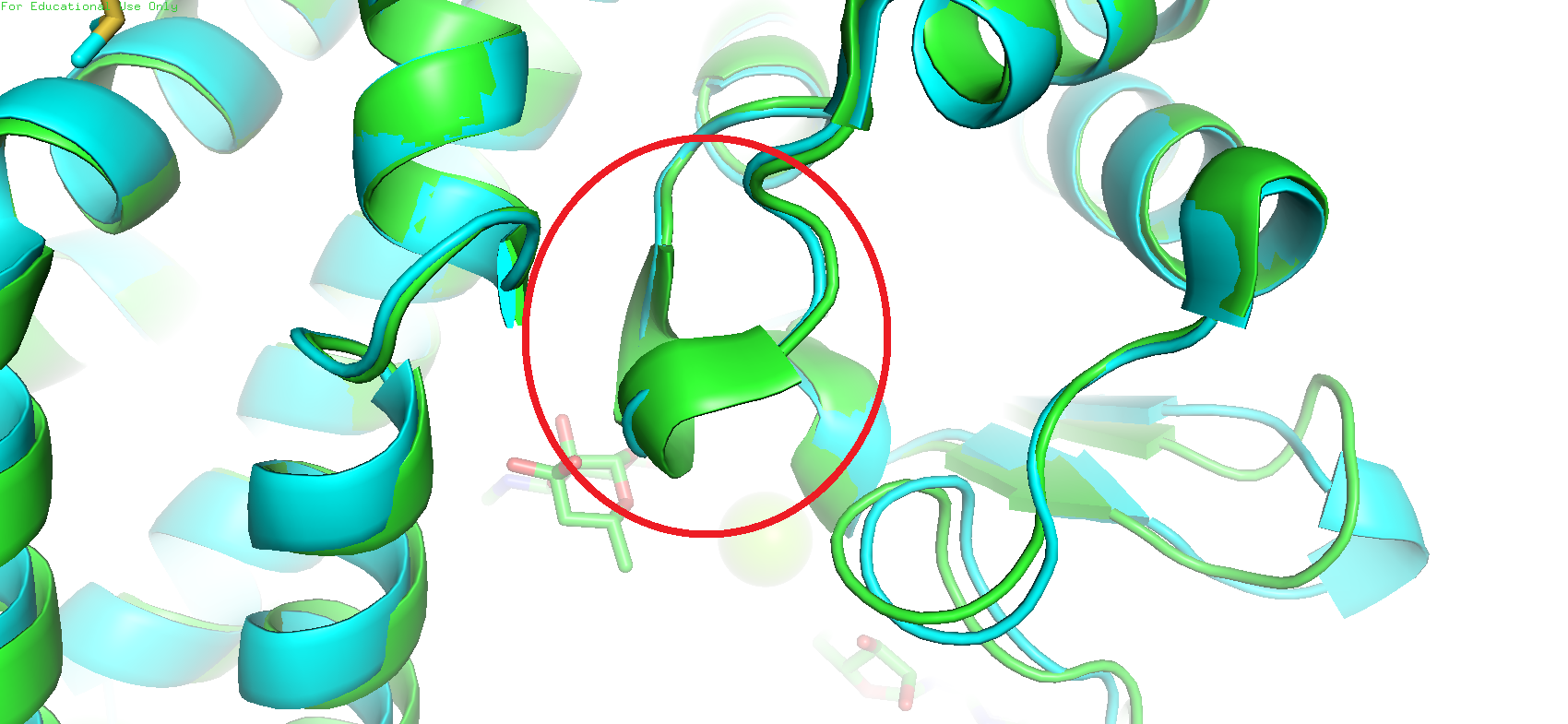
Рис. 2. Разные структурные отображения одного и того же участка в двух моделях
Однако в то же время другой участок цепи, а именно с 222 по 224 остатки, у голубого белка изображён витком альфа-спирали, а у зелёного - петлёй (Рис 3).
Рис. 3. Разные структурные отображения одного и того же участка в двух моделях
Вдобавок ещё оказалось (Рис 4), что С-конец зелёного белка будет подлиннее, чем у голубого, на 2 аминокислоты (при этом радикал у лейцина 332 кажется каким-то "обрезанным" на 3 атома углерода)
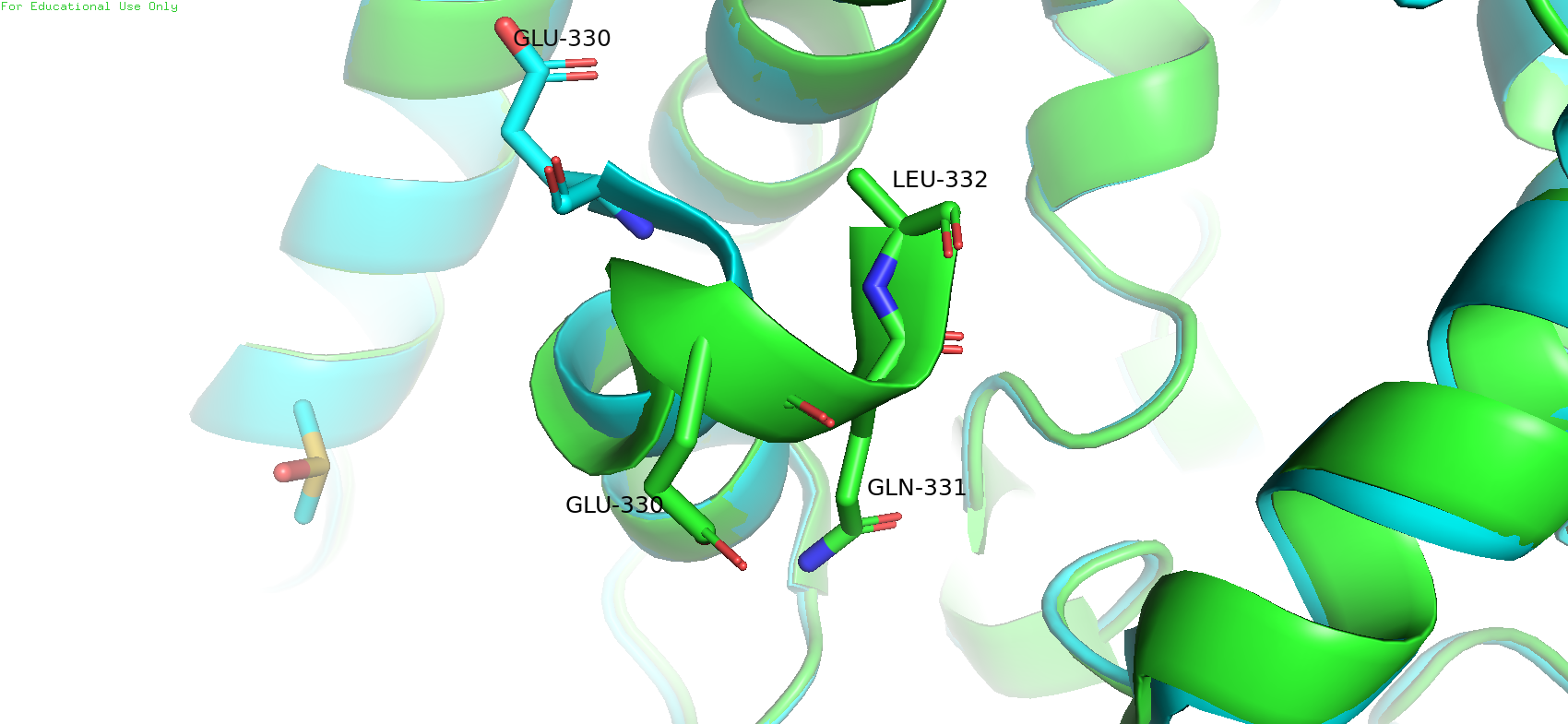
Рис. 4. С-конец у двух структур
Затем для двух структур были измерены площади молекулярной поверхности и поверхности, доступной растворителю (в ангстремах^2). Результаты приведены в Таблице 1. Стоит отметить, что перед подсчётом площади растворитель и различные лиганды были удалены из структуры, чтобы посчитать площади именно для белка и без всего лишнего.
Таблица. 1. Значения значений площади молекулярной поверхности и поверхности, доступной растворителю, для двух моделей белка
Модель |
MS |
SAS |
3I0O |
33478.281 |
16496.717 |
3I1A |
34567.484 |
16684.680 |
Можно заметить, что площадь молекулярной поверхности у белка с закрытой конформацией на 1089.203 ангстрем^2 меньше, чем у открытой. Однако площади поверхностей, доступных растворителю, у двух структур различаются не так сильно - у закрытой конформации она меньше чем у отурытой всего на 187,963 ангстрем^2. Как вариант, это может быть связано с тем, что некоторые остатки, которые в открытой конформации сидят в белке, при "закрытии" структуры могут как бы экспонироваться наружу, тем самым уменьшая разницу в площади. Вполне возможно, что этому есть и другое объяснение.
На данном этапе нужно было определить полодение основного кармана связывания. С помощью сервиса fpocket нужно было предсказать положение и параметры карманов на поверхности молекул.
При переходе в режим surface и переключении между моделями довольно хорошо становится заметен карман связывания. Особенно отчётливо это видно с такого ракурса (Рис 5)
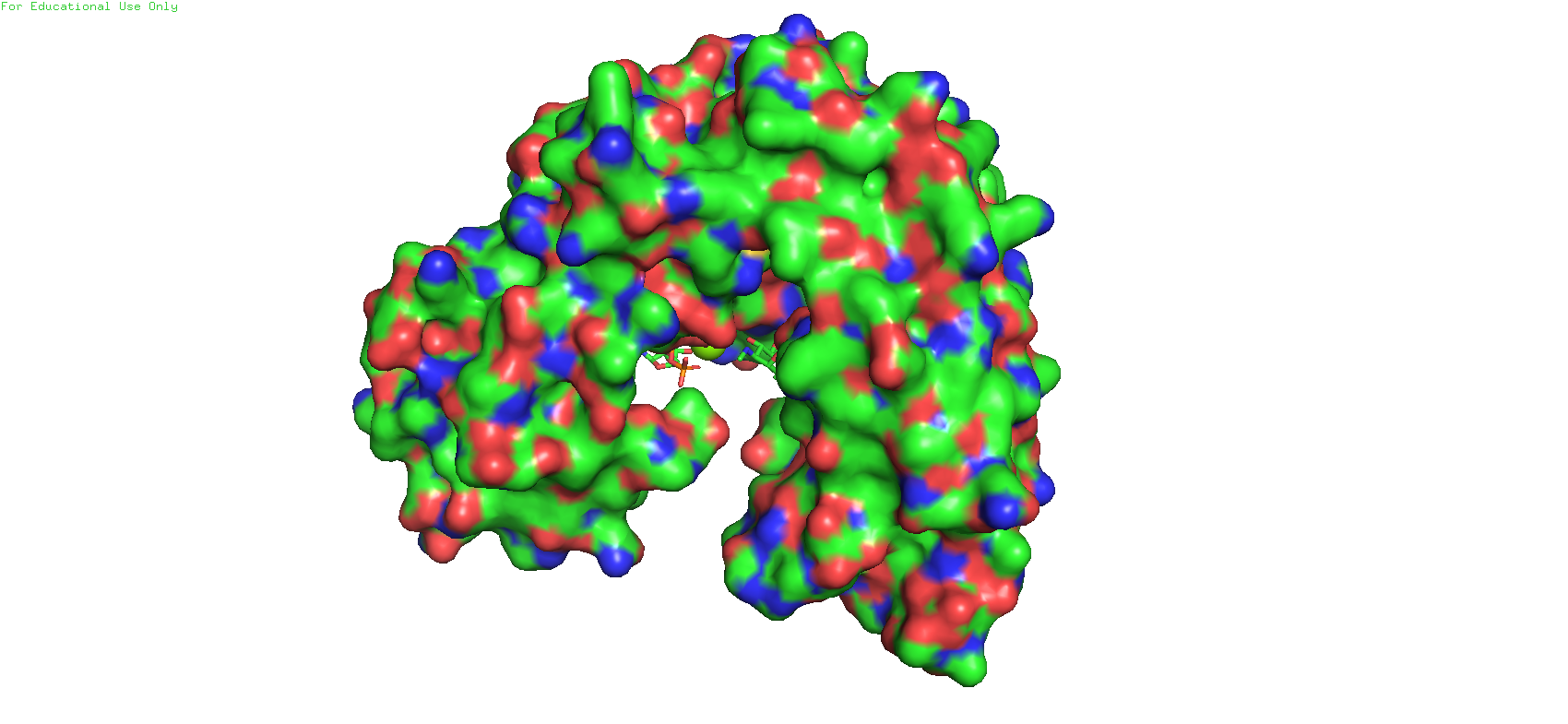
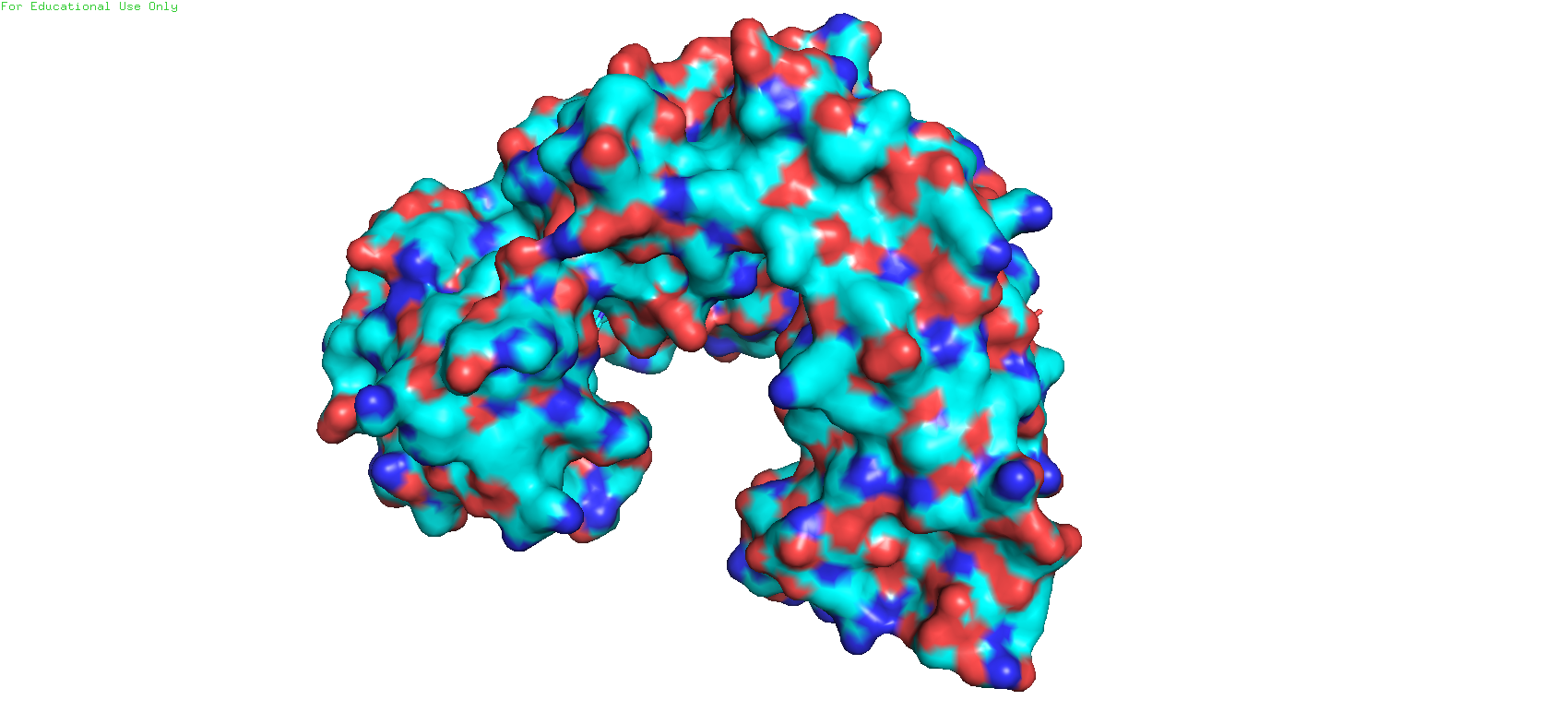
Рис. 5. Сравнение двух моделей в режиме surface. С левой стороны молекулы можно видеть карман связывания.
В результате работы сервера со структурой 3I0O было получено 24 потенциальных кармана. Многие из них не подходили, но наиболее похожим на определённый визуально оказался карман 3. На Рис 6 он изображён в виде белых сфер. Объём данного кармана составил 1902.8763 ангстрем^3.
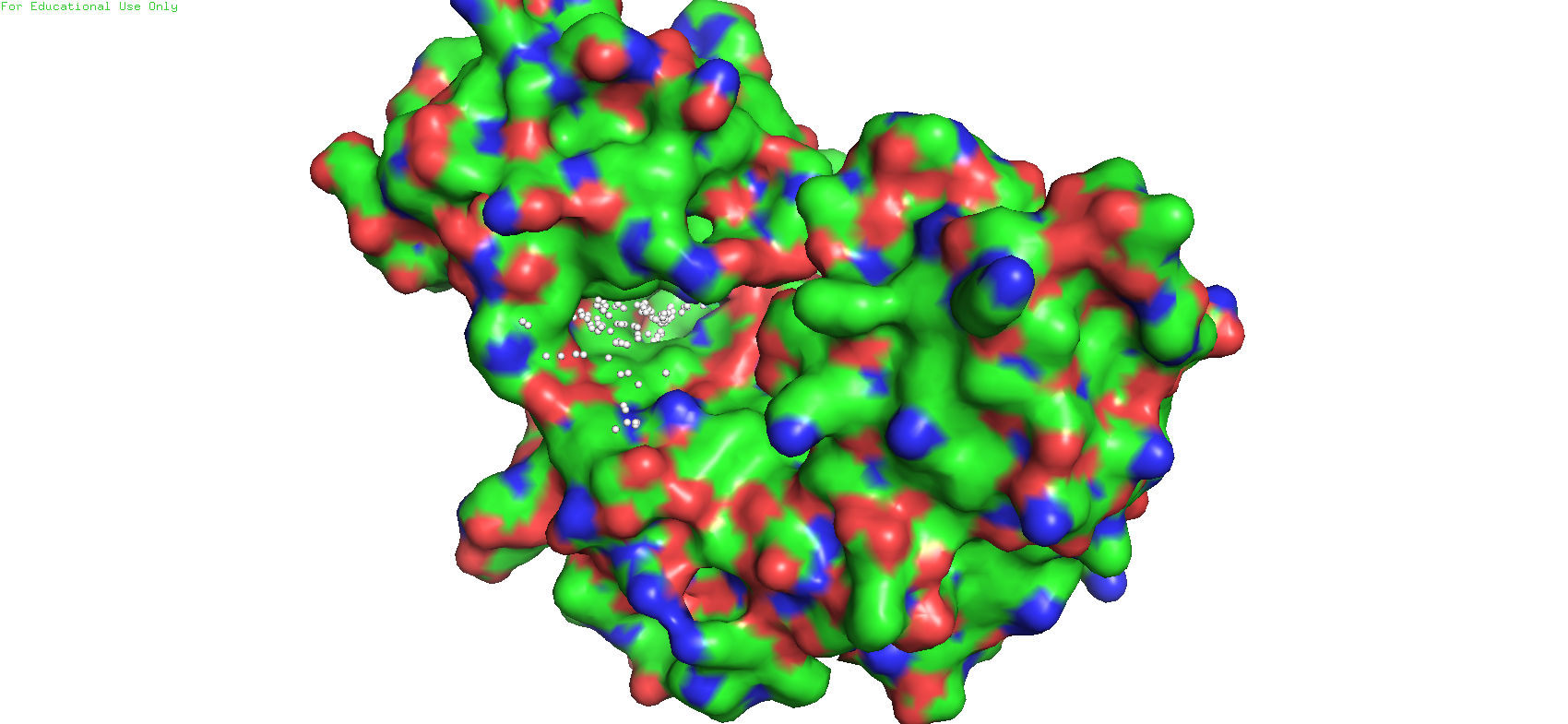
Рис. 6. Карман 3 в структуре 3I0O
При анализе структуры 3I1A сервер показал 23 потенциальных кармана. Из них больше всего соответствовал визуально определённому карман 1 (Рис 7). Его объём составил 1389.6356 ангстрем^3.
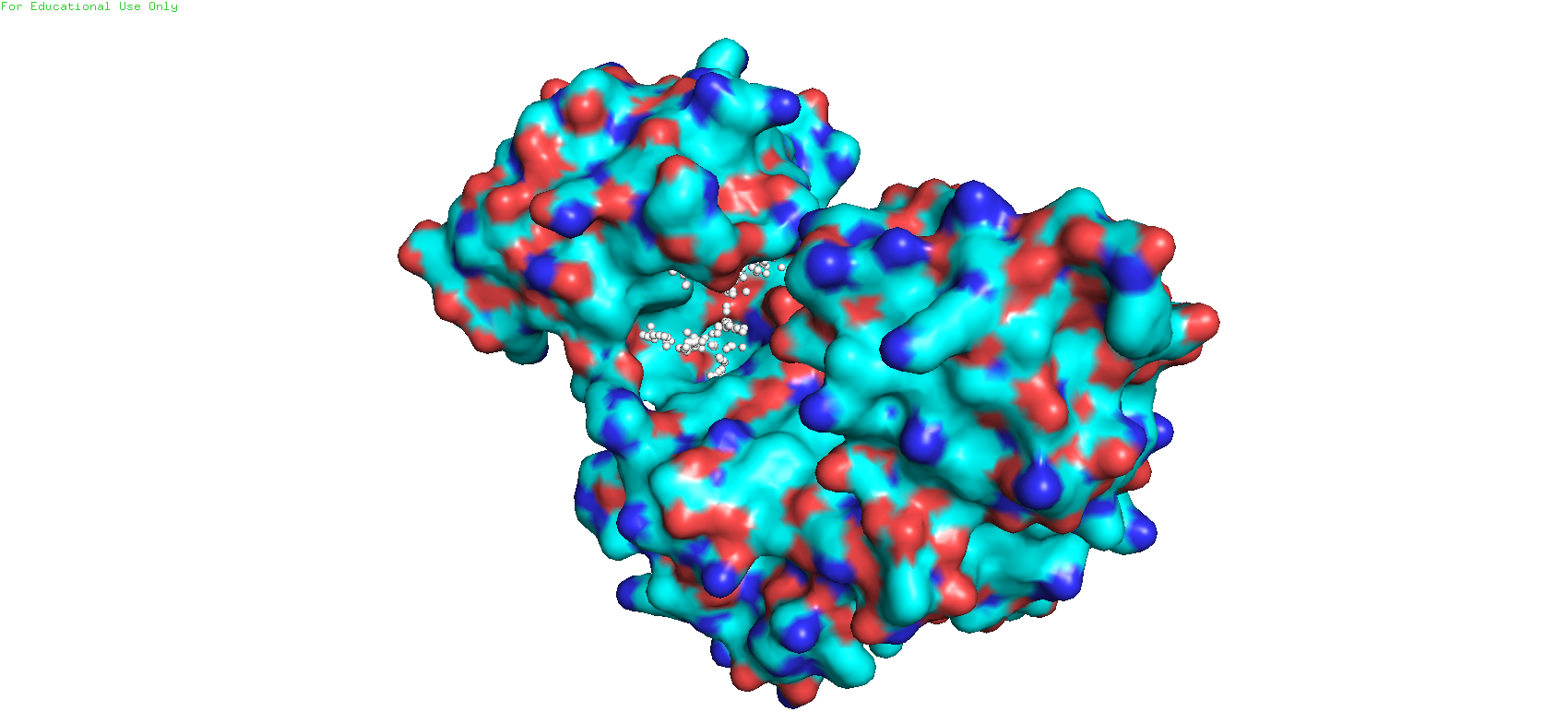
Рис. 7. Карман 1 в структуре 3I1A
Как можно заметить объём кармана у структуры с открытой конформацией оказался меньше, чем объём кармана у закрытой конформации. Казалось бы странно, однако при более приближенном рассмотрении оказалось, что в закрытой конформации в области кармана образуется что-то на подобие "пещерки", причём довольно глубокой, внутренность которой также считается программой за карман, чего нет у открытой структуры. Видимо этим и вызвана столь странная разница в объёме.
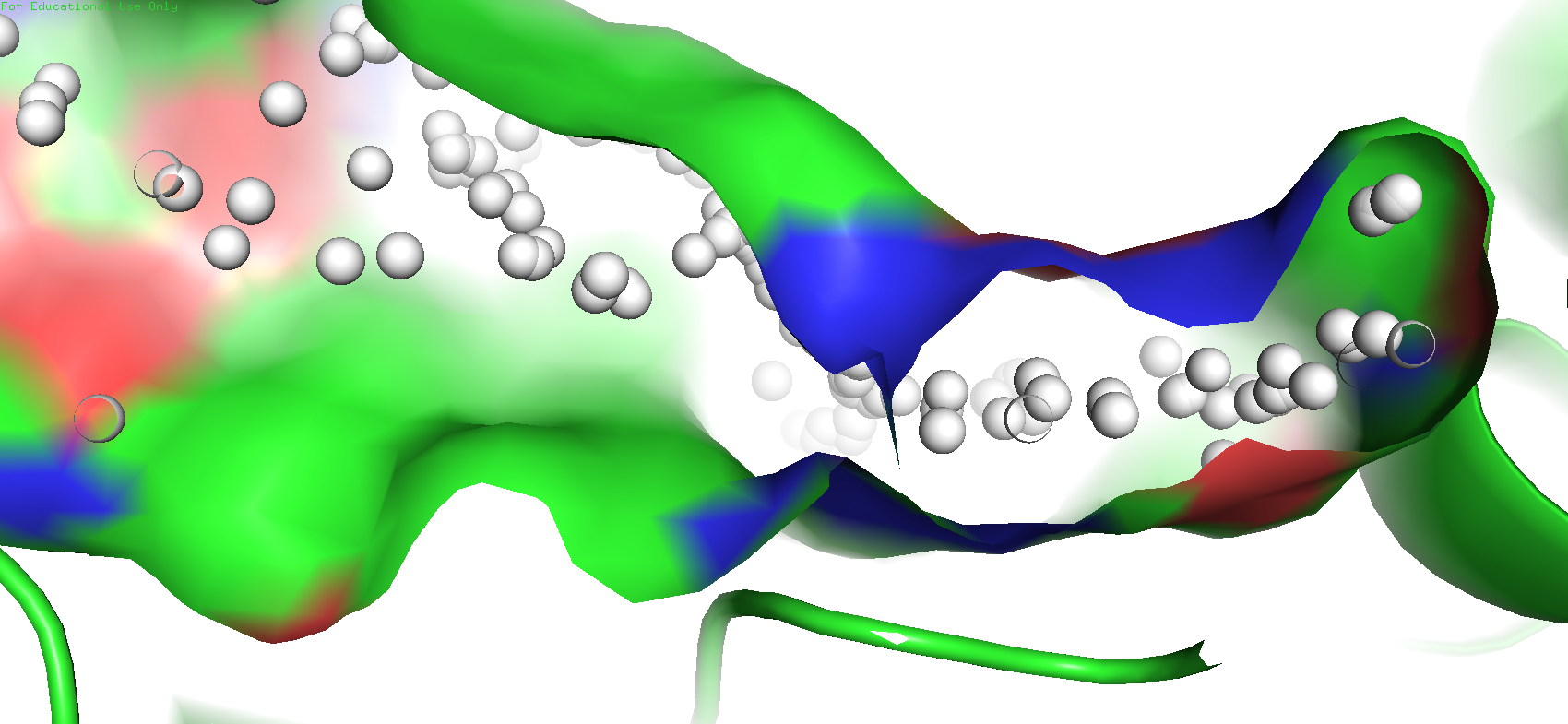
Рис. 8. "Пещерка" в структуре 3I0O
В данном задании нужно было посчитать экспонированность остатков с помощью пакета DSSP, и далее сопоставить экспонированность остатка с его номером для обеих структур, после чего определить, какой остаток больше всего изменил свою экспонированность при "закрытии" белка.
В результате сравнения двух структур выяснилось, что наибольшей разницей в экспонированности между открытой и закрытой конформациями обладает 59-й остаток, а именно ASP 59. В структуре 3I0O его экспонированность составляет 9, а в структуре 3I1A - 128. Разница в 119 является самой большой среди остальныхх остатков.
На Рис 9 данный остаток у закрытой конформации покрашен золотым цветом, у открытой - красным. Можно заметить, что радикал ASP 59 в первом случае как бы смотрит больше внутрь белка, а во втором случае торчит наружу, где может спокойно взаимодействовать с растворителем, в отличие от первого случая. Причём можно заметить, что в закрытой конформации данный остаток находится в составе альфа-спирали, а в открытой - в составе петли.
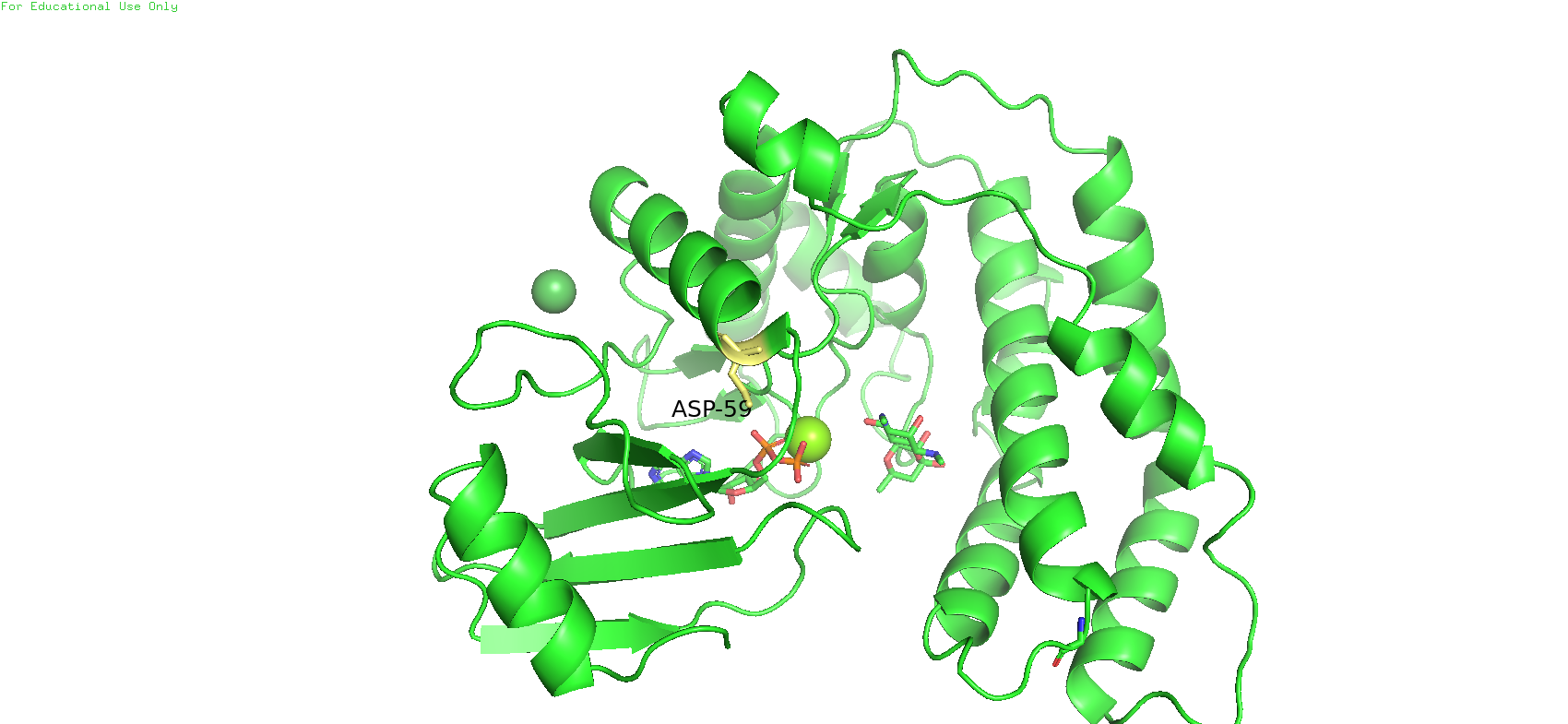
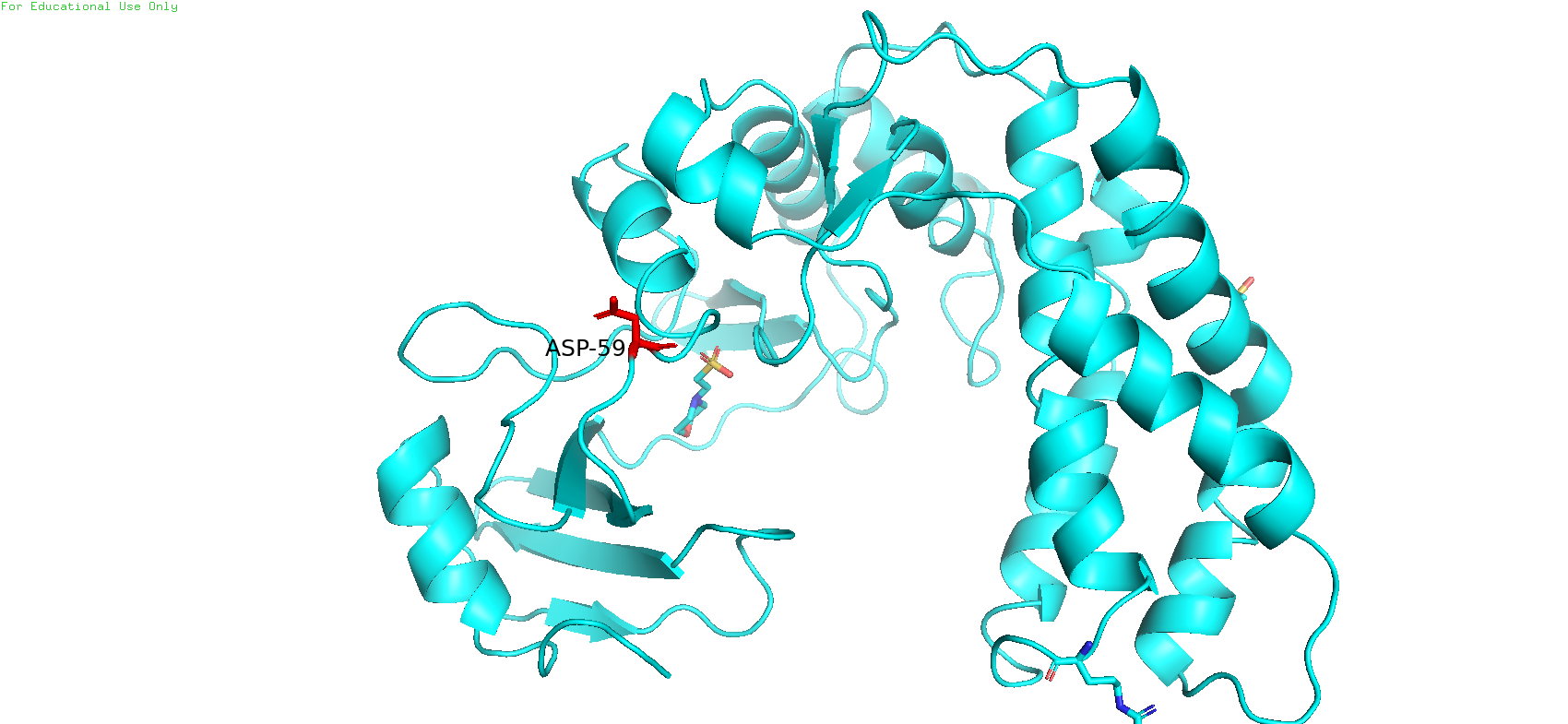
Рис. 9. ASP 59 в открытой и закрытой конформациях белка
© Иззи Антон, 2020