В даннмом задании необходимо было взять PDB_ID из первого практикума (5R7Y), структуру протеазы Sars-Cov-2 с лигандом, и с помощью программы Poseview сгенерировать 2Д-диаграмму взаимодействий.
В прошлый раз было высказано предположение о том, что несколько остатков могут иметь значение при взаимодействии с лигандом, однако водородных связей в модели обнаружено не было. Посмотрим что по этому поводу покажет программа.
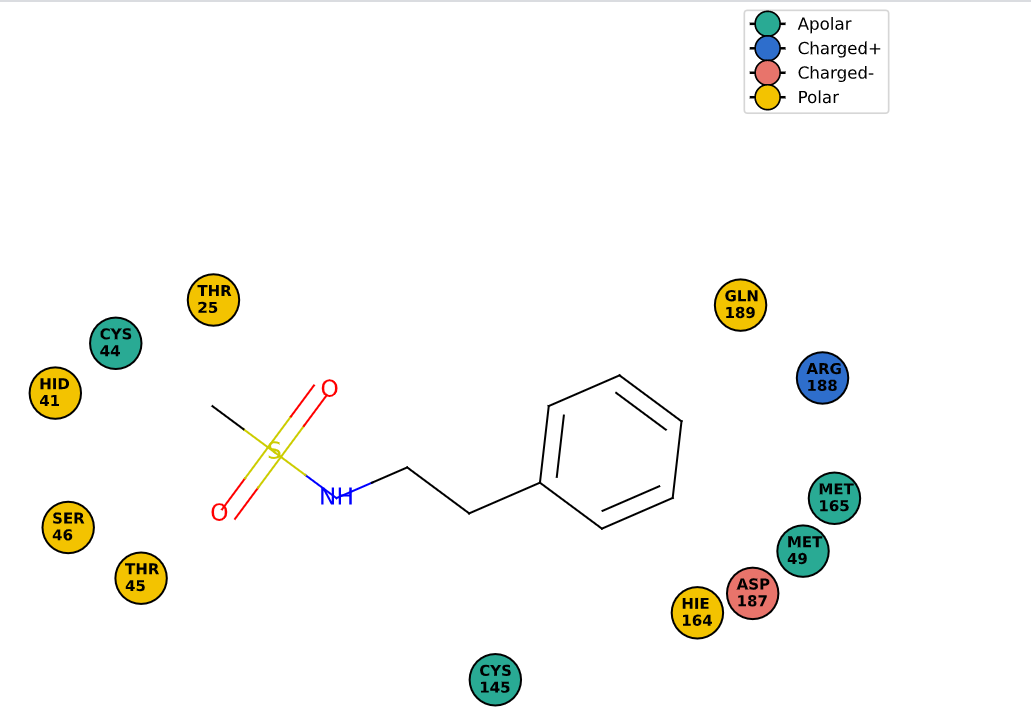
Первая попытка была осуществлена на сайте Protein Plus, но при прогоне PDB_ID программа не выдала никакого варианта 2Д-диаграммы, не показал никаких взаимодействий. Тогда была предпринята попытка второго прогона, но уже на сайте playmolecule.com. В результате была получена следующая диаграмма:

Рис. 1. 2Д-диаграмма взаимодействий лиганда JFM-1001, полученная с помощью программы Poseview
Как можно заметить, программа также не обнаружила никаких водородных взаимодействий. Если снова посмотреть на модель, то можно увидеть, что большинство остатков, которые могли бы служить донорами водородной связи, смотрят в совершенно другую сторону от лиганда, или же слишком далеко от него расположены.
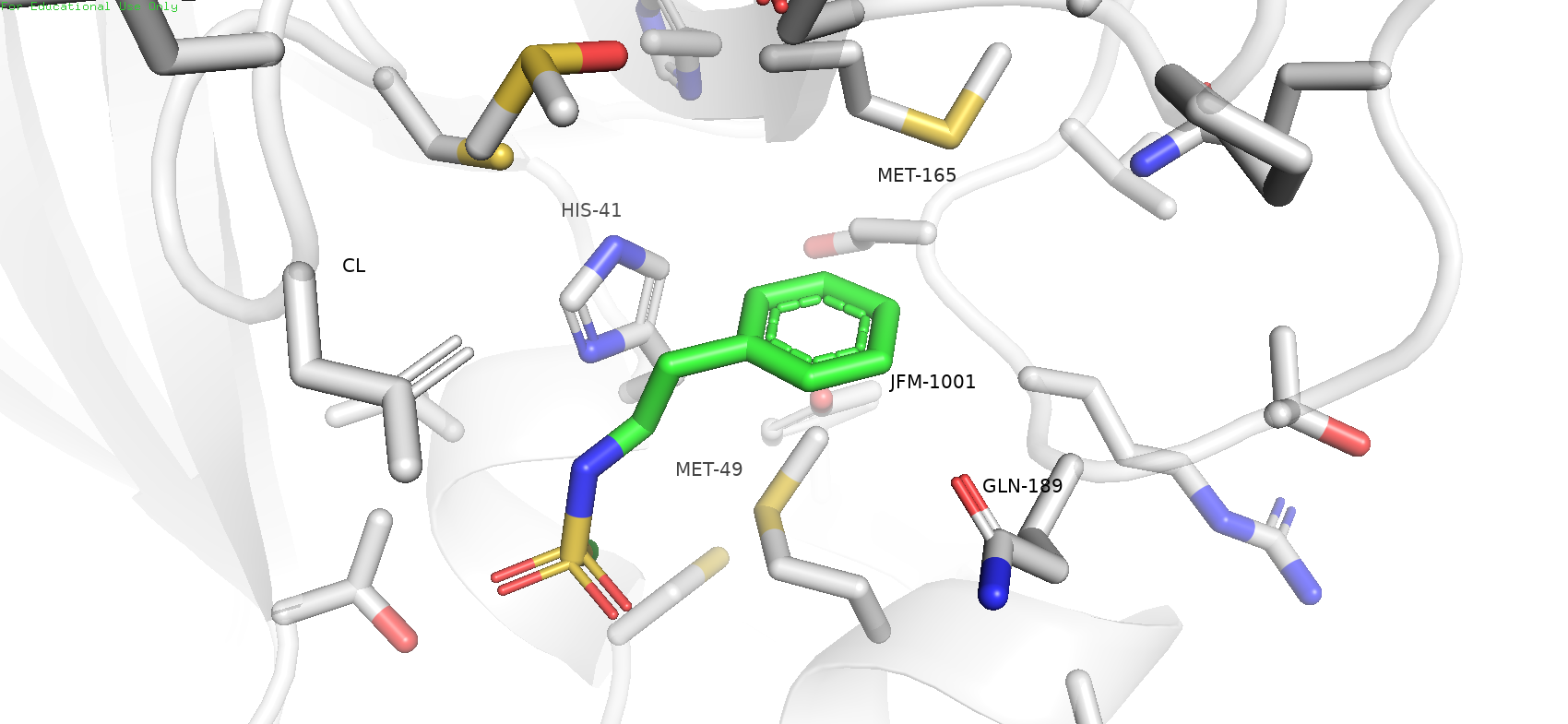
Рис. 2. Окружение лиганда JFM-1001
Если включить режим surface, то видно что лиганд располагается в так называемом "кармашке". Можно предположить, что в таком положении он может удерживаться гидрофобными взаимодействиями, которые могут обеспечивать MET-49 и MET-165.
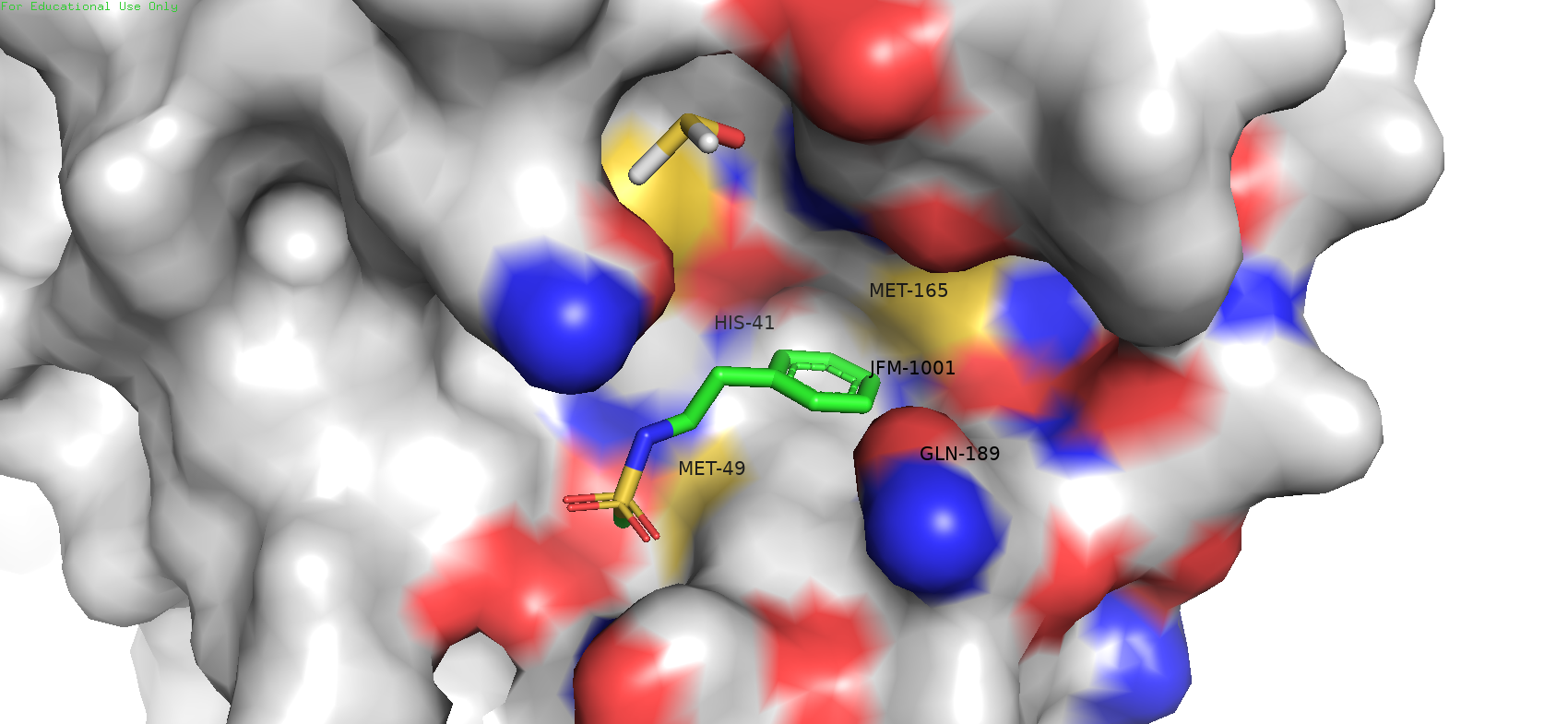
Рис. 3. Режим surface
Также говорилось, что во взаимодействии с лигандои может принимать участие HIS-41. Если мы рассмотрим ближе, то увидим, что он располагается на расстоянии 3.6 ангстрем от ароматического кольца лиганда, и повёрнут к нему практически под 90 градусов. Таким образом, можно предположить, что данный гистидин с лигандом может образовывать стэкинг-взаимодейсвтие, вероятнее всего Т-стэкинг, что также дополняет картину взаимодействия JFM-1001 с белком.
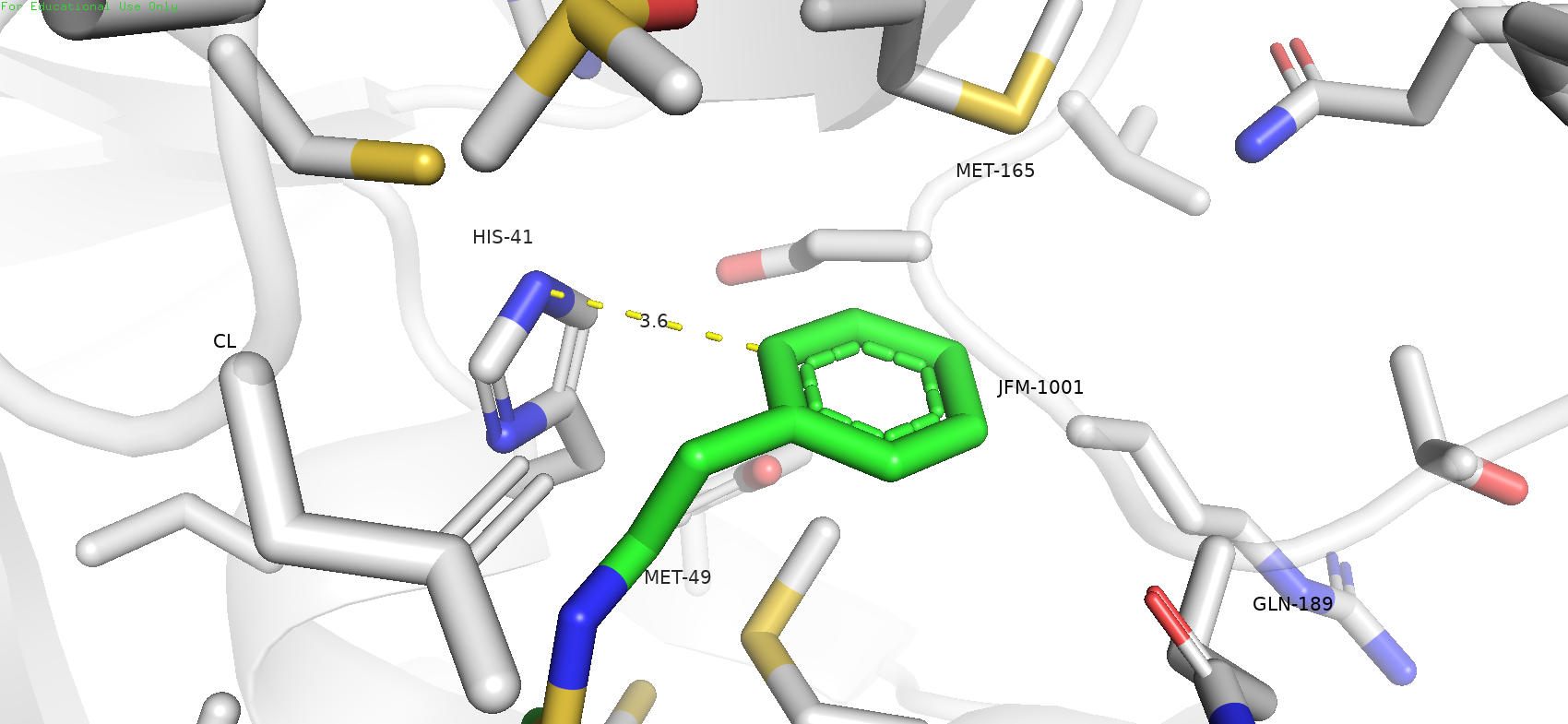
Рис. 4. Взаимодействие лиганда с гистидином-41, возможно Т-стэкинг
В данном случае нам был выдан комплекс антитела с пептидным антигеном, где в одной его позиции одна аминокислота была заменена на глицин. Нужно попытаться выяснить, что это была за аминокислота.
На Рис5 можно видеть взаимодействие антигена (цепь С, покрашен красным) с белком (серый, отображён поверхностью). Исследуемая позиция искомого остатка (в данной модели представлен глицином) покрашена циановым. Можно заметить, что в этой области внутрь белка вдавлен некоторый кармашек; это означает, что в данной позиции находится точно не глицин, а остаток с довольно ощутимым радикалом.
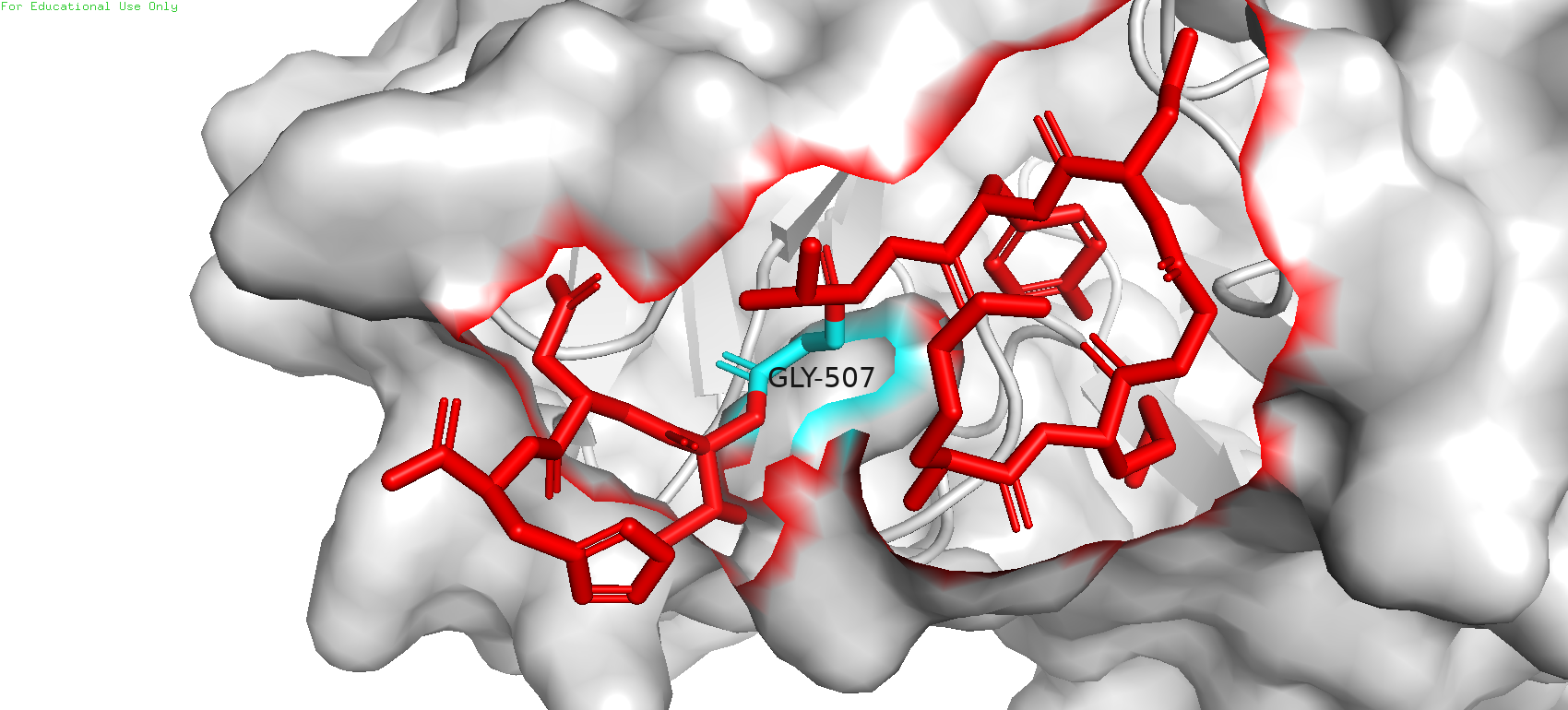
Рис. 5. Взаимодействие белка (серый, отображён surface) с антигеном (красный, отображён sticks)
Стоит предположить, что раз это взаимодействие антитела с антигеном, то оно должно быть довольно прочным, поэтому для начала стоит рассмотреть, какие остатки находятся вблизи исследуемой области, чтобы можно было предположить о характере взаимодействий.
Рядом с исследуемой позицией не было обнаружено каких-либо остатков, которые могли бы служить донорами или акцепторами водородной связи, в особенности в области "кармашка". Однако можно заметить "нависающий" тирозин-405, что может намекать на наличие стэкинг-взаимодействия или пи-водородной связи. Следовательно, в превую очередь можно попробовать прогнать по ротамерам ароматических аминокислот.
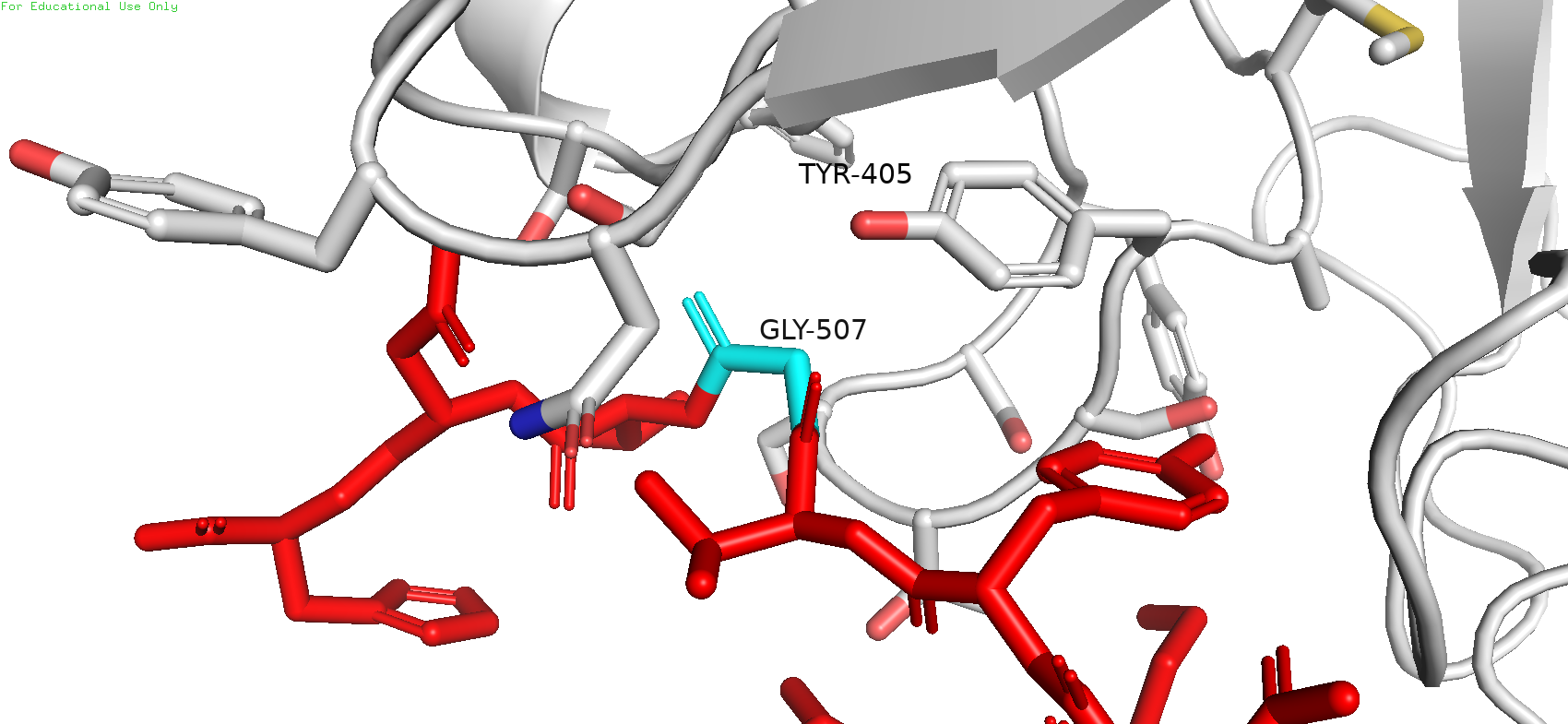
Рис. 6. Соседи GLY-507 и предполагаемый участник стэкинг-взаимодействия (TYR-405)
Но при попытке подставить в это место ароматические остатки стали возникать проблемы. Ротамеры таких аминокислот как тирозин, фенилаланин и гистидин порой просто не попадали в карман, а варианты с наибольшей представленностью (у фенилаланина такой параметр достигал 84.4%) имели довольно большой strain (в случае того же ротамера фенилалнина 82.59), и к тому же чисто визуально они просто не могли бы таким образом располагаться.
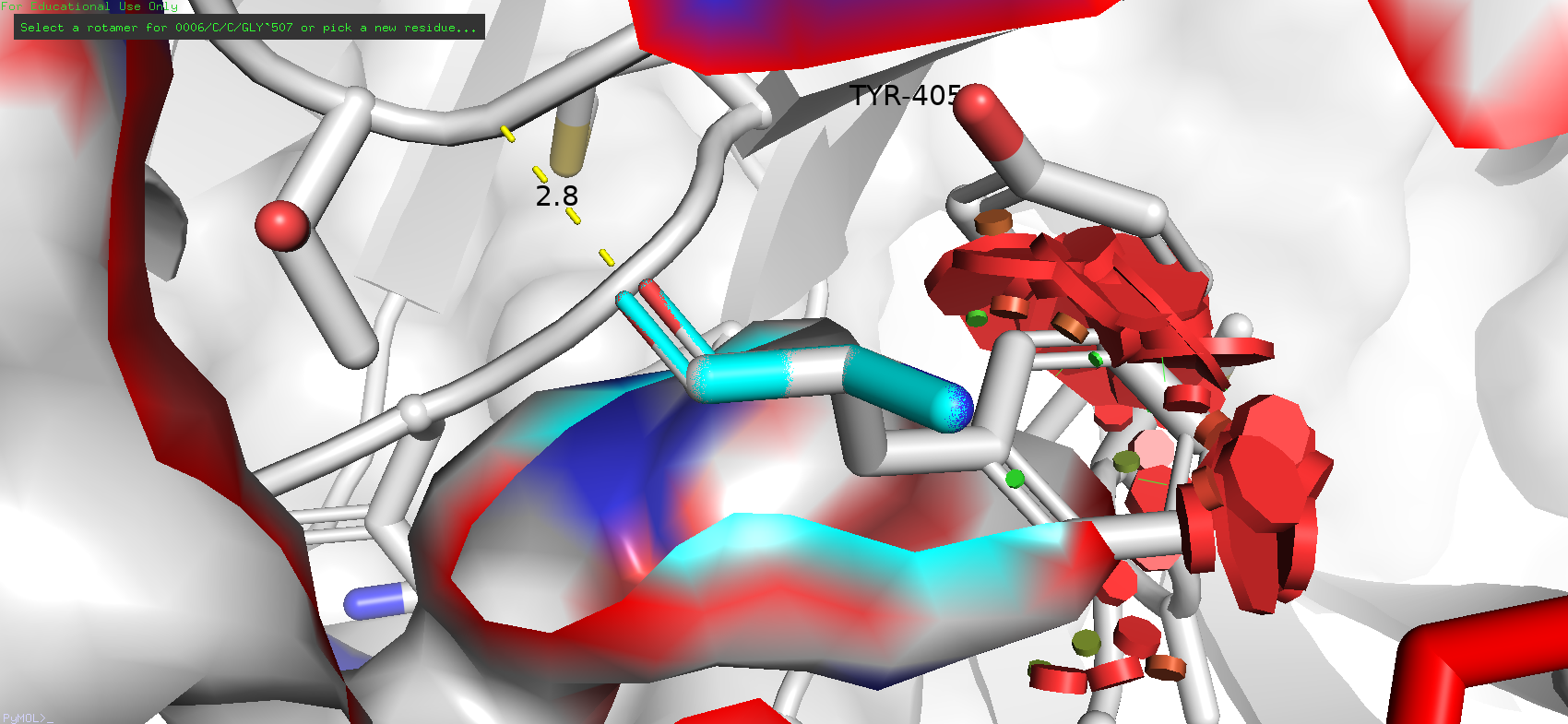
Рис. 7. Наиболее представленный ротамер фенилаланина (для облегчения восприятия была убрана остаточная цепь антигена из поля зрения и оставлен только исследуемый остаток)
В случае триптофана к сожалению также не нашлось вариантов, которые бы идеально подходили. Самый представленный вариант вообще как будто бы пронзал собой кольцо тирозина, и вполне логично что у него был довольно гигантский strain (96.38)
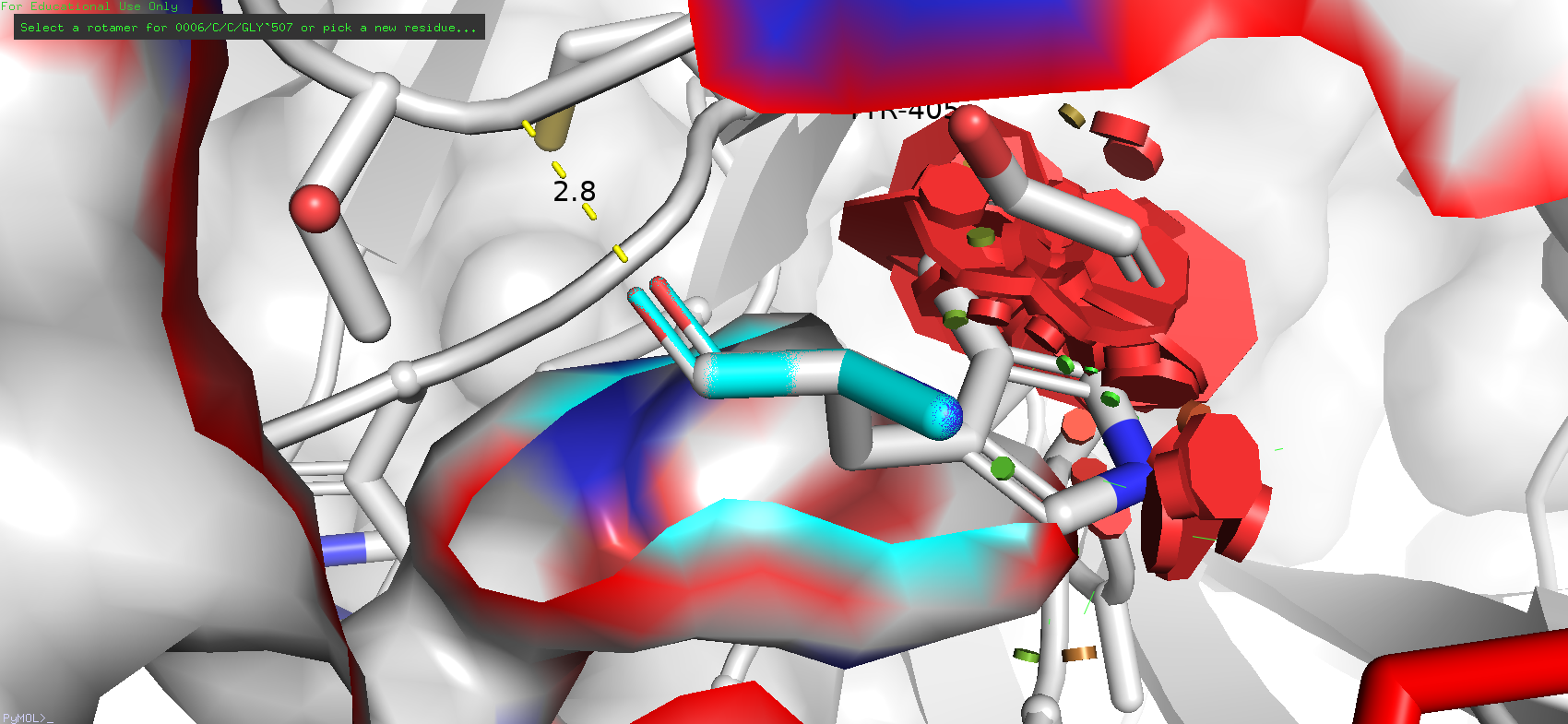
Рис. 8. Наиболее представленный ротамер триптофана
При этом среди них был вариант, 4-й по распространённости,который на первый взгляд располагается более-менее удачно, и вроде как даже способен образовывать Т-стекинг с тирозином-405, но всё же он довольно близко располагается к петле белка, расположенной позади, и strain всё равно довольно немалый (41.78). Следовательно, стоит рассмотреть другие варианты.
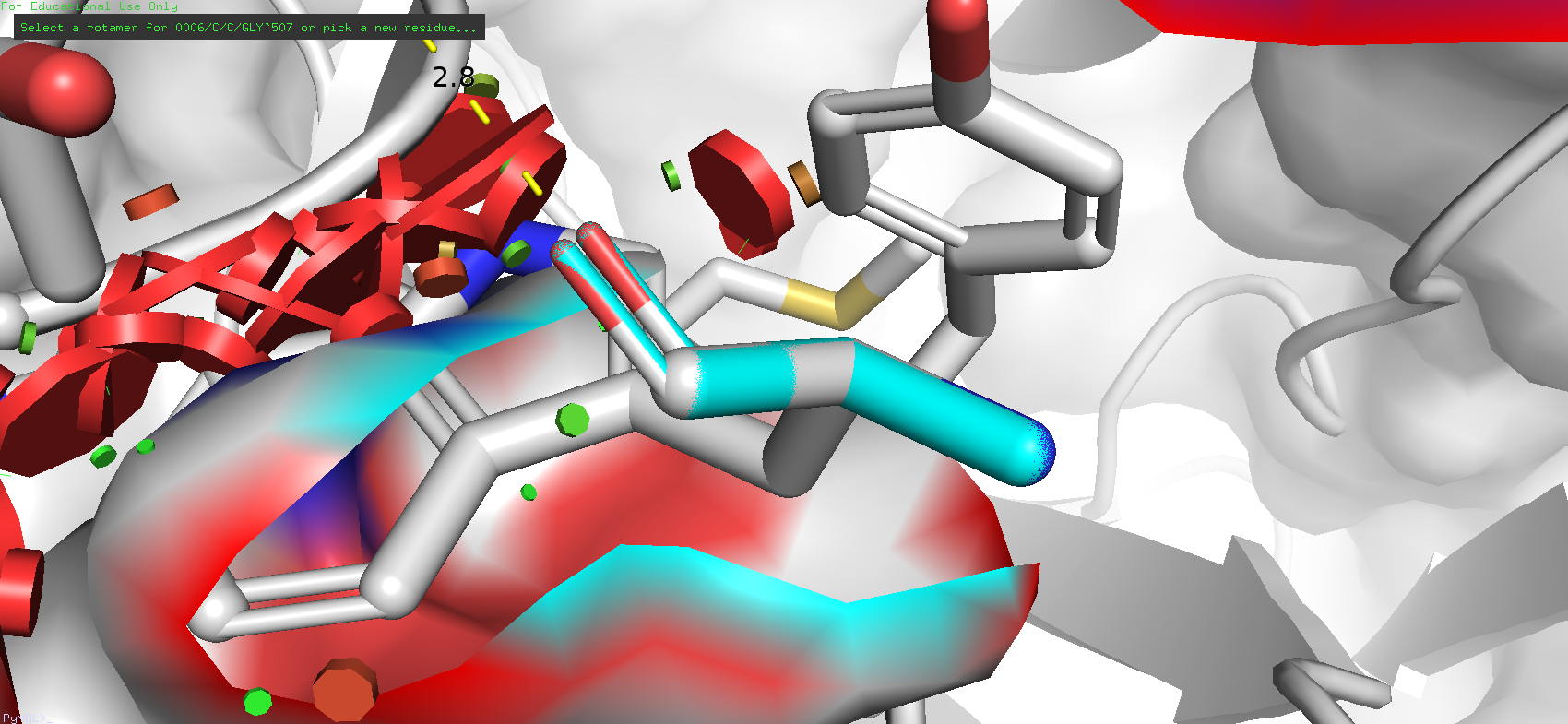
Рис. 9. Четвёртый по распространённости ротамер триптофана
В следующей попытки были перебраны различные варианты полярных аминокислот. Однако практически никто из них не смог подойти. самые распространённые варианты имели довольно большой показатель strain, при этом если у ротамра он был маленький, то как правило он был очень мало распространённый (около 2-4 %) и совсем не взаимодействовал с тирозином. Попался лишь один вариант с аспарагином, где он с большой натяжечкой может хоть как-то взаимодействовать с тирозином (предположительно пи-катионный стэкинг), но его представленность составляет всего 4.9 %, при этом strain составляет 21.25. Такой вариант очень мало похож на правдоподобный.
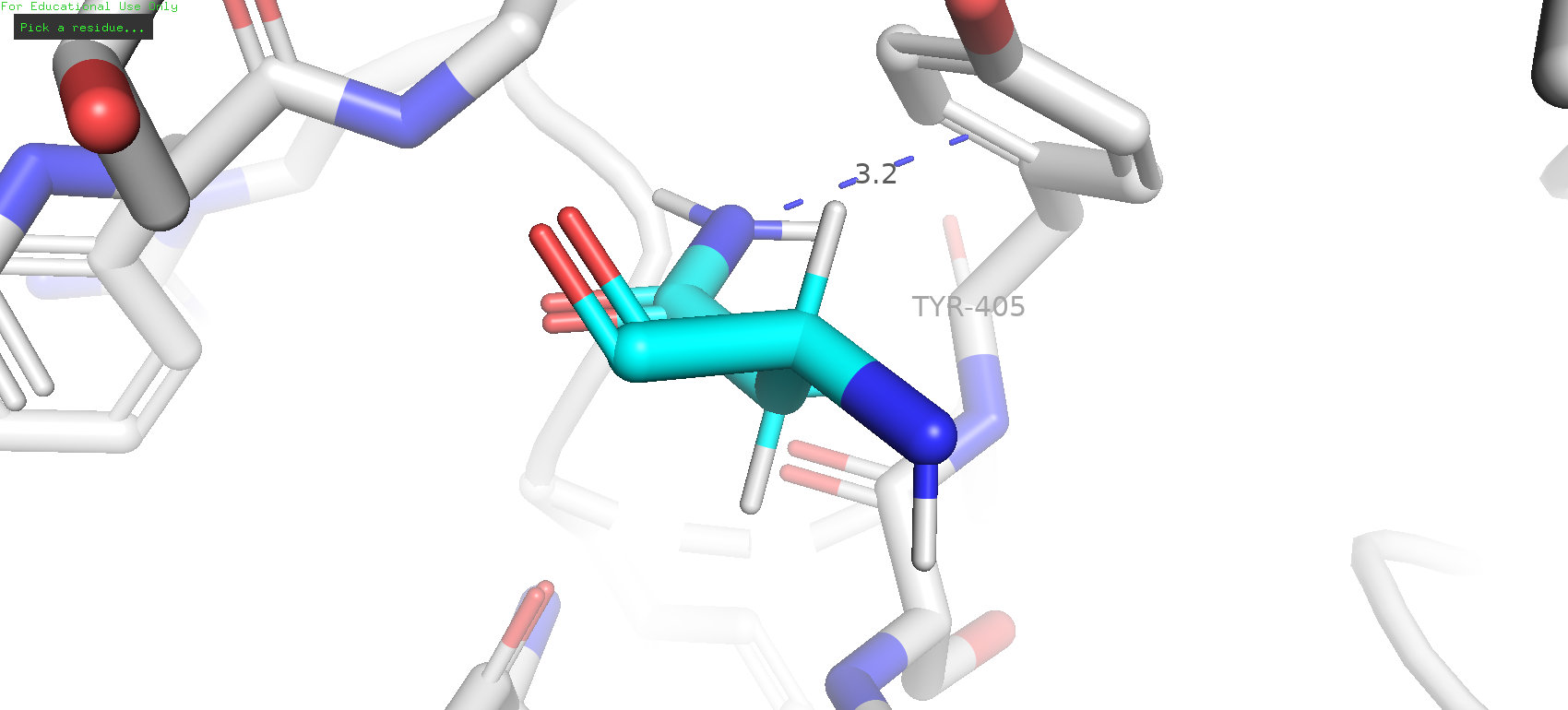
Рис. 10. Шестой по представленности ротамер аспарагина
Был опробован вариант мутации в серин. Самый распространённый ротамер (42 %) имел strain 21.19, при этом вроде как даже мог образовывать пи-водородную связь с тирозином, но всё же его стерическая напряжённость довольно выскокая, и сам по себе плохо вписывается в карман.
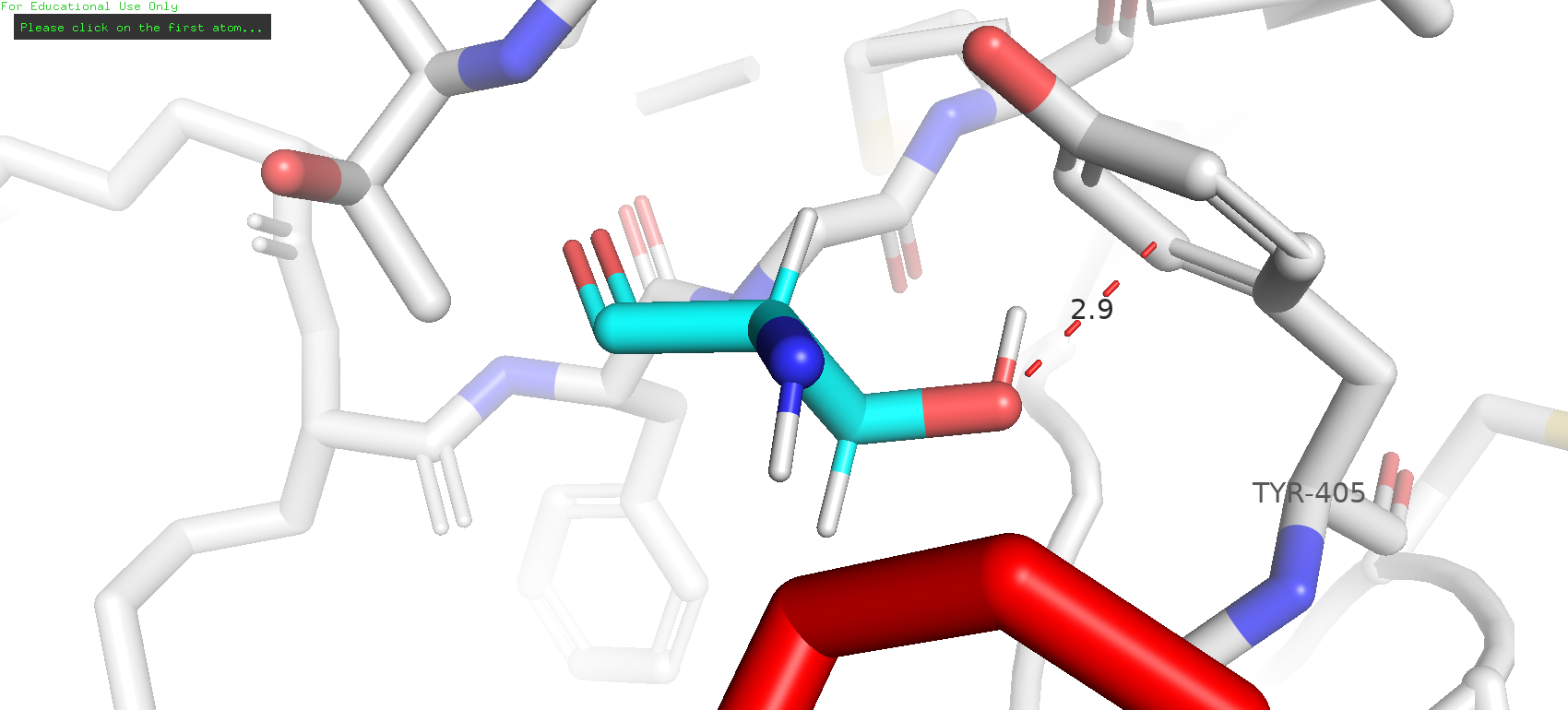
Рис. 11. Самый представленный ротамер серина
Также был рассмотрен вариант с аспарагиновой кислотой. В данном случае позиция всё же не сильно удачная, однако, если тирозин мог бы совсем немного повернуться (поскольку водород находится в плоскости), то его атом кислорода мог бы служить донром водородной связи, а акцептором мог бы быть атом OD1 аспартата. При этом такой вариант третий по распространённости (9.8 %) и strain составляет всего лишь 11.95. При этом также стоит учитывать, что инсрумент mutagenesis при изменении аминокислоты не учитывает изменение остова, поэтому всё же может присутствовать некоторая погрешность в расположении остатка.
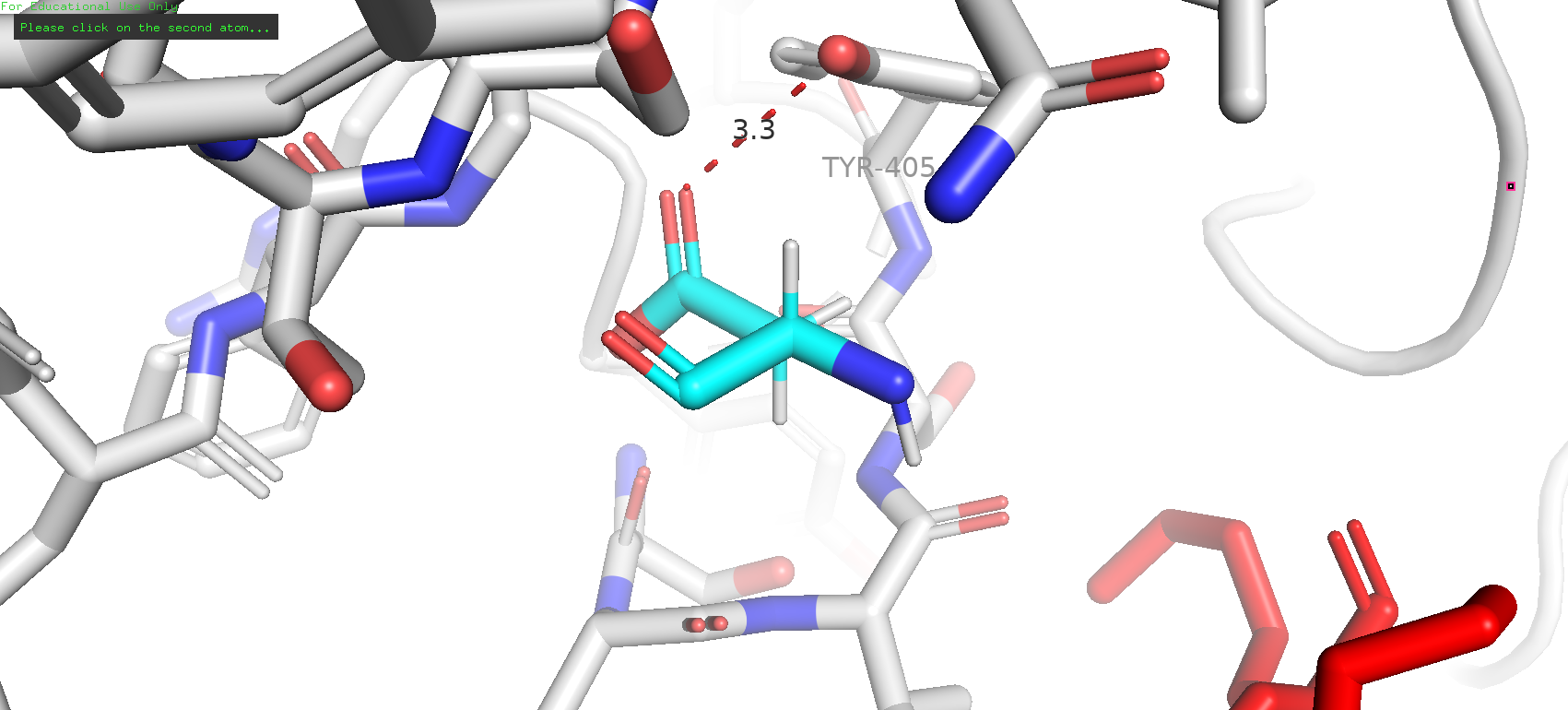
Рис. 12. Третий по представленности ротамер аспарагиовой кислоты
При этом в карман данный остатко в принципе вписывается, но не очень хорошо. По крайней мере, по сравнению с остальными, вариант с аспартатом в таком положении мне показался наиболее удачным, хотя и тоже не идеальным.
Также был рассмотрен вариант с треонином. Второй по представленности ротамер (35,5 %) имеет довольно низкий strain (всего лишь 12.51), и к тому же способен образовывать пи-водородную связь с ароматическим кольцом тирозина. Он довольно хорошо вписывается в карман, хотя и не совсем иделаьно, но при этом стоит вспомнить про погрешность режима mutagenesis, который не учитывает изменения остова при замене остатка. Поэтому, как мне кажется, вариант с треонином может быть наиболее правдоподобным.
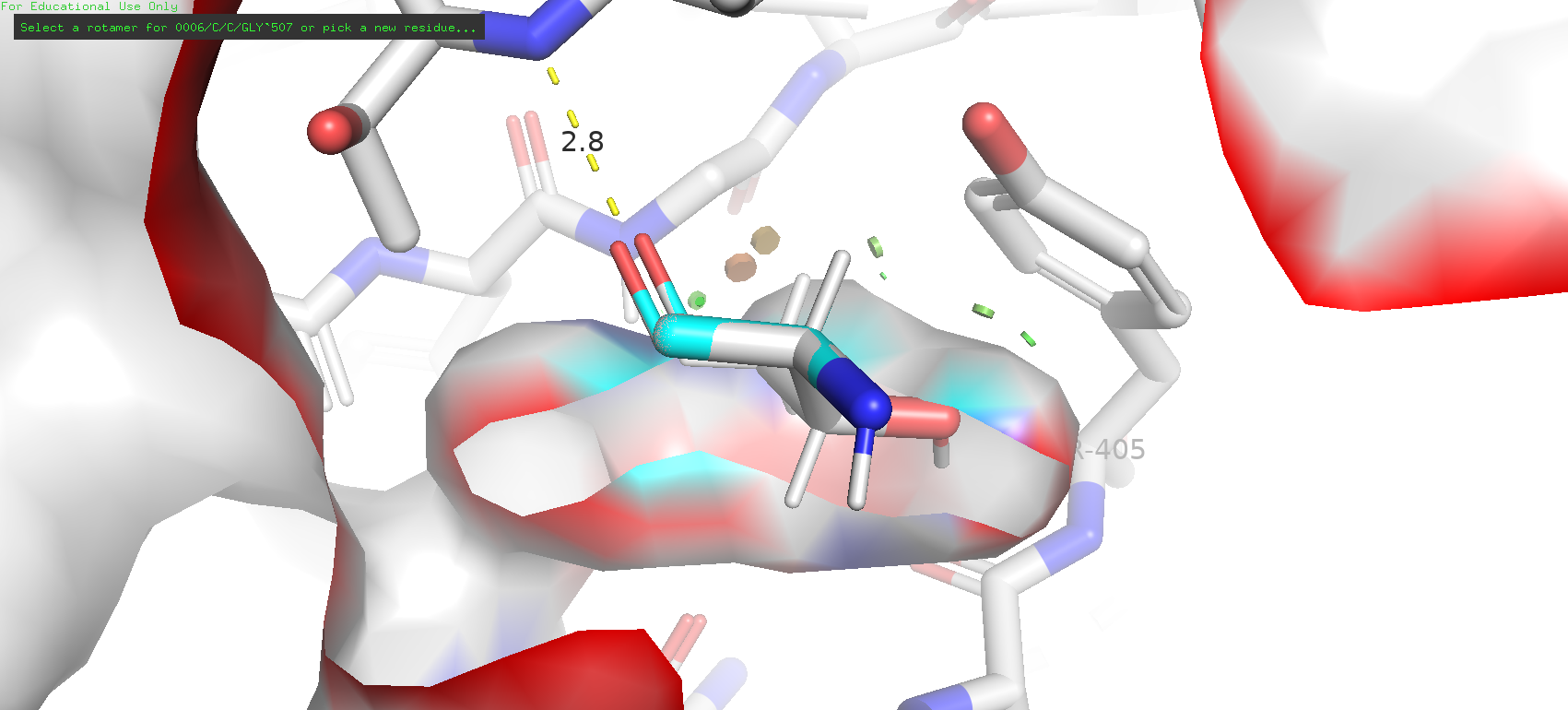
Рис. 13. Второй по представленности ротамер треонина
Теперь посмотрим, какой же остаток находился в данном месте на самом деле.
Если же из полярных аминокислот никто не может нормально подойти в этот карман, то вполне вероятно, что здесь может находиться гидрофобный остаток. Так оно и оказалось - в данном месте располагался валин.
Первый по представленности ротамер (84.3%) имеет довольно неплохой показатель strain - всего лишь 16.39. И несмотря на некоторую кажущуюся стерическую нагруженность (но при этом стоит вспомнить про погрешность, которая вызвана невозможностью изменения положения остова при мутировании остатка), данный валин кажется вполне подходящим для данного участка. Также стоит отметить, что и карман даже в некотором плане повторяет очертания радикала валина, на что тоже стоило бы обратить внимание.
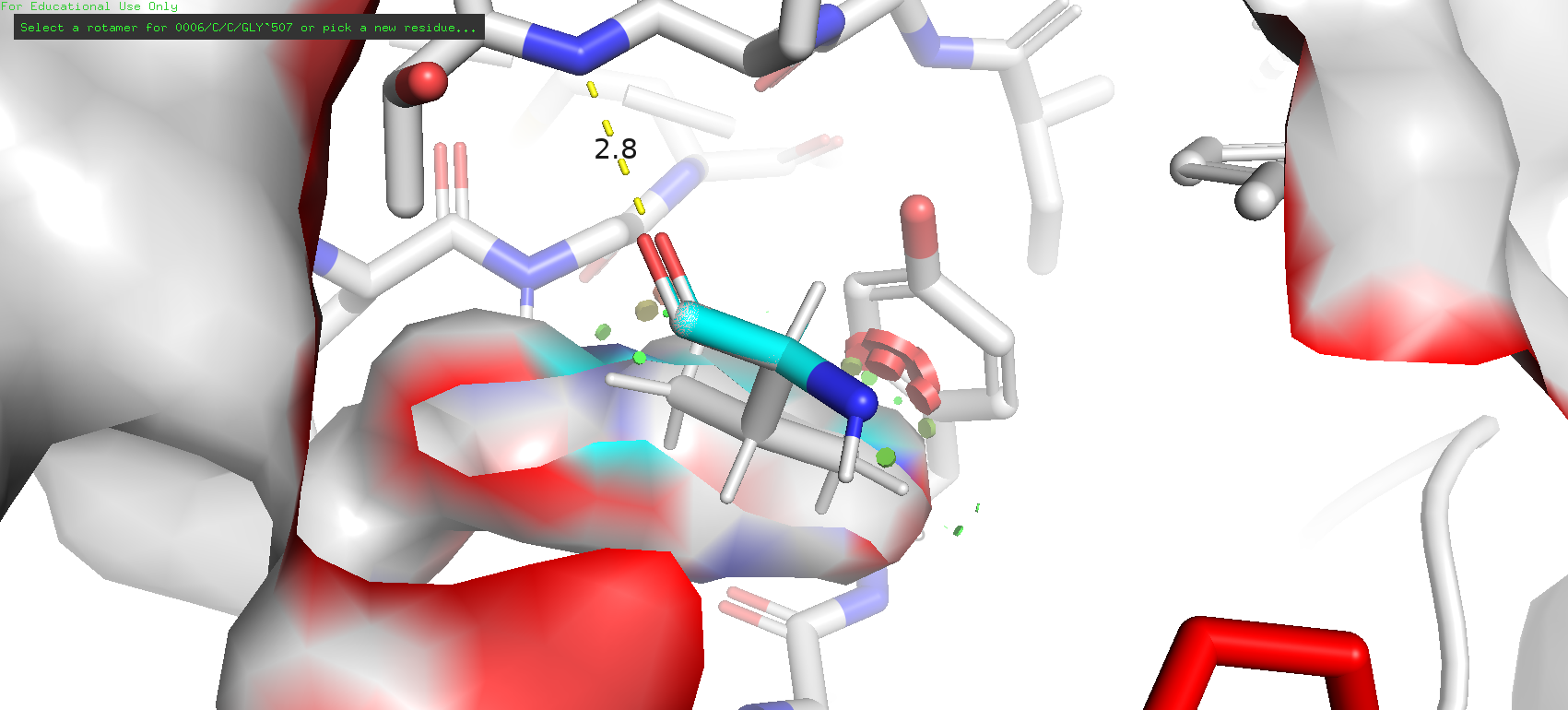
Рис. 14. Первый по представленности ротамер валина
В другой молекуле белка на цепи С в пятом положении также была заменена аминокислота, и нужно выяснить, какая была исходной.
В данном случае наблюдается иная картина. Цепь антигена обозначена зелёным цветом, исследуемая позиция - оранжевым. Можно заметить, что довольно близко к этому месту располагается остаток аргинина-95, и вполне возможно с ним может быть взаимодействие.
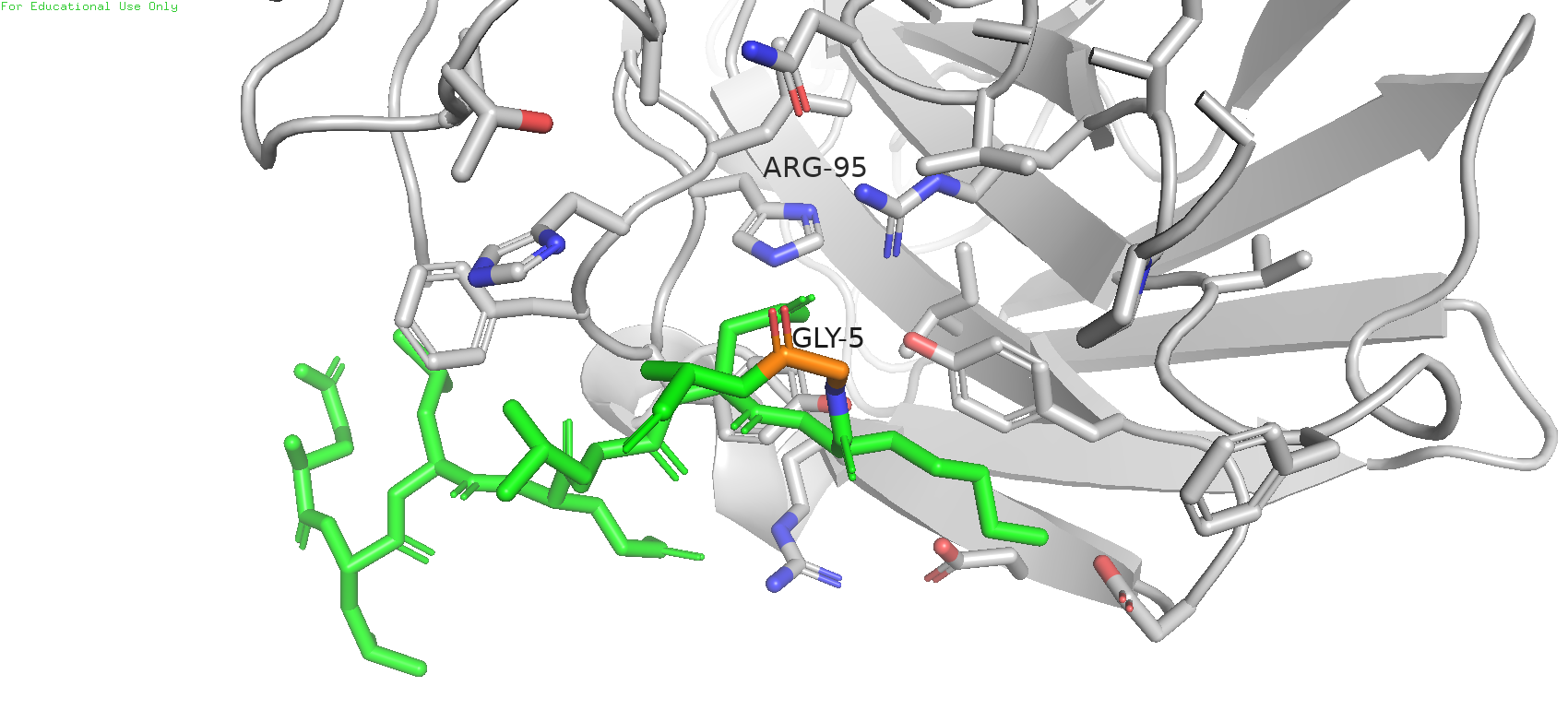
Рис. 15. Расположение антигена в молекуле белка
При отображении поверхности можно даже заметить некоторую "ямку" в сторону аргиниа. Поэтому можно попробовать поискать исходную аминокислоту среди полярных остатков.
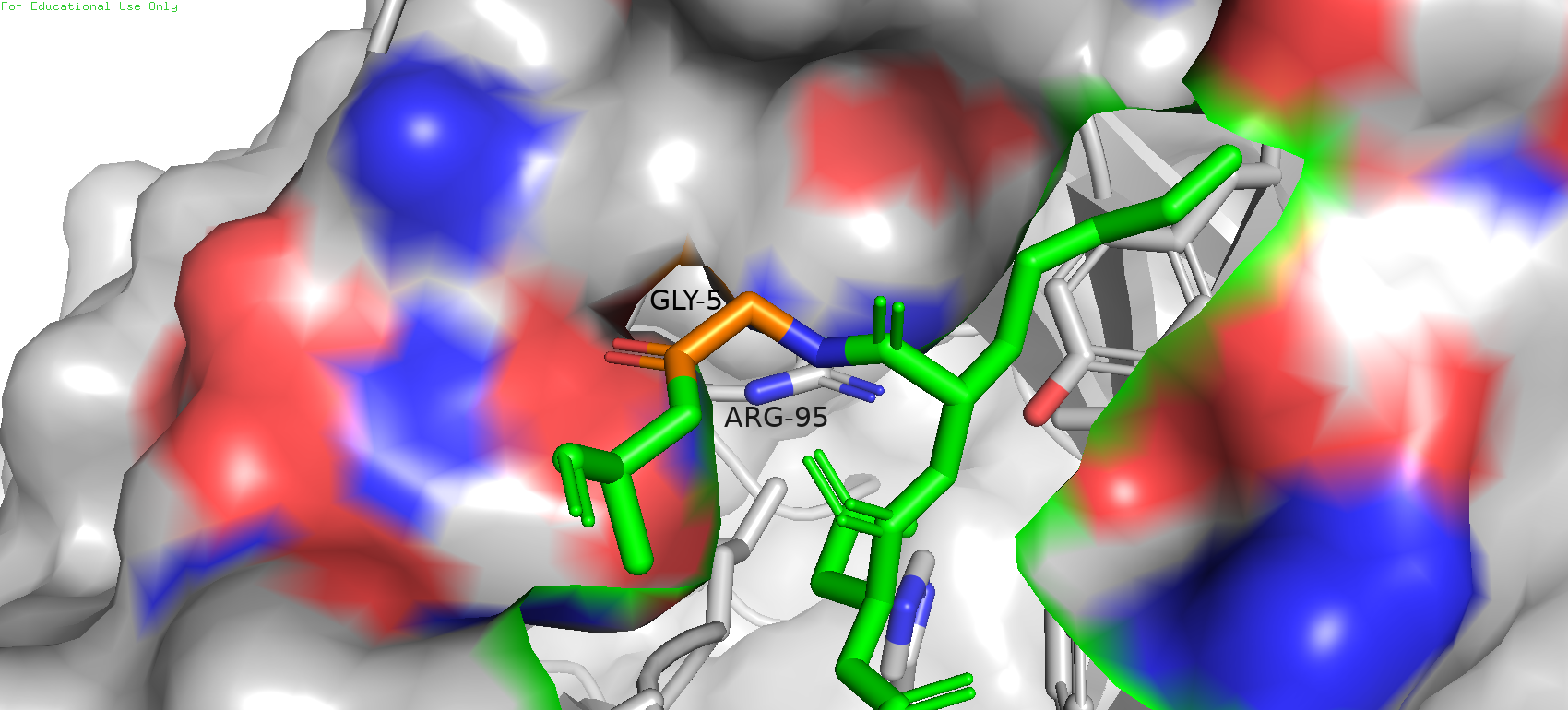
Рис. 16. Отображение поверхности.
Аргинин в большинстве своём демонстрирует довольно большой strain и маловероятно что может здесь располагаться. В случае же аспарагина практически все ротамеры были на довольно большом отдалении от аргиниа и не могли образовывать связи, или же имели довольно ощутимый strain. Похожая ситуация обстоит и с глутамином, однако самый последний ротамер имеет вероятность образования солевого мостика, но при этом strain данного варианта составляет 26.21, а представленность - 1.3 %, следовательно такой вариант не правдоподобен.
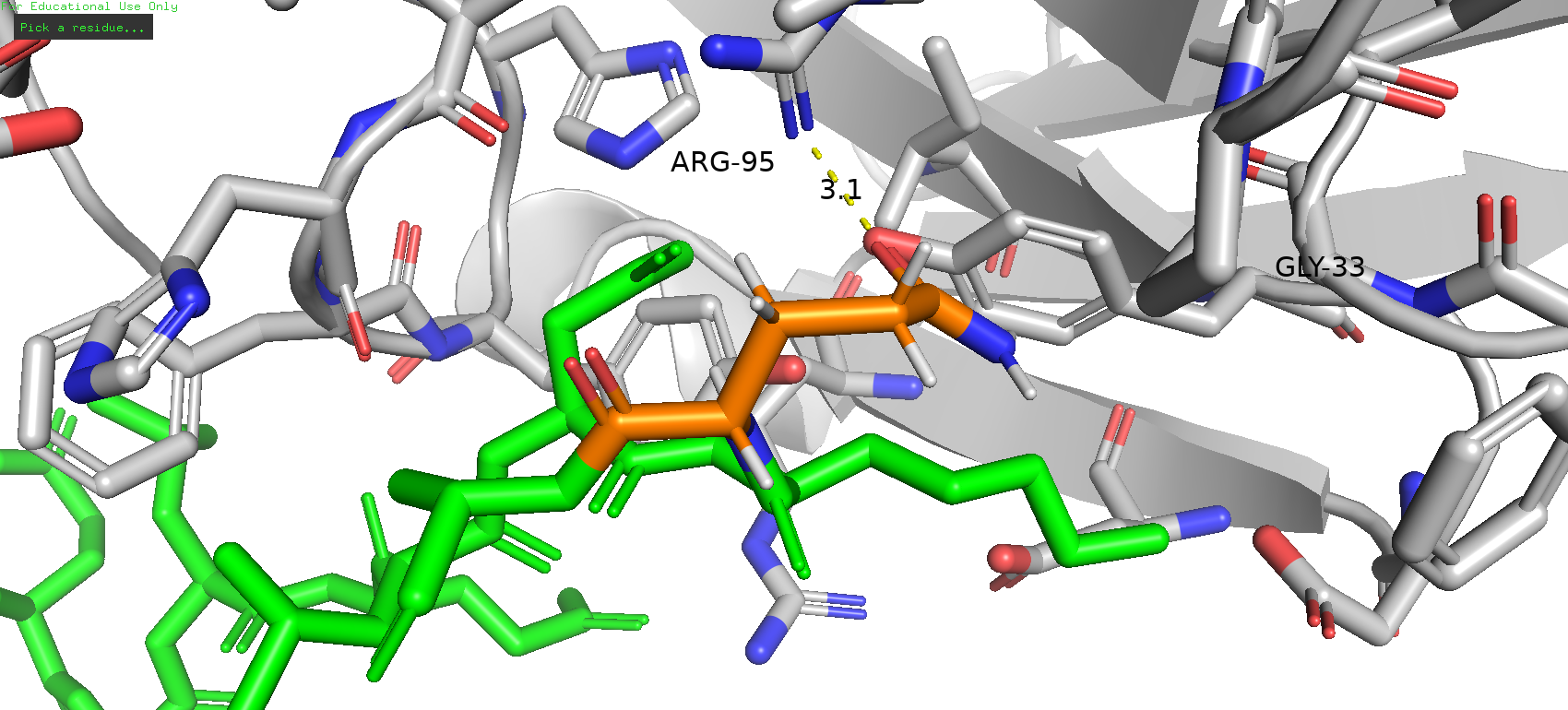
Рис. 17. Наименее представленный ротамер глутамина
В случае же выбора глутамата также возможно образование солевого мостика, при этом наиболее подходящим является 7-й по представленности ротамер. И несмотря на то, что он вполне хорошо вписывается в карман, всё же представленность в 3.2% и strain 22.49 оставляют некоторые сомнения.
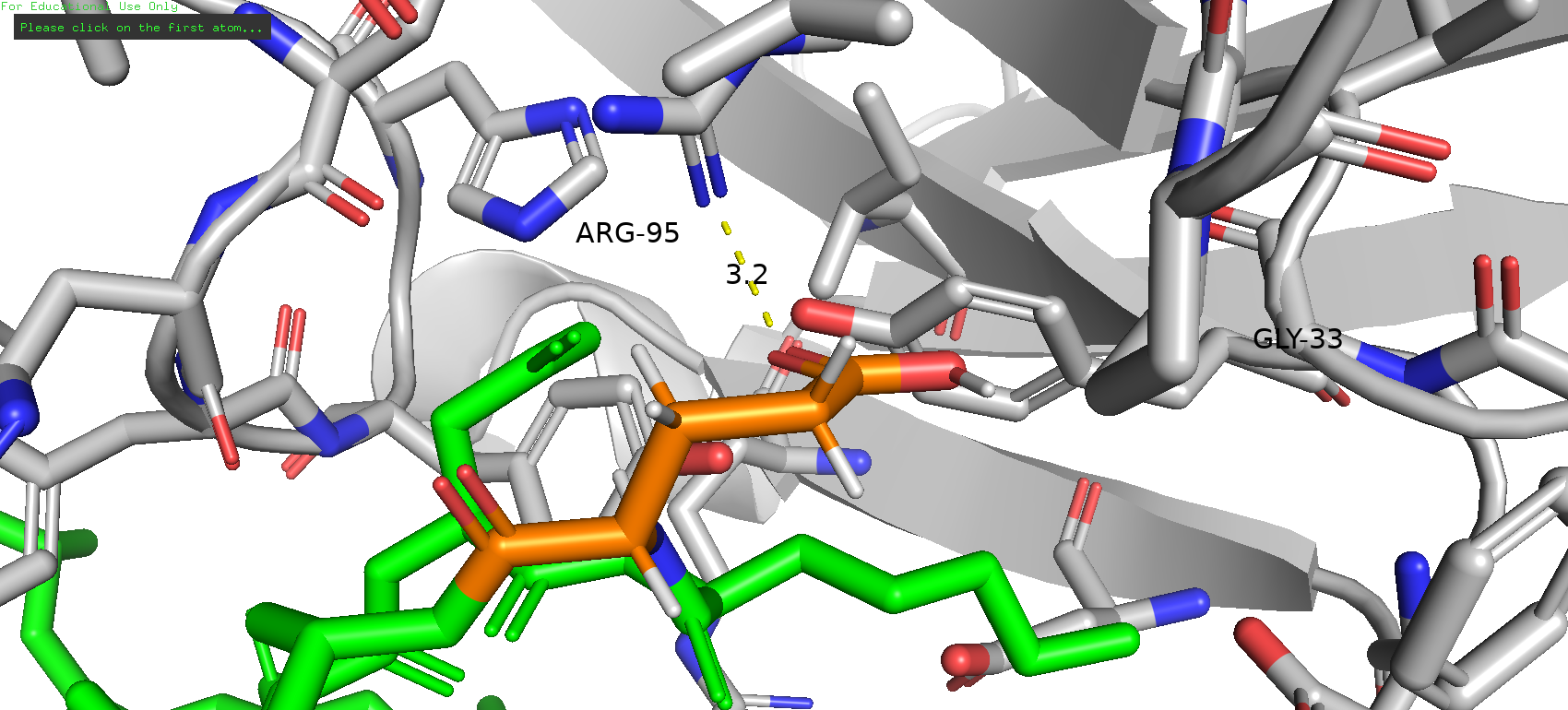
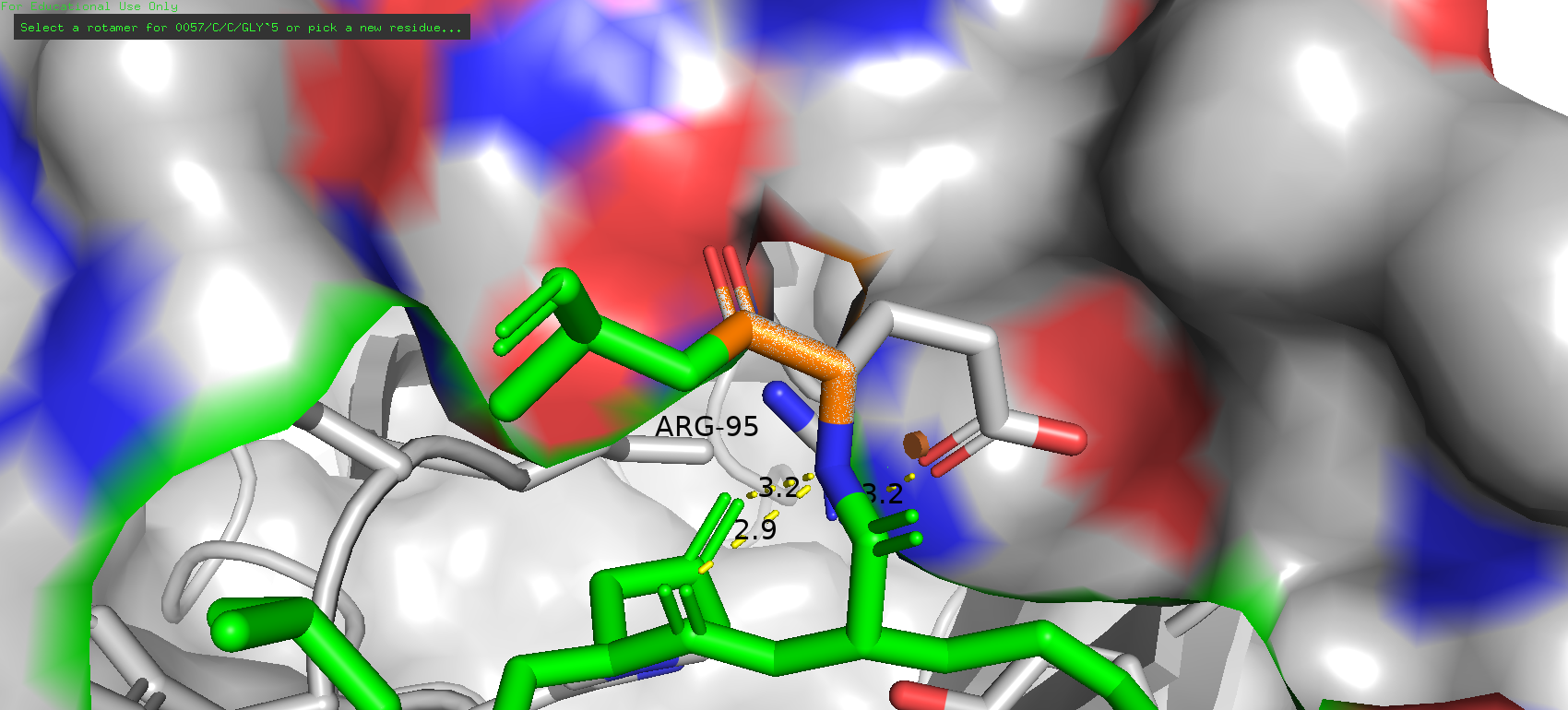
Рис. 18. 7-й по представленности ротамер глутаминовой кислоты
Однако если попробовать встроить лизин, то окажется, что он вполне может образовывать водородную связь с атомам кислорода остова глицина 33. При этом strain составляет 19.58, для 3-го по распространённости ротамера (9.7 %). Как мне кажется, такой вариант может быть вполне вероятным, и в карман данный остаток довольно удачно укладывается.
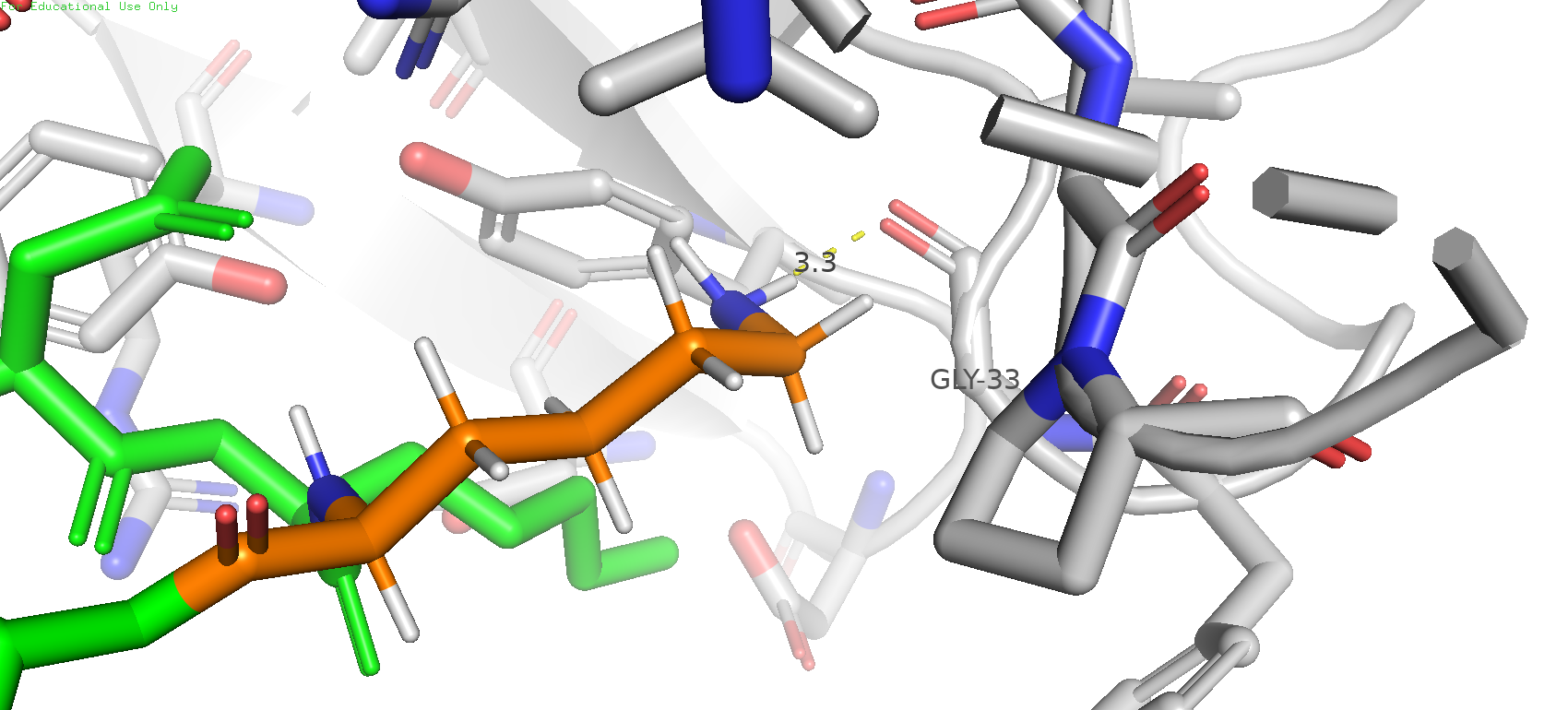
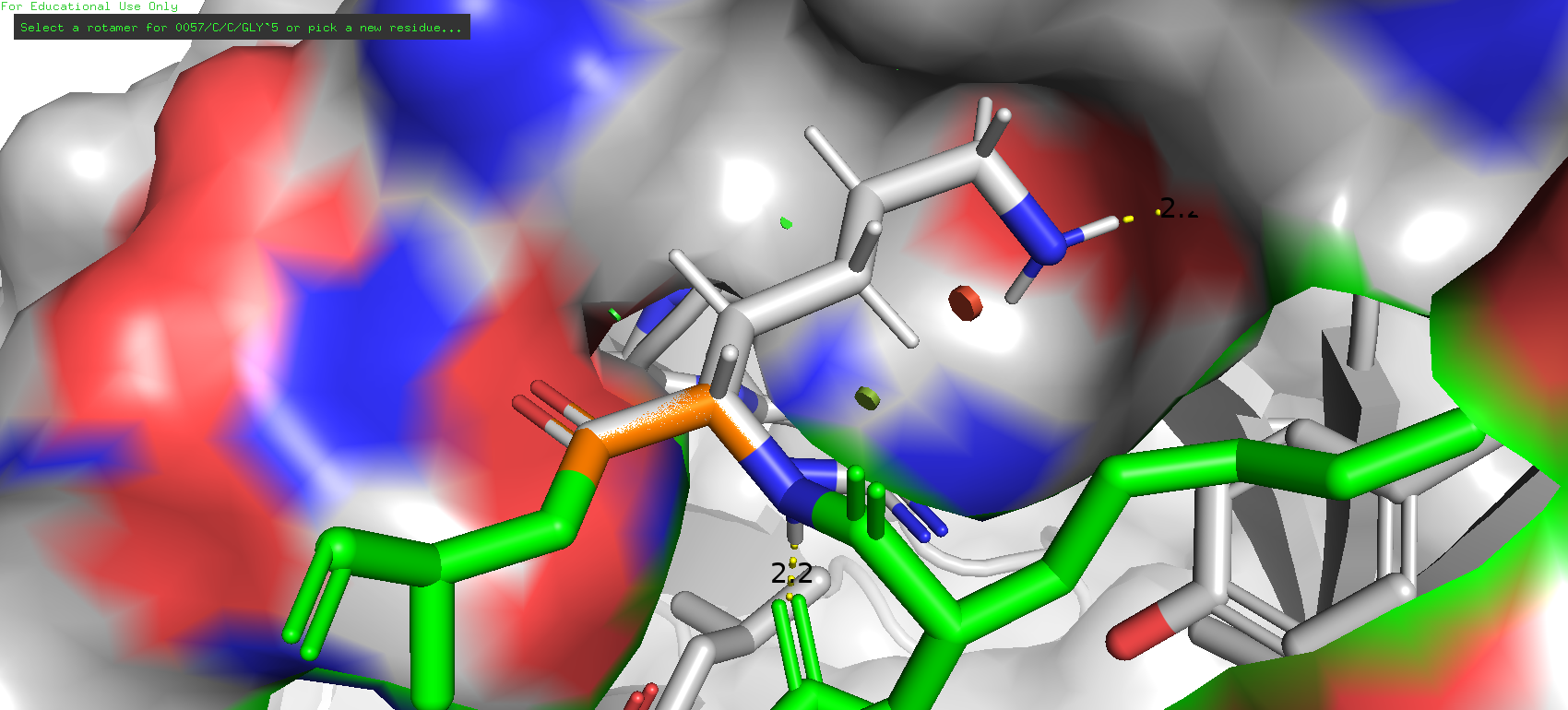
Рис. 19. 3-й по представленности ротамер лизина
Также был рассмотрен вариант с гистидином. Для него не удалось обнаружить каких-либо взаимодействий, однако из всех рассмотренных вариантов у него оказались лучшие характеристикаи - у самого распространённого ротамера (49 %) starin оказался 16.76, довольно неплохой результат. Более того, как мне кажется он очень удачно располагается в кармане, очень хорошо в нём сидит.
Рис. 20. Наиболее представленный 3отамер гистидина
Таким образом, наилучшими кандидатами оказались глутамат, лизин и гистидин. Вполне возможно, что на самом деле там может располагаться другая аминокислота, всё же это всего лишь предположение, основанное на анализе структуры и взаимодействий. Лизин кажется довольно вероятным в данной позиции, и водородная связь подкрепляет это предположение, однако всё же хочется высказаться больше в пользу гистидина, поскольку он действительно очень хорошо сидит в этом кармане. Да, связей не образует, но вполне может способствовать специфичности благодаря своей форме.
В данном же случае правильным остатком оказался триптофан.
В первую очередь стоило обратить внимание, что в рассматриваемом участке было довольно немало гидрофобных остатков, причём близко расположенных, что вполне могло спосбствовать образованию гидрофобных взаимодействий. Однако при просмотре ротамеров триптофана возникла довольно подозрительная картина: самый его распространённый ротамер (50.5%) имел strain 35.32, что является не вполне удовлетворительным, к тому же возможны и стерические затруднения с остатком пролина. Да и сам остаток как будто немного "парит" над своим карманом. Хотя опять же, возможно всё дело в погрешностях.
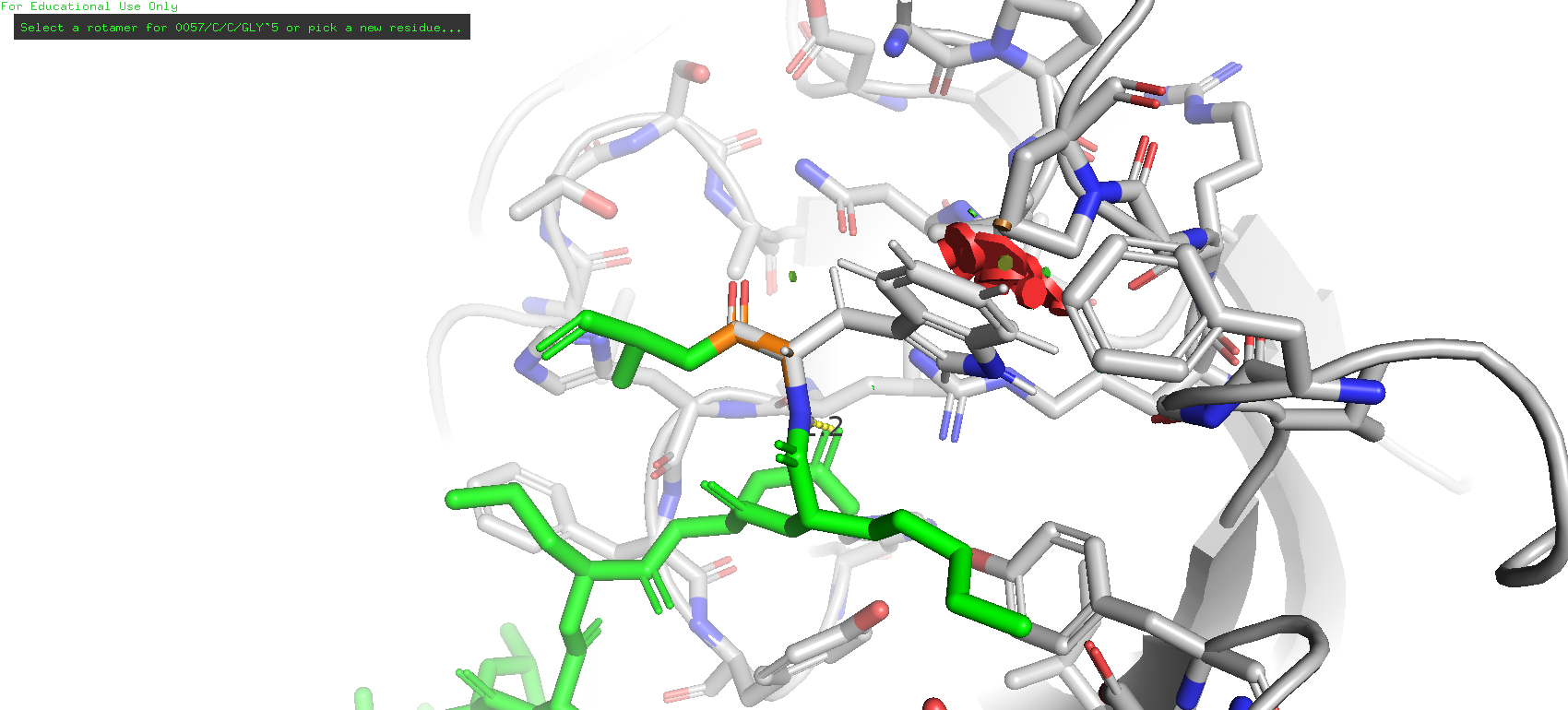
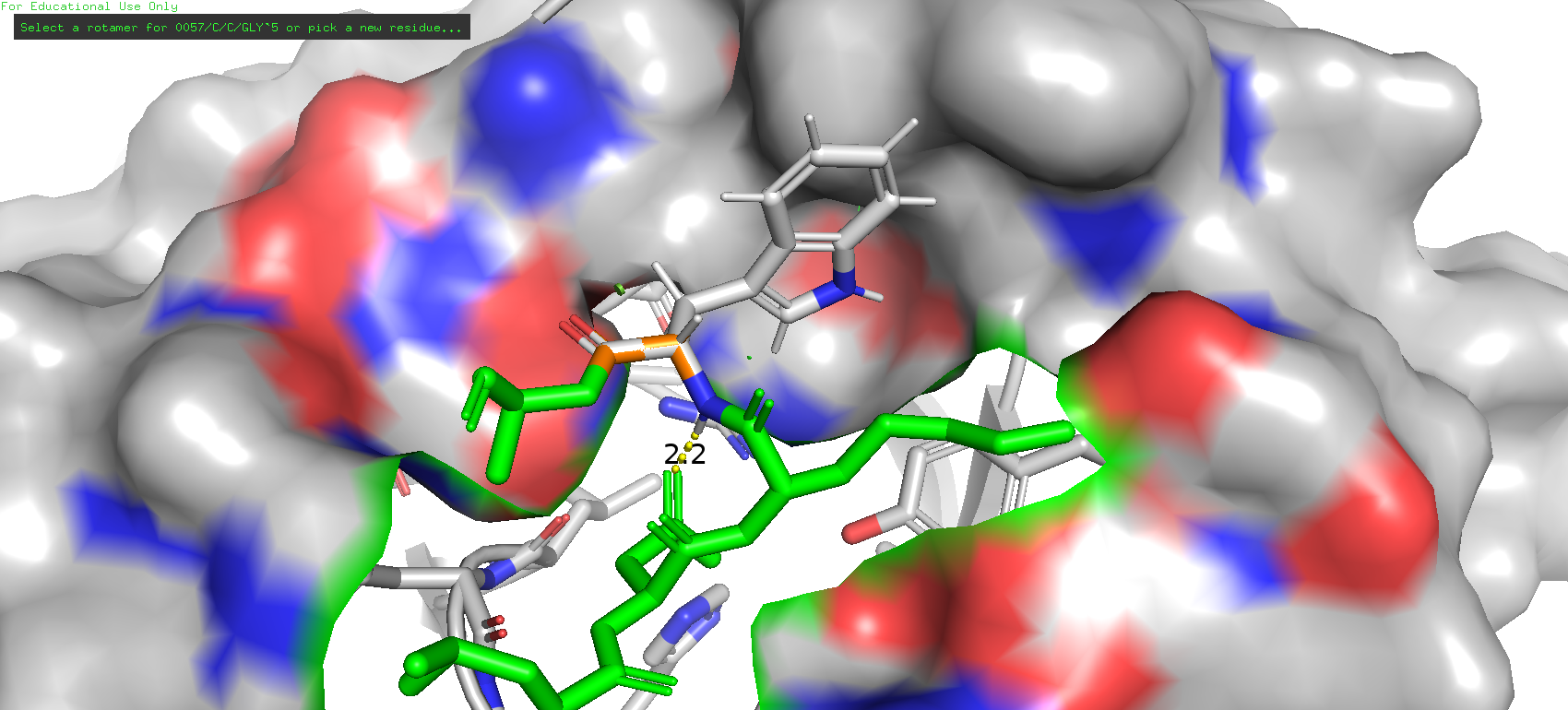
Рис. 21. Самый представленный ротамер триптофана
© Иззи Антон,2020